Шины и диски для Lada Granta 2022 1.6i 2190x Facelift, размер колёс на Лада Гранта 1.6i 2190x Facelift
Наиболее популярные модели шин для Lada Granta
Cordiant Snow Cross 175/65 R14 82T
Хит
3 180 ₽
Windforce Snowblazer 175/65 R14 82T
Хит Новинка
2 950 ₽
3 390 ₽
Tracmax X-Privilo S130 175/65 R14 86T XL
Хит Новинка
2 530 ₽
3 290 ₽
Кама 505 175/65 R14 82T
Хит
2 620 ₽
2 890 ₽
Windforce Ice-Spider (Нешип) 175/65 R14 86T XL
Хит Новинка
2 850 ₽
Cordiant Snow Cross 2 175/65 R14 86T
Хит
3 030 ₽
3 680 ₽
Sailun Ice Blazer WST3 185/60 R14 82T
Хит
3 280 ₽
Triangle TI501 IceLynX 175/65 R14 86T XL
Хит Новинка
4 480 ₽
5 190 ₽
В данный момент для автомобиля Lada Granta на Мосавтошине присутствует 497 модификаций шин со средней оценкой 4. 43/5. Добавить свой отзыв.
43/5. Добавить свой отзыв.
Услуги по ремонту
Другие модели Lada
Lada 110, Lada 111, Lada 1111 Oka, Lada 112, Lada 1200, Lada 1200DL, Lada 1300, Lada 1300SL, Lada 1500, Lada 2104, Lada 2105, Lada 2107, Lada 2108, Lada 2109, Lada 21099, Lada 4X4, Lada 4×4 Bronto, Lada 4×4 Urban, Lada 4×4 Urban, Lada Classics, Lada Fora, Lada Granta, Lada Granta Cross, Lada Granta Sport, Lada Kalina Cross, Lada Kalina Sport, Lada Largus Cross, Lada Nadezhda, Lada Niva, Lada Niva Bronto, Lada Niva II, Lada Niva II, Lada Niva Legend, Lada Niva Travel, Lada Nova, Lada Priora, Lada Riva, Lada Samara, Lada Taiga, Lada Vesta, Lada Vesta Cross, Lada Vesta Sport, Lada Vesta SW, Lada Vesta SW Cross, Lada XRay, Lada XRAY Cross, Lada Калина, Lada Калина Кросс, Lada Ларгус, Lada Ларгус Кросс,Подбор шин и дисков для автомобиля Lada Granta 2022 1.6i 2190x Facelift
Подбор шин и дисков для автомобиля Lada Granta 1.6i 2190x Facelift 2022 позволяет снизить практически до минимума возникновение различных сложностей, связанных с тем, что очень многие автовладельцы при самостоятельном выборе таких изделий нередко допускают ошибки.
Технические характеристики Lada Granta (Лада Гранта)
Новая Лада Гранта построена на базе модели Калина, вначале автомобиль будет выпускаться в кузове седан, а с 2013 года появится и хэтчбек.
Автомобиль предлагается в трех комплектациях: «Стандарт», «Норма» и «Люкс». Версия в комплектации «Стандарт» получила 1,6-литровый мотор от Калины, две другие предлагаются с новым 8-клапанным силовым агрегатом объемом 1,6 литра мощностью 80 и 90 л.
Все варианты двигателей работают на бензине АИ-95, их средний расход от 8,7 до 9,3 литров на сотню в городе, от 5,8 до 6,1 литра — за городом и от 7,2 до 7,3 литров — в смешанном цикле.
Максимальная скорость самой мощной модификации Лады Гранта, по данным производителя, составляет 168,5 км/ч. Разгон с места до сотни у нее же занимает 12,0 секунд.
Более подробные технические характеристики Лада Гранта смотрите в приведенной ниже таблице. Стоимость Лада Гранта можно узнать в соответствующем разделе сайта.
| Автомобиль | Лада Гранта (ВАЗ-2190) | ||
| Модификация | «Стандарт» | «Норма» | «Люкс» |
| Тип кузова | Четырехдверный седан | ||
| Число мест | 5 | ||
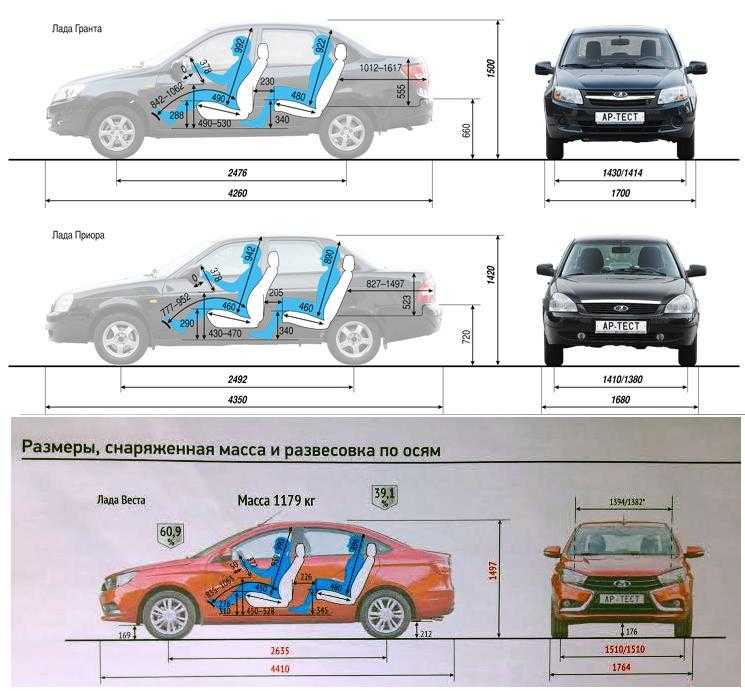
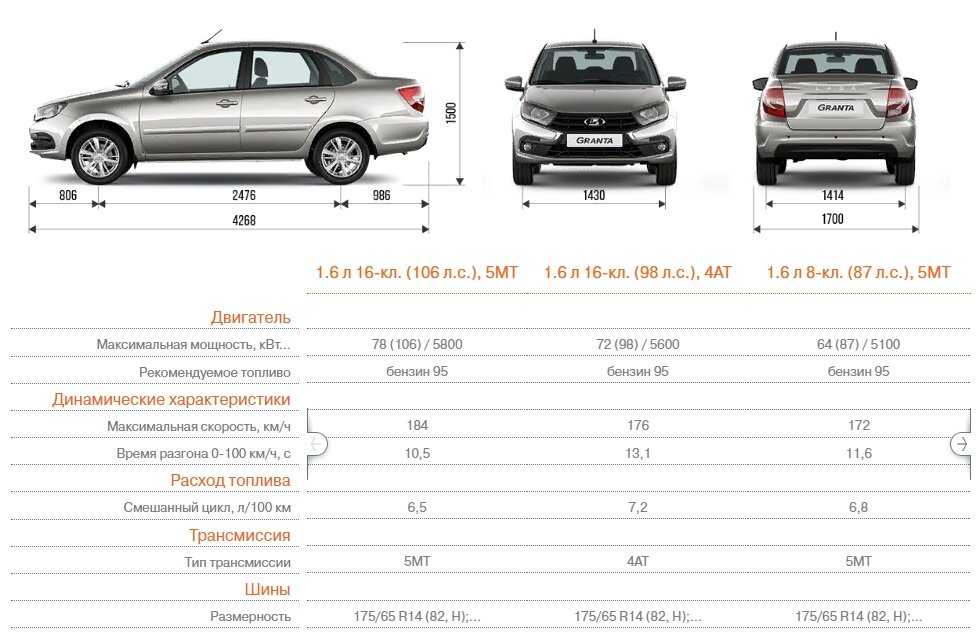
| Длина, мм | 4260 | ||
| Ширина, мм | 1700 | ||
| Высота, мм | 1500 | ||
| База, мм | 2470 | ||
| Колея передняя, мм | 1430 | ||
| Колея задняя, мм | 1410 | ||
| Педений свес, мм | 810 | ||
| Задний свес, мм | 980 | ||
Мин. дорожный просвет, мм дорожный просвет, мм | 160 | ||
| Объем багажника, л | 500 | ||
| Масса снаряженная, кг | 1040 | 1080 | 1100 |
| Распределение снаряженной массы по передней/задней осям, % | 59/41 | 59/41 | 59/41 |
| Полезная нагрузка, кг | 475 | ||
| Полная масса, кг | 1515 | 1555 | 1575 |
| Распределение полной массы по передней/задней осям, % | 50/50 | 50/50 | 50/50 |
| Масса прицепа с тормозами/без тормозов, кг | 900/450 | ||
| Коэффициент аэродинамического сопротивления | 0,367 | 0,353 | |
| Двигатель | Бензиновый, с распределенным прыском | ||
| Обозначение двигателя | ВАЗ-11183 | ВАЗ-21116 | |
| Расположение | спереди, поперечно | ||
| Число и расположение цилиндровов | 4, в ряд | ||
| Рабочий объем, см3 | 1597 | ||
| Диаметр цилиндра/ход поршня, мм | 82,0/75,6 | ||
| Степень сжатия | 9,8:1 | 10,5:1 | |
| Число клапанов | 8 | ||
Максимальная мощность, л. с./кВт/об/мин с./кВт/об/мин | 80/59/5600 | 90/66/5600 | |
| Максимальный крутящий момент, Нм/об/мин | 132/3500 | 143/3500 | |
| Коробка передач | механическая, 5-ступенчатая | ||
| Привод | передний | ||
| Передняя подвеска | независимая, пружинная, McPherson | ||
| Задняя подвеска | полузависимая, пружинная | ||
| Передние тормоза | дисковые, вентилируемые | ||
| Задние тормоза | барабанные | ||
| Шины | 175/70 R13 | 175/65 R14 | |
| Максимальная скорость, км/ч | 164,5 | 167,0 | 168,5 |
| Время разгона от 0 до 100 км/ч, с | 12,5 | 11,8 | 12,0 |
| Расход топлива, л/100км | |||
| — в городском режиме | 9,3 | 8,5 | 8,7 |
| — в загородном режиме | 6,1 | 5,7 | 5,8 |
| — в смешанном режиме | 7,3 | 7,2 | 7,3 |
| Выбросы CO2, г/км (смешанный цикл) | 177 | 164 | 164 |
| Емкость топливного бака, л | 50 | ||
| Топливо | Бензин АИ-95 | ||
Скачать руководство по эксплуатации Лада Гранта
Tweet |
Конформационная гетерогенность и интерпретация данных FRET для размеров несвернутых белков
1. Харан Г. Как, когда и почему белки разрушаются: связь со складкой. Курс. мнение Структура биол. 2012; 22:14–20. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Харан Г. Как, когда и почему белки разрушаются: связь со складкой. Курс. мнение Структура биол. 2012; 22:14–20. [Бесплатная статья PMC] [PubMed] [Google Scholar]
2. Шулер Б., Хофманн Х. Спектроскопия одиночных молекул динамики сворачивания белка — расширение масштабов и временных масштабов. Курс. мнение Структура биол. 2013; 23:36–47. [PubMed] [Google Scholar]
3. Gelman H., Gruebele M. Кинетика сворачивания быстрых белков. Q. Преподобный Биофиз. 2014;47:95–142. [Бесплатная статья PMC] [PubMed] [Google Scholar]
4. Джуэтт М.Ф., Терри Д.С., Бланшар С.К. Светлое будущее флуоресцентной визуализации одиночных молекул. Курс. мнение хим. биол. 2014;20:103–111. [Статья бесплатно PMC] [PubMed] [Google Scholar]
5. Elbaum-Garfinkle S., Cobb G., Rhoades E. Мутанты тау связывают гетеродимеры тубулина с повышенной аффинностью. проц. Натл. акад. науч. США. 2014;111:6311–6316. [Бесплатная статья PMC] [PubMed] [Google Scholar]
6. Banerjee P.R., Deniz A.A. Проливая свет на ландшафты укладки белков с помощью флуоресценции одиночных молекул. хим. соц. 2014; 43:1172–1188. [Бесплатная статья PMC] [PubMed] [Google Scholar]
хим. соц. 2014; 43:1172–1188. [Бесплатная статья PMC] [PubMed] [Google Scholar]
7. Кениг И., Заррине-Афсар А., Шулер Б. Одномолекулярная спектроскопия конформационной динамики белков в живых эукариотических клетках. Нац. Методы. 2015; 12: 773–779. [PubMed] [Google Scholar]
8. Мело А.М., Кораор Дж., Роудс Э. Функциональная роль внутренних нарушений в тау-тубулиновом комплексе. проц. Натл. акад. науч. США. 2016;113:14336–14341. [Статья бесплатно PMC] [PubMed] [Google Scholar]
9. Шулер Б., Соранно А., Неттелс Д. Спектроскопия FRET одиночных молекул и физика полимеров развернутых и внутренне неупорядоченных белков. Анну. Преподобный Биофиз. 2016;45:207–231. [PubMed] [Академия Google]
10. Уверский В.Н., Олдфилд С.Дж., Дункер А.К. Внутренне неупорядоченные белки при заболеваниях человека: введение концепции D 2 . Анну. Преподобный Биофиз. 2008; 37: 215–246. [PubMed] [Google Scholar]
11. Томпа П. Внутренне неупорядоченные белки: итоги 10-летнего периода. Тенденции биохим. науч. 2012; 37: 509–516. [PubMed] [Google Scholar]
Тенденции биохим. науч. 2012; 37: 509–516. [PubMed] [Google Scholar]
12. Форман-Кей Дж. Д., Миттаг Т. От последовательности и сил к структуре, функции и эволюции внутренне неупорядоченных белков. Структура. 2013;21:1492–1499. [Бесплатная статья PMC] [PubMed] [Google Scholar]
13. Liu Z., Huang Y. Преимущества неупорядоченных белков. Белковая наука. 2014; 23: 539–550. [Бесплатная статья PMC] [PubMed] [Google Scholar]
14. Chen T., Song J., Chan H.S. Теоретические перспективы ненативных взаимодействий и внутреннего беспорядка в сворачивании и связывании белков. Курс. мнение Структура биол. 2015;30:32–42. [PubMed] [Google Scholar]
15. Дас Р.К., Руфф К.М., Паппу Р.В. Связывание информации, закодированной последовательностью, с формой и функцией внутренне неупорядоченных белков. Курс. мнение Структура биол. 2015; 32:102–112. [Бесплатная статья PMC] [PubMed] [Google Scholar]
16. Шерман Э., Харан Г. Переход клубок-глобула в денатурированном состоянии небольшого белка. проц. Натл. акад. науч. США. 2006; 103:11539–11543. [Бесплатная статья PMC] [PubMed] [Google Scholar]
проц. Натл. акад. науч. США. 2006; 103:11539–11543. [Бесплатная статья PMC] [PubMed] [Google Scholar]
17. Мерчант К. А., Бест Р. Б., Итон В. А. Характеристика развернутых состояний белков с использованием спектроскопии FRET одиночных молекул и молекулярного моделирования. проц. Натл. акад. науч. США. 2007; 104:1528–1533. [Бесплатная статья PMC] [PubMed] [Google Scholar]
18. Mazouchi A., Zhang Z., Gradinaru C.C. Конформации метастабильного домена Sh4, характеризуемые smFRET и моделью полимера с исключенным объемом. Биофиз. Дж. 2016; 110:1510–1522. [Бесплатная статья PMC] [PubMed] [Google Scholar]
19. Мюллер-Шпет С., Соранно А., Шулер Б. С обложки: взаимодействие зарядов может доминировать в размерах внутренне неупорядоченных белков. проц. Натл. акад. науч. США. 2010;107:14609–14614. [Бесплатная статья PMC] [PubMed] [Google Scholar]
20. Liu B., Chia D., Gradinaru C.C. Влияние внутрицепочечного электростатического отталкивания на конформационные нарушения и динамику белка Sic1. Дж. Физ. хим. Б. 2014; 118:4088–4097. [PubMed] [Google Scholar]
Дж. Физ. хим. Б. 2014; 118:4088–4097. [PubMed] [Google Scholar]
21. Сонг Дж., Гомес Г.-Н., Чан Х.С. Адекватный учет исключенного объема необходим, чтобы сделать вывод о компактности и асферичности неупорядоченных белков с помощью резонансного переноса энергии Фёрстера. Дж. Физ. хим. Б. 2015; 119: 15191–15202. [PubMed] [Google Scholar]
22. Гомес Г.-Н., Градинару С.С. Взгляд на конформации и динамику внутренне неупорядоченных белков с использованием флуоресценции одиночных молекул. Биохим. Биофиз. Акта. 2017 С1570-9639(17)30129-2. [PubMed] [Google Scholar]
23. Хуанг Ф., Ин Л., Фершт А.Р. Прямое наблюдение ограниченной барьером укладки BBL с помощью резонансной передачи энергии флуоресценции одной молекулы. проц. Натл. акад. науч. США. 2009;106:16239–16244. [Бесплатная статья PMC] [PubMed] [Google Scholar]
24. Лю Дж., Кампос Л.А., Муньос В. Изучение одностадийного свертывания белков в одиночных молекулах. проц. Натл. акад. науч. США. 2012; 109: 179–184.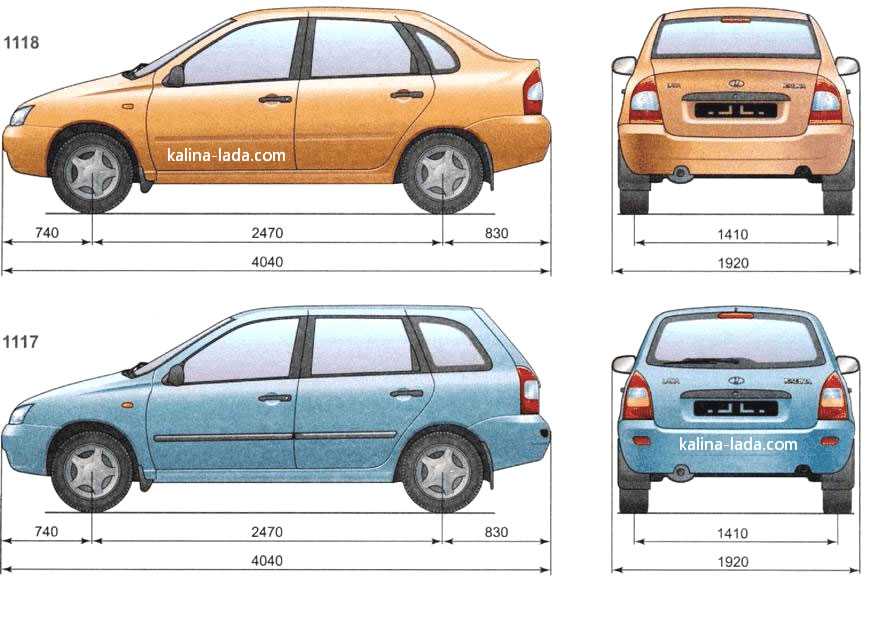 [Бесплатная статья PMC] [PubMed] [Google Scholar]
[Бесплатная статья PMC] [PubMed] [Google Scholar]
25. Чан Х.С., Чжан З., Лю З. Кооперативность, локально-нелокальная связь и неродные взаимодействия: принципы сворачивания белков на основе крупнозернистых моделей. Анну. Преподобный физ. хим. 2011;62:301–326. [PubMed] [Google Scholar]
26. Skinner J.J., Yu W., Sosnick T.R. Сравнительный анализ моделирования всех атомов с использованием водородного обмена. проц. Натл. акад. науч. США. 2014;111:15975–15980. [Бесплатная статья PMC] [PubMed] [Google Scholar]
27. Ли М., Лю З. Размеры, энергетика и денатурирующие эффекты неструктурированного состояния белка. Белковая наука. 2016; 25:734–747. [Бесплатная статья PMC] [PubMed] [Google Scholar]
28. Чанг Х.С., Итон В.А. Флуоресцентные зонды одиночной молекулы исследуют динамику пересечения барьера. Природа. 2013; 502: 685–688. [Бесплатная статья PMC] [PubMed] [Google Scholar]
29. Zhang Z., Chan H.S. Пути перехода, диффузионные процессы и предравновесия фолдинга белков. проц. Натл. акад. науч. США. 2012;109: 20919–20924. [Бесплатная статья PMC] [PubMed] [Google Scholar]
проц. Натл. акад. науч. США. 2012;109: 20919–20924. [Бесплатная статья PMC] [PubMed] [Google Scholar]
30. Борг М., Миттаг Т., Чан Х.С. Полиэлектростатические взаимодействия неупорядоченных лигандов предполагают физическую основу сверхчувствительности. проц. Натл. акад. науч. США. 2007; 104:9650–9655. [Бесплатная статья PMC] [PubMed] [Google Scholar]
31. Mittag T., Marsh J., Forman-Kay J.D. Значение структуры/функции в динамическом комплексе внутренне неупорядоченного Sic1 с субъединицей Cdc4 убиквитинлигазы SCF . Структура. 2010;18:494–506. [Бесплатная статья PMC] [PubMed] [Google Scholar]
32. Фуксрайтер М., Томпа П. Нечеткие комплексы: более стохастический взгляд на функцию белка. Доп. Эксп. Мед. биол. 2012; 725:1–14. [PubMed] [Google Scholar]
33. Csizmok V., Orlicky S., Forman-Kay J.D. Аллостерический канал облегчает динамическое мультисайтовое распознавание субстрата с помощью убиквитинлигазы SCF ( Cdc4 ). Нац. коммун. 2017;8:13943. [Бесплатная статья PMC] [PubMed] [Google Scholar]
34. Чонг П.А., Форман-Кей Дж.Д. Разделение фаз жидкость-жидкость в сотовых сигнальных системах. Курс. мнение Структура биол. 2016;41:180–186. [PubMed] [Академия Google]
Чонг П.А., Форман-Кей Дж.Д. Разделение фаз жидкость-жидкость в сотовых сигнальных системах. Курс. мнение Структура биол. 2016;41:180–186. [PubMed] [Академия Google]
35. Шривастава Д., Мутукумар М. Зависимость конформаций полиамфолитов от последовательности. Макромолекулы. 1996; 29: 2324–2326. [Google Scholar]
36. Дас Р.К., Паппу Р.В. На конформации внутренне неупорядоченных белков влияет линейное распределение последовательностей противоположно заряженных остатков. проц. Натл. акад. науч. США. 2013;110:13392–13397. [Статья бесплатно PMC] [PubMed] [Google Scholar]
37. Sawle L., Ghosh K. Теоретический метод вычисления конфигурационных свойств, зависящих от последовательности, в заряженных полимерах и белках. J. Chem. физ. 2015;143:085101. [PubMed] [Академия Google]
38. Лин Ю.-Х., Форман-Кей Дж.Д., Чан Х.С. Специфическое для последовательности разделение фаз полиамфолита в безмембранных органеллах. физ. Преподобный Летт. 2016;117:178101. [PubMed] [Google Scholar]
39. Лин Ю.-Х., Чан Х.С. Разделение фаз и одноцепочечная компактность заряженных неупорядоченных белков сильно коррелируют. Биофиз. Дж. 2017; 112:2043–2046. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Лин Ю.-Х., Чан Х.С. Разделение фаз и одноцепочечная компактность заряженных неупорядоченных белков сильно коррелируют. Биофиз. Дж. 2017; 112:2043–2046. [Бесплатная статья PMC] [PubMed] [Google Scholar]
40. Зив Г., Харан Г. Сворачивание белков, коллапс белков и модель переноса Танфорда: уроки одномолекулярного FRET. Варенье. хим. соц. 2009 г.;131:2942–2947. [Статья бесплатно PMC] [PubMed] [Google Scholar]
41. Hofmann H., Nettels D., Schuler B. Спектроскопия одиночных молекул неожиданного коллапса развернутого белка при низком pH. J. Chem. физ. 2013;139:121930. [PubMed] [Google Scholar]
42. Möglich A., Joder K., Kiefhaber T. Распределения расстояний от конца до конца и константы внутрицепочечной диффузии в развернутых полипептидных цепях указывают на образование внутримолекулярной водородной связи. проц. Натл. акад. науч. США. 2006;103:12394–12399. [Бесплатная статья PMC] [PubMed] [Google Scholar]
43. Yoo T.Y., Meisburger S.P., Plaxco K. Малоугловое рассеяние рентгеновских лучей и спектроскопия FRET одиночных молекул дают сильно расходящиеся представления о развернутом состоянии с низким уровнем денатурации.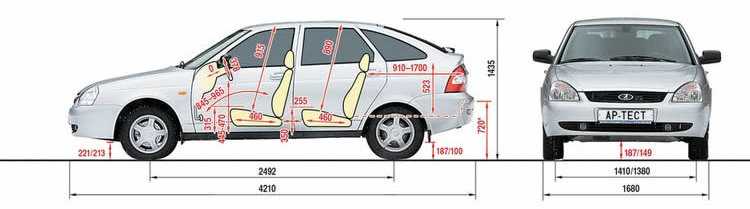 Дж. Мол. биол. 2012; 418: 226–236. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Дж. Мол. биол. 2012; 418: 226–236. [Бесплатная статья PMC] [PubMed] [Google Scholar]
44. Watkins H.M., Simon A.J., Plaxco K.W. Отрицательный контроль со случайной катушкой воспроизводит несоответствие между измерениями рассеяния и FRET размеров денатурированного белка. проц. Натл. акад. науч. США. 2015;112:6631–6636. [Бесплатная статья PMC] [PubMed] [Google Scholar]
45. Холехаус А.С., Перана И., Паппу Р.В. Моделирование и эксперименты обеспечивают конвергентное представление о развернутых состояниях белка в условиях фолдинга. Биофиз. Дж. 2017;112:315а. [Google Scholar]
46. Plaxco K.W., Millett I.S., Baker D. Коллапс цепи может происходить одновременно с лимитирующей стадией фолдинга белка. Нац. Структура биол. 1999; 6: 554–556. [PubMed] [Google Scholar]
47. Джейкоб Дж., Кранц Б., Сосник Т.Р. Ранний коллапс не является обязательным этапом фолдинга белка. Дж. Мол. биол. 2004;338:369–382. [PubMed] [Google Scholar]
48. О’Брайен Э.П., Моррисон Г. , Тирумалай Д. Насколько точны полимерные модели при анализе экспериментов по переносу энергии резонанса Фёрстера на белках? J. Chem. физ. 2009;130:124903. [Статья бесплатно PMC] [PubMed] [Google Scholar]
, Тирумалай Д. Насколько точны полимерные модели при анализе экспериментов по переносу энергии резонанса Фёрстера на белках? J. Chem. физ. 2009;130:124903. [Статья бесплатно PMC] [PubMed] [Google Scholar]
49. Kellner R., Hofmann H., Schuler B. Спектроскопия одиночных молекул показывает опосредованное шаперонами расширение белка-субстрата. проц. Натл. акад. науч. США. 2014;111:13355–13360. [Бесплатная статья PMC] [PubMed] [Google Scholar]
50. Maity H., Reddy G. Сворачивание белка L с последствиями коллапса в ансамбле денатурированного состояния. Варенье. хим. соц. 2016;138:2609–2616. [PubMed] [Google Scholar]
51. Li M., Sun T., Liu Z. Преобразование размеров и масштабирование неупорядоченных белковых цепей. Мол. Биосист. 2016;12:2932–2940. [PubMed] [Google Scholar]
52. Чжэн В., Борджиа А., Бест Р. Б. Исследование действия химического денатуранта на внутренне неупорядоченный белок с помощью моделирования и эксперимента. Варенье. хим. соц. 2016;138:11702–11713. [Бесплатная статья PMC] [PubMed] [Google Scholar]
[Бесплатная статья PMC] [PubMed] [Google Scholar]
53. Borgia A., Zheng W., Schuler B. Непротиворечивое представление о расширении полипептидных цепей в химических денатурантах, полученное с помощью нескольких экспериментальных методов. Варенье. хим. соц. 2016;138:11714–11726. [Бесплатная статья PMC] [PubMed] [Google Scholar]
54. Хаас Э., Качальский-Кацир Э., Стейнберг И.З. Броуновское движение концов олигопептидных цепей в растворе, оцененное по переносу энергии между концами цепей. Биополимеры. 1978; 17:11–31. [Google Scholar]
55. Джейкоб М.Х., Дсоуза Р.Н., Нау В.М. Диффузионно-усиленный резонансный перенос энергии Фёрстера, влияние внешних тушителей и квантовый выход донора. Дж. Физ. хим. Б. 2013; 117: 185–19.8. [PubMed] [Google Scholar]
56. Топтыгин Д., Чин А.Ф., Хильзер В.Я. Влияние диффузии на распределение скорости переноса резонансной энергии: последствия для измерений расстояний. Дж. Физ. хим. Б. 2015; 119:12603–12622. [Бесплатная статья PMC] [PubMed] [Google Scholar]
57. Piana S., Klepeis J.L., Shaw D.E. Оценка точности физических моделей, используемых при моделировании сворачивания белков: количественные данные длительного моделирования молекулярной динамики. Курс. мнение Структура биол. 2014;24:98–105. [PubMed] [Google Scholar]
Piana S., Klepeis J.L., Shaw D.E. Оценка точности физических моделей, используемых при моделировании сворачивания белков: количественные данные длительного моделирования молекулярной динамики. Курс. мнение Структура биол. 2014;24:98–105. [PubMed] [Google Scholar]
58. Чен Т., Чан Х.С. Влияние барьеров десольватации и боковых цепей на локально-нелокальное сцепление и поведение шевронов в крупнозернистых моделях сворачивания белков. физ. хим. хим. физ. 2014;16:6460–6479. [PubMed] [Google Scholar]
59. Раушер С., Гапсис В., Грубмюллер Х. Структурные ансамбли внутренне неупорядоченных белков сильно зависят от силового поля: сравнение с экспериментом. J. Chem. Теория вычисл. 2015;11:5513–5524. [PubMed] [Академия Google]
60. Huang J., Rauscher S., MacKerell A.D., Jr. CHARMM36m: улучшенное силовое поле для свернутых и внутренне неупорядоченных белков. Нац. Методы. 2017;14:71–73. [Бесплатная статья PMC] [PubMed] [Google Scholar]
61. Лучший Р. Б. Вычислительные и теоретические достижения в исследованиях внутренне неупорядоченных белков.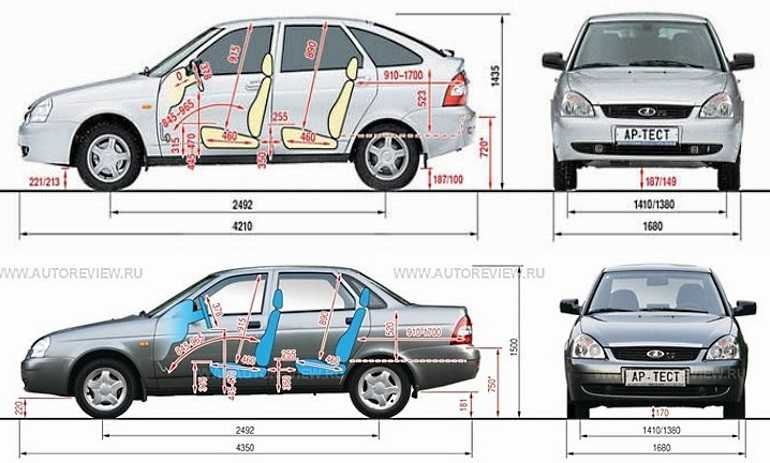 Курс. мнение Структура биол. 2017;42:147–154. [PubMed] [Google Scholar]
Курс. мнение Структура биол. 2017;42:147–154. [PubMed] [Google Scholar]
62. Левин З.А., Ши Дж.-Э. Моделирование неупорядоченных белков и систем с конформационной неоднородностью. Курс. мнение Структура биол. 2017;43:95–103. [PubMed] [Google Scholar]
63. Таваколи, М., Дж. Н. Тейлор, …, С. Прессе. 2016. Анализ данных отдельных молекул: введение. Препринт arXiv arXiv: 1606.00403.
64. Левитт М. Упрощенное представление конформаций белка для быстрого моделирования фолдинга белка. Дж. Мол. биол. 1976; 104: 59–107. [PubMed] [Google Scholar]
65. Метрополис Н., Розенблут А.В., Теллер Э. Уравнение расчета состояния с помощью быстрых вычислительных машин. J. Chem. физ. 1953; 21: 1087–109.2. [Google Scholar]
66. Сонг Дж., Нг С.К., Чан Х.С. Взаимодействия поликатион- π являются движущей силой молекулярного распознавания семейством внутренне неупорядоченных онкобелков. PLoS-компьютер. биол. 2013;9:e1003239. [Бесплатная статья PMC] [PubMed] [Google Scholar]
67. Verdier P.H., Stockmayer W.H. Расчеты методом Монте-Карло динамики полимеров в разбавленных растворах. J. Chem. физ. 1962; 36: 227–235. [Google Scholar]
Verdier P.H., Stockmayer W.H. Расчеты методом Монте-Карло динамики полимеров в разбавленных растворах. J. Chem. физ. 1962; 36: 227–235. [Google Scholar]
68. Лал М. Компьютерное моделирование цепных молекул методом Монте-Карло. I. Мол. физ. 1969;17:57–64. [Google Scholar]
69. Маккарни Э.Р., Вернер Дж.Х., Пласко К.В. Сайт-специфические размеры сильно денатурированного белка; исследование одной молекулы. Дж. Мол. биол. 2005; 352: 672–682. [PubMed] [Google Scholar]
70. Кихней А.Г., Свергун Д.И. Практическое руководство по малоугловому рассеянию рентгеновских лучей (SAXS) гибких и внутренне неупорядоченных белков. ФЭБС лат. 2015; 589 (19 часть А): 2570–2577. [PubMed] [Google Scholar]
71. Kohn J.E., Millett I.S., Plaxco K.W. Поведение случайной спирали и размеры химически развернутых белков. проц. Натл. акад. науч. США. 2004;101:12491–12496. [Бесплатная статья PMC] [PubMed] [Google Scholar]
72. Инман Х.Ф., Брэдли Э.Л., младший. Коэффициент перекрытия как мера согласия между вероятностными распределениями и точечной оценкой перекрытия двух нормальных плотностей. коммун. Стат. Методы теории. 1989; 18:3851–3874. [Google Scholar]
коммун. Стат. Методы теории. 1989; 18:3851–3874. [Google Scholar]
73. Hu J., Chen T., Zhang Z. Критическое сравнение подходов, основанных на крупнозернистой структуре, и атомарных моделей сворачивания белков. физ. хим. хим. физ. 2017;19:13629–13639. [PubMed] [Google Scholar]
74. Borgia A., Wensley B.G., Schuler B. Локализация внутреннего трения по координате реакции сворачивания белка путем объединения ансамблевой и одиночной молекулярной флуоресцентной спектроскопии. Нац. коммун. 2012;3:1195. [Бесплатная статья PMC] [PubMed] [Google Scholar]
75. Choy W.-Y., Forman-Kay J.D. Расчет ансамблей структур, представляющих развернутое состояние домена Sh4. Дж. Мол. биол. 2001; 308:1011–1032. [PubMed] [Академия Google]
76. Марш Дж. А., Форман-Кей Дж. Д. Ансамбльное моделирование неупорядоченных состояний белков: вклад экспериментальных ограничений и проверка. Белки. 2012; 80: 556–572. [PubMed] [Google Scholar]
77. Антонов Л.Д., Олссон С., Хамельрик Т.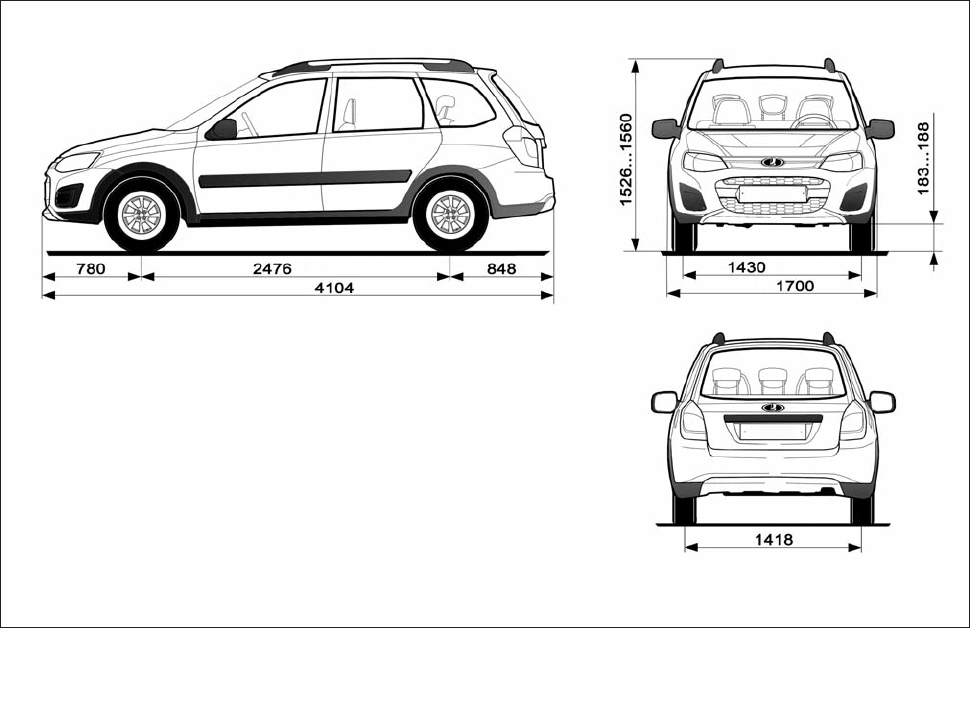 Байесовский вывод белковых ансамблей по данным SAXS. физ. хим. хим. физ. 2016;18:5832–5838. [PubMed] [Google Scholar]
Байесовский вывод белковых ансамблей по данным SAXS. физ. хим. хим. физ. 2016;18:5832–5838. [PubMed] [Google Scholar]
78. Валлин С., Чан Х.С. Критическая оценка модели поиска топомера укладки белка с использованием континуальной модели с явной цепью и обширной конформационной выборкой. Белковая наука. 2005; 14:1643–1660. [Бесплатная статья PMC] [PubMed] [Google Scholar]
79. Болдуин Р.Л. Природа путей сворачивания белков: классический взгляд против нового. Дж. Биомол. ЯМР. 1995; 5: 103–109. [PubMed] [Google Scholar]
80. Шортл Д., Акерман М.С. Сохранение нативной топологии в денатурированном белке в 8 М мочевине. Наука. 2001; 293:487–489. [PubMed] [Google Scholar]
81. Meng W., Lyle N., Pappu R.V. Эксперименты и моделирование показывают, как дальнодействующие контакты могут образовываться в расширенных развернутых белках с незначительной вторичной структурой. проц. Натл. акад. науч. США. 2013;110:2123–2128. [Бесплатная статья PMC] [PubMed] [Google Scholar]
82. Садки М., Фушман Д., Муньос В. Поатомный анализ глобального нисходящего фолдинга белков. Природа. 2006; 442: 317–321. [PubMed] [Google Scholar]
Садки М., Фушман Д., Муньос В. Поатомный анализ глобального нисходящего фолдинга белков. Природа. 2006; 442: 317–321. [PubMed] [Google Scholar]
83. Чан Х.С., Симидзу С., Кая Х. Принципы кооперативности в фолдинге белков. Методы Энзимол. 2004; 380:350–379. [PubMed] [Google Scholar]
84. Bai Y., Sosnick T.R., Englander S.W. Промежуточные продукты сворачивания белков: водородный обмен в нативном состоянии. Наука. 1995; 269: 192–197. [Бесплатная статья PMC] [PubMed] [Google Scholar]
85. Симидзу С., Чан Х.С. Происхождение компактности денатурированного состояния белка и гидрофобной кластеризации в водном растворе мочевины: выводы из неполярных потенциалов средней силы. Белки. 2002; 49: 560–566. [PubMed] [Google Scholar]
86. Кая Х., Чан Х.С. Модель явной цепи водородного обмена в нативном состоянии: последствия для упорядочения событий и кооперативности при сворачивании белков. Белки. 2005; 58:31–44. [PubMed] [Google Scholar]
87. Нотт М., Чан Х.С. Критерии нисходящей укладки белков: калориметрия, шевронный график, кинетическая релаксация и радиус вращения одной молекулы в цепных моделях с пониженной степенью кооперативности.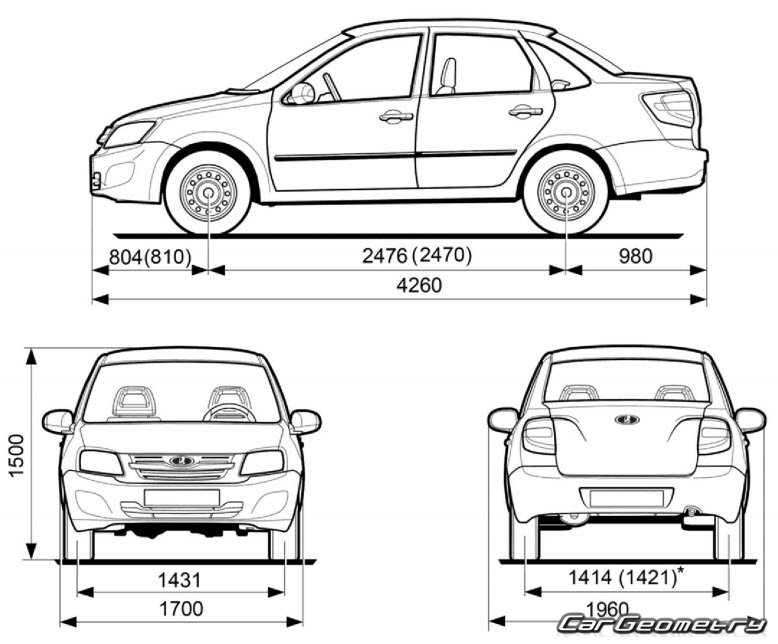 Белки. 2006; 65: 373–39.1. [PubMed] [Google Scholar]
Белки. 2006; 65: 373–39.1. [PubMed] [Google Scholar]
88. Martin E.W., Holehouse A.S., Mittag T. Последовательность детерминант конформационных свойств внутренне неупорядоченного белка до и после мультисайтового фосфорилирования. Варенье. хим. соц. 2016;138:15323–15335. [Бесплатная статья PMC] [PubMed] [Google Scholar]
89. Паппу Р.В., Шринивасан Р., Роуз Г.Д. Гипотеза Флори об изолированных парах недействительна для полипептидных цепей: значение для сворачивания белков. проц. Натл. акад. науч. США. 2000;97:12565–12570. [Бесплатная статья PMC] [PubMed] [Google Scholar]
90. Fitzkee NC, Rose G.D. Переоценка статистики случайных катушек в развернутых белках. проц. Натл. акад. науч. США. 2004; 101:12497–12502. [Бесплатная статья PMC] [PubMed] [Google Scholar]
91. Orevi T., Ben Ishay E., Haas E. Раннее закрытие длинной петли в рефолдинге аденилаткиназы: возможная ключевая роль нелокальных взаимодействий на начальных этапах складывания. Дж. Мол. биол. 2009; 385:1230–1242. [PubMed] [Академия Google]
[PubMed] [Академия Google]
92. Лернер Э., Ореви Т., Хаас Э. Кинетика быстро меняющихся внутримолекулярных распределений расстояний, полученная путем комбинированного анализа кинетики эффективности FRET и измерений равновесия FRET с временным разрешением. Биофиз. Дж. 2014; 106: 667–676. [Бесплатная статья PMC] [PubMed] [Google Scholar]
93. Orevi T., Rahamim G., Haas E. Последовательное закрытие петлевых структур образует сворачивающееся ядро во время рефолдингового перехода Escherichia coli молекулы аденилаткиназы. Биохимия. 2016;55:79–91. [PubMed] [Google Scholar]
94. Fuertes G., Banterle N., Lemke E.A. Разделение флуктуаций размера и формы в гетерополимерных последовательностях устраняет расхождения в измерениях SAXS и FRET. проц. Натл. акад. науч. США. 2017; 114:E6342–E6351. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Collings D1 | Акустическая гитара дредноут
Обзор
D1Дредноут с квадратным плечом и 14 ладами — самая популярная форма корпуса акустической гитары со стальными струнами в мире. Хотя Collings, безусловно, не единственная компания, производящая их, мы привносим новую тональную ясность в глубину и теплоту, которые обычно ассоциируются с такой большой гитарой с глубоким корпусом. Хотя его басовая характеристика делает дредноут идеальным для вокального сопровождения, версии Коллингса также часто используются любителями мятлика, которым приходится конкурировать с изначально более громкими инструментами, такими как банджо и скрипки. Широкий выбор предлагаемых пород дерева и размеров грифа позволяет поклонникам дредноута найти модель Collings, идеально подходящую для их стиля игры и тональных предпочтений.
Хотя Collings, безусловно, не единственная компания, производящая их, мы привносим новую тональную ясность в глубину и теплоту, которые обычно ассоциируются с такой большой гитарой с глубоким корпусом. Хотя его басовая характеристика делает дредноут идеальным для вокального сопровождения, версии Коллингса также часто используются любителями мятлика, которым приходится конкурировать с изначально более громкими инструментами, такими как банджо и скрипки. Широкий выбор предлагаемых пород дерева и размеров грифа позволяет поклонникам дредноута найти модель Collings, идеально подходящую для их стиля игры и тональных предпочтений.
Ручная озвучка
Исходя из плотности и жесткости древесины, каждая верхняя дека акустической гитары отбирается вручную, оценивается и градуируется до уникальной толщины; максимизация тонального потенциала каждого топа.
Древесина премиум-класса
Каждая акустическая гитара Collings, от самой доступной модели до самой дорогой, изготавливается из древесины лучших тонов. Каждая древесина приобретается, акклиматизируется и отбирается вручную мастерами здесь, в нашем магазине, которые выбирают каждый компонент с учетом всей тональности конечного инструмента.
Каждая древесина приобретается, акклиматизируется и отбирается вручную мастерами здесь, в нашем магазине, которые выбирают каждый компонент с учетом всей тональности конечного инструмента.
Удобство игры
Сочетание тщательной машинной правки PLEK и ручной обработки ладов обеспечивает неизменно превосходную играбельность и приятное ощущение ладов.
Финишное покрытие
Путем тщательной ручной шлифовки между слоями наша нитроцеллюлозная лаковая отделка имеет конечную толщину от 0,005 до 0,007 дюйма, обеспечивая максимальную акустическую реакцию, обеспечивая при этом превосходную защиту и эстетику.
Precision Tuning
Premium Колки Waverly с открытой передачей обеспечивают исключительную стабильность настройки и плавную надежную работу в винтажном стиле.
Appointments
Переплет черепахового цвета прекрасно сочетается с теплыми оттенками задней и боковых сторон из красного дерева. Черно-белая деревянная розетка и вставки из перламутровых точек завершают простую, но элегантную отделку в стиле 1.
Premium Tonewoods
Сочетание ели сикта с декой и обечайками из гондурасского красного дерева создает гитару с четкой, но теплой артикуляцией и прекрасным тональным балансом.
Сделай сам
С широким выбором нестандартных вставок, ширины порожка, профилей грифа и вариантов цвета дерева; Инструмент Collings можно настроить так, чтобы он идеально соответствовал вашему стилю игры и эстетическим предпочтениям.
Технические характеристики
| Top | Sitka spruce |
| Back & Sides | Honduran mahogany |
| Neck | Honduran mahogany |
| Body Binding | Tortoise with b/w/b/w top purfling |
| Крепление грифа | Нет |
| Крепление головки грифа | Нет |
| Бридж | Эбзоновый стиль живота с 2 3/16 «Расстояние |
Гриф. Ebony with MOP dot Ebony with MOP dot | |
| Nut | Bone, 1 11/16″ |
| Saddle | Bone, drop-in |
| Neck Profile | Modified V |
| Peghead Profile | Square |
| Neck Joint | Mortise & tenon hybrid |
| Truss Rod | Fully adjustable |
| Frets | Medium 18% nickel-silver |
| Peghead Veneer | Ebony with MOP Collings logo |
| Колки | Никель Waverly |
| Задняя планка | 1-стиль (орех) |
| Розетка/корпус | 9 |
| Scale Length | 25 1/2″ |
| Brace Material | Sitka spruce |
| Brace Pattern | Pre-war scalloped X-brace |
| Body Finish | High gloss nitrocellulose lacquer |
| Отдел шеи | Высокий глянцевый полиэфирный смола |
| Tortoise | |
| String | |
. 0246 0246 | |
| Кейс | Твердый футляр Deluxe от TKL |
Профиль шеи
*Фактические размеры могут незначительно отличаться из-за ручной шлифовки и различных вариантов отделки.
Dimensions
| Body Length | 20″ |
| Body Depth | 4 7/8″ |
| Lower Bout Width | 15 5/8″ |
| Total Length | 40 1/4″ |
Найти дилера
Галерея
Изображения Видео
Кенни Смит — D1 A V
Кенни Смит играет «Me и My Farmall» на его личном 2003 Collings D1 A V.
Пит Хаттлингер играет «Джози» Стили Дэна на Collings D1 A.
Карл Майнер — Collings D1 A
Карл Майнер из Greencards играет оригинальную композицию на Collings D1 A.
Show Custom Examples
Custom Options
Top Woods
- Sitka Spruce (standard)
- Torrefied Sitka Spruce
- Adirondack Spruce
- Torrefied Adirondack Spruce
- European Spruce
- Honduran Mahogany Top
- Koa Top
Древесина для задней и боковой стенок
- Восточно-индийский палисандр
Восточно-индийский палисандр — одна из самых популярных пород древесины, и на то есть веские причины.

