Что такое металлизация химическая? Химическая металлизация своими руками :: SYL.ru
Эффективная защита и декоративное оформление — это очень актуальная тема как для масштабного производства, так и для домашнего мастера. Одним из самых популярных методов решения этих задач является металлизация химическая. Она широко применяется в производстве, а также выполняется своими руками.
Виды металлизации
Металлизация — это нанесение на поверхность тонкого металлического слоя. Так могут обрабатываться не только металлические изделия, но также пластиковые, деревянные, стеклянные и другие. Самые популярные и известные виды этого процесса — хромирование (то есть металлизация хромом) и цинкование (когда поверхность изделия покрывают слоем цинка). Менее известный вид — это алитирование (нанесение на поверхность слоя алюминия).
В зависимости от оборудования и технологии различают несколько разновидностей металлизации:
- Гальваническая. Выполняется в специальном электролите, который наливают в ванны.

- Металлизация электродуговая. Покрытие здесь наносится следующим способом: применяется электродуговое плавление металлического электрода.
- Газоплазменное напыление по технологии похоже на электродуговую металлизацию, когда расплавленный, мелкодисперсный металл наносится на поверхность. Газоплазменное напыление, как и электродуговая металлизация — это достаточно сложный технологический процесс, поэтому применяется он в основном в производстве.
- Плакирование. При этом методе слой металла наносят на поверхность изделия, после чего применяется горячая прокатка.
- Металлизация диффузная. Высокая температура заставляет атомы наносимого металла проникать в поверхность обрабатываемого изделия.
- Горячий вид металлизации. Покрытие формируется во время погружения изделия в расплавленный металл.
- Металлизация химическая. Данный вид отлично подходит для применения в домашних условиях.
Технологические особенности
У химической металлизации различные цели. Основная — это улучшенные декоративные характеристики изделия после проведения процедуры. Кроме этого, химическая металлизация скрывает дефекты обрабатываемых поверхностей, например, микротрещины и мелкие поры. Иногда с помощью данной технологии восстанавливают поверхность. Общей целью можно считать улучшение характеристик обрабатываемого изделия, а точнее материала, из которого оно изготовлено.
Основная — это улучшенные декоративные характеристики изделия после проведения процедуры. Кроме этого, химическая металлизация скрывает дефекты обрабатываемых поверхностей, например, микротрещины и мелкие поры. Иногда с помощью данной технологии восстанавливают поверхность. Общей целью можно считать улучшение характеристик обрабатываемого изделия, а точнее материала, из которого оно изготовлено.
Как правило, происходит улучшение следующих характеристик:
- Декоративных свойств.
- Коррозийной устойчивости.
- Твердости.
- Износоустойчивости и т. д.
Самой важной задачей в выполнении данного процесса является обеспечение оптимальных условий для того, чтобы окислительно-восстановительные реакции протекали правильно. Это сложный химический процесс с вылетом атомов. Конечно, контроль этого процесса провести визуально довольно сложно, но в результате цвет обрабатываемой поверхности изменится — так сразу будет заметна химическая металлизация.
Технология химического способа металлизации следующая: изделие покрывается специальными химическими реагентами, которые вступают в реакции между собой. В результате поверхность покрывается тонким слоем металла. Такое металлическое покрытие может быть не только определенного цвета, но и с несколькими оттенками, с плавными переходами между этими оттенками. Если понаблюдать за химической металлизацией, то можно сделать вывод, что метод не сложный. Сам процесс выглядит как простая покраска поверхности.
В результате поверхность покрывается тонким слоем металла. Такое металлическое покрытие может быть не только определенного цвета, но и с несколькими оттенками, с плавными переходами между этими оттенками. Если понаблюдать за химической металлизацией, то можно сделать вывод, что метод не сложный. Сам процесс выглядит как простая покраска поверхности.
Оборудование для химической металлизации
В домашних условиях достаточно часто проводится химическая металлизация. Оборудование при этом специальное не требуется. Самой простейшей установкой для химической металлизации может быть эмалированная емкость и паяльная лампа. Также металлизация может проводиться стандартным краскораспылительным оборудованием или с помощью мини-установок, работающих от компрессора.
В общем, вариантов здесь много. Стоит учитывать и то, что изделия небольших размеров и несложной формы можно обрабатывать без специального оборудования. При имеющемся устройстве химическая металлизация в домашних условиях может проводиться и на габаритных деталях со сложной конфигурацией.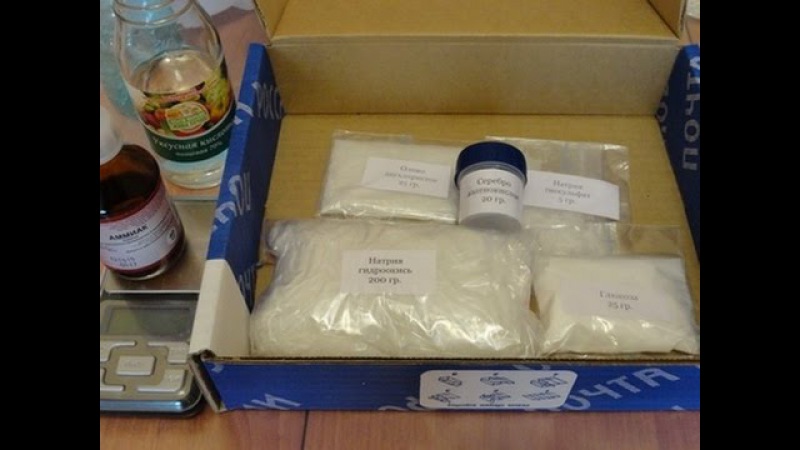
Выполняя химическую металлизацию самостоятельно, нужно быть предельно осторожным, так как работа проходит с использованием специальных реактивов. Правильная подготовка оборудования и материалов для проведения химической металлизации позволяет получить качественное покрытие на изделиях, которое практически не будет отличаться от заводского.
Материалы для химической металлизации
Химическая металлизация проводится с применением специальных веществ. Реактивы для химической металлизации обладают активирующими и восстанавливающими свойствами. Также в процессе процедуры понадобится грунтовка. Ее наносят на обрабатываемую поверхность. После нанесения грунтовки потребуется еще лак, который защищает готовые покрытия от негативных внешних факторов. Перед нанесением финишного лакового покрытия нужно выбрать качественный материал, у которого достаточная твердость и износостойкость.
Чтобы наносимый металлический слой был желаемого цвета, можно воспользоваться специальным красящим тонером. Грунтовка, про которую говорили выше, нужна для улучшения адгезии металлического слоя с верхним слоем обрабатываемого изделия. Химическая металлизация своими руками может быть выполнена быстро, но не всегда она показывает качественный, хороший результат. Однако это можно исправить — нанесенный слой удаляется с помощью специальных смывочных растворов.
Грунтовка, про которую говорили выше, нужна для улучшения адгезии металлического слоя с верхним слоем обрабатываемого изделия. Химическая металлизация своими руками может быть выполнена быстро, но не всегда она показывает качественный, хороший результат. Однако это можно исправить — нанесенный слой удаляется с помощью специальных смывочных растворов.
Химическая металлизация своими руками в домашних условиях
Если вы впервые выполняете химическую металлизацию в домашних условиях, то стоит заранее изучить теоретические материалы, просмотреть видео по данной теме. Конечно, нужно подготовить оборудование и расходные материалы. В процессе химической металлизации применяются опасные химические реактивы, с которыми нужно обращаться очень аккуратно, соблюдать требования техники безопасности. Сама химическая металлизация, как уже говорилось выше, не сложный метод, и ее без труда можно провести в домашних условиях. Несмотря на все достоинства метода, не стоит забывать, что даже в домашних условиях достаточно дорого обходится химическая металлизация. Цена заводского покрытия еще выше и будет зависеть от площади покрытия поверхности.
Цена заводского покрытия еще выше и будет зависеть от площади покрытия поверхности.
Последовательность действий в процессе химической металлизации
Несмотря на то что данный процесс является несложным, важно выполнять все действия в строгой последовательности:
- Сначала проводится тщательная очистка обрабатываемой поверхности.
- Затем осуществляется обезжиривание. Это очень важный этап, так как от него зависит качество результата.
- Обезжиренная поверхность промывается водой.
- Если металлизируют не все изделие, то те участки, которые должны остаться без покрытия, нужно заизолировать свинцом (он устойчив к электролитическому раствору).
- Изделие закрепляется на проводе, через который подается электрический ток, и опускается в электролитический раствор. Здесь его нужно выдержать определенное время.
- По прошествии времени изделие нужно достать, просушить, остудить и отполировать.
Условия безопасности
Химическая металлизация (хромирование) — это опасный для здоровья процесс, поэтому важно выполнять требования по технике безопасности. Сам процесс должен проходить в помещении, которое хорошо проветривается. Хорошо, если в этом помещении установлена качественная принудительная вентиляция. Приступая к химической металлизации в домашних условиях, важно позаботиться о средствах защиты органов дыхания, зрения, кожных покровов, то есть специальных очках, респираторе, закрытой одежде, фартуке, перчатках.
Сам процесс должен проходить в помещении, которое хорошо проветривается. Хорошо, если в этом помещении установлена качественная принудительная вентиляция. Приступая к химической металлизации в домашних условиях, важно позаботиться о средствах защиты органов дыхания, зрения, кожных покровов, то есть специальных очках, респираторе, закрытой одежде, фартуке, перчатках.
Для приготовления необходимых растворов используется только дистиллированная вода. Также стоит подумать о реагентах — они должны быть чистыми, высокого качества, с маркировкой «Ч». Посуда для реагентов тоже имеет значение — емкости должны быть стеклянными или эмалированными.
Подготовка поверхностей для химической металлизации
Перед началом процедуры металлизации нужно обязательно подготовить поверхность изделия. Изначально ее очищают, а потом избавляют от остатков жира. Чем ответственнее подойти к этим процедурам, тем прочнее и долговечнее будет будущее металлизированное покрытие. Чтобы выполнить данные процедуры, нужно правильно подобрать оборудование. Эффективно удалить ненужные слои лакокрасочного покрытия, ржавчину, а также различные загрязнения можно с помощью функционального пескоструйного аппарата.
Эффективно удалить ненужные слои лакокрасочного покрытия, ржавчину, а также различные загрязнения можно с помощью функционального пескоструйного аппарата.
Если случай не такой запущенный, то поверхность поможет очистить крупнозернистая наждачная бумага. Вся эта процедура совсем не сложная, и ее легко можно выполнить в домашних условиях. Главное, подойти к этому ответственно.
Обезжиривание поверхности
Выполняя химическую металлизацию, отполированное и отшлифованное изделие нужно обязательно обезжирить. По правилам делают это с помощью специального раствора. Для приготовления самого простого состава потребуется:
- 150 г едкого натра;
- 50 г кальцинированной соды;
- 5 г силикатного канцелярского клея.
Само обезжиривание — процесс несложный, поэтому легко осуществляется самостоятельно. Приготовленная смесь разогревается до 80-100 градусов, подготовленное для металлизации изделие погружают в раствор. Там его нужно продержать от 15 минут до часа, в зависимости от уровня загрязнений.
Для обработки старых алюминиевых изделий используют другой раствор:
- 50 г сернокислой меди;
- 8 г концентрированной серной кислоты.
В такой раствор изделие можно опустить лишь на несколько секунд (не больше 10 секунд).
Процесс металлизации
Для получения нужного внешнего вида изделия его подвергают химической металлизации, которая происходит с помощью специального оборудования и химических реагентов. Время процесса может быть различным. Оно зависит от желаемых результатов и от того, какова должна быть толщина металлического слоя. Обычно процесс продолжается 5-8 часов. Также нужно помнить, что металлизация химическая проходит при определенной температуре. Она должна поддерживаться во время всего процесса.
После того как металлизация химическая проведена, изделие достают, моют и просушивают. На поверхности нельзя оставлять химические реактивы, так как они опасны для здоровья. Для более эффективного устранения всех остатков после промывания изделие нужно прокипятить в специальном оборудовании.
Рекомендации
Для получения качественного металлического слоя на изделиях и для того, чтобы не навредить своему здоровью, нужно обязательно выполнять следующие рекомендации:
- до начала процедуры проверяются все электрические контакты на надежность;
- в процессе металлизации нужно обязательно использовать резиновые перчатки, чтобы защитить руки от ожогов;
- помещение следует обязательно проветривать, так как в процессе выделяются газы, раздражающие слизистую оболочку органов дыхания.
2 Вопрос Сравнение способов нанесения металлопокрытий из водных растворов.
Литература:
Гальванотехника (под ред. А.М. Гинберг), 87 г.
Шалкаускас М. В., Вашкялис А., «Химическая металлизация пластмасс», И: Куча, 69-92 г. Чем старее – тем подробнее, чем новее – тем больше практики.
Вишенков С.А., «Химические и электротермохимические способы осаждения металлопокрытий».

Флеров В.Н., «Химические технологии в производстве радиоэлектронных деталей»
Свиридов, «Химическое осаждение металлопокрытий»: растворы, элементы теории
Задачник Флерова – всякая расчётная часть, реакторы металлизации
Лекция 1. 04/11/15 1 вопрос
Химическая металлизация – это способ нанесения металлопокрытий без применения электрического тока. Процесс ведётся из водных растворов за счёт протекания на поверхности деталей определённых химических реакций. Это – относительно новое, развивающееся направление процессов металлизации.
Химическим способом
наносят достаточно много металлов: Cu,
Ni,
Co,
Fe,
Pd,
Au,
Ag,
Pt,
Ro,
Rt
и их сплавы. Элементы химической
металлизации известны ~200 лет, например
– получение медных зеркал, когда на
поверхность стекла химическим способом
наносится слой меди; реакция серебряного
зеркала, когда под действием восстановителя
серебро из ионного состояния
восстанавливается на стенках реактора
до металла в виде зеркала.
Бурный рост процессов химической металлизации начался в середине прошлого века, когда, уже в промышленном масштабе, на разнообразные металлические и не металлические детали стали наносить относительно толстые покрытия с нужными функциональными свойствами. Такие технологии за рубежом получили торговое название «Kanigen» (NiF) и «Nibogur» (Ni-B).
Развитие процессов
химической металлизации произошло
из-за того, что в данной технологии можно
получить достаточно толстое, максимально
равномерное по толщине покрытие на
сложном профиле детали. При этом источники
тока не требуются, аноды и электрические
контакты не нужны, можно проводить
металлизацию различных основ, как
металлических, так и диэлектрических,
включая стекло, пластмассы, ткани,
порошки, волокна и тому подобное. Также
можно металлизировать такие детали, к
участкам которых электрический контакт
подвести или очень сложно, или невозможно
вообще: на некоторых печатных платах
количество участков под металлизацию
может достигать нескольких сотен.
Процесс химической
металлизации расширился с развитием
электронной техники, где детали очень
миниатюрны, со множеством контактных
площадок. На таких деталях часто
используются покрытия из драгоценных
металлов для обеспечения проведения
сборочных операций (пайка, сварка). Кроме
того, в случае благородных металлов, за
счёт максимальной равномерности толщины,
можно экономить драгоценные металлы
при металлизации сложных по профилю
деталей. Затраты золота на технические
нужды исчисляются сотнями тонн в год,
поэтому, применяя химические методы
осаждения благородных металлов, можно
существенно снизить затраты золота или
других металлов. Кроме того, при химическом
осаждении металлопокрытий можно получить
различные сплавы, многокомпонентные,
включающие в себя как несколько металлов,
так и сплавы металла с неметаллом.
Неметалл включается в покрытие благодаря
протеканию химических реакций
непосредственно в процессе восстановления.
Такие сплавы трудно получить металлургическим путём (или вообще невозможно), и такие сплавы обладают рядом ценных характеристик: хорошей коррозионной стойкостью, высокой твёрдостью и износостойкостью, термостойкостью, способностью к пайке и сварке, относительно низким и стабильным электрическим сопротивлением. В ряде случаев, такие сплавы могут на некоторых изделиях заменять покрытия (гальванические) из драгоценных металлов, что даёт дополнительную экономию. Функциональными свойствами таких сплавов можно управлять, можно получать покрытия с необходимыми свойствами.
Недостатки: как
правило, процессы химической металлизации
– высокотемпературные, t
> 90 C.
Скорости процессов металлизации –
меньше, чем в гальванике, и эти скорости
уменьшаются во времени по мере выработки
компонентов раствора в ходе протекания
процесса. Растворы – не вечные, и продукты
реакции, накапливаясь, делают раствор
не работоспособным. Получаются большие
объёмы отработанных растворов, которые
нужно направлять на утилизацию.
Исходя из этого, обычные металлические реакторы нельзя применять. Чаще используют реакторы из стекла, фарфора, фторопласта и некоторых термостойких пластмасс. Если рассматривать технологию электроосаждения и химического осаждения металлов, то, несмотря на определённую конкуренцию между ними, каждый из этих процессов дополняет другой, и в зависимости от вида детали, материала, конфигурации и свойств покрытия всегда можно подобрать оптимальную технологию нанесения металлопокрытия.
Контактный обмен.
Берётся ячейка,
туда погружается деталь. Если потенциал
металла-1 более отрицателен, чем потенциал
металла-2, то происходит контактный
обмен и на поверхности детали осаждается
слой металлопокрытия.
Контактная медь, контактное золото и так далее. Процесс кончается тогда, когда потенциалы выравниваются, т.е. поверхность основы зарастает слоем металлопокрытия. Поэтому толстые покрытия получить нельзя, а т.к. основа подрастворяется, прочность сцепления покрытия с основой плохая. Такая технология практически не применятся для ответственных деталей.
Гальванический способ
Требуются источники тока, аноды. Неравномерное покрытие – неудобно и не выгодно. Возникают затраты электроэнергии, электролиты часто вредные. На аноде растворяется металл, на катоде он садится.
Химическая металлизация
Отличительной
особенностью является наличие в растворе
обязательного компонента – восстановителя,
который является донором электронов и
поставляет их ионам металла покрытия,
которые высаживаются на поверхности
детали. Металл детали должен обладать
каталитическими свойствами к реакции
окисления восстановителя.
Металл детали должен обладать
каталитическими свойствами к реакции
окисления восстановителя.
Слой получается равномерным на любом сложном профиле. Не все металлические основы первоначально являются катализаторами, и часто их принудительно нужно делать каталитически активными. С другой стороны, если металл стал катализатором или был им, то процесс окисления восстановителя пойдёт самопроизвольно, а т.к. само металлопокрытие является катализатором, значит, восстановитель будет окисляться на нём, давая электроны, благодаря чему процесс самовозобновляется и может идти достаточно долго, особенно в условиях корректировки раствора по расходуемым компонентам. Можно получать достаточно толстые и равномерные покрытия.
Каталитически
активных основ не столь много, например:
для химического никелирования – это
железо, никель, кобальт, палладий, рений;
все другие металлические основы (медь,
свинец, латунь, алюминий) надо делать
каталитически активными, применяя
способы различной предварительной
подготовки.
Основные восстановители, применяемые в процессах химической металлизации.
Формула | Название | Обозначение | Рабочая температура, С | Равновесный потенциал | pH | Скорость металлизации, мкм/ч |
NaH2PO2 | Гипофосфит натрия | ГФ | 90-98 (иногда 40-60) | -1,57 | 4-5 или 8-9 | 20-25 |
| NaBH4 | Боргидрид натрия | БГ | 90-98 | -1,24 | 13-14 | 20-25 |
(CH3)2HN*BH3 | Диметиламиноборан | ДМАБ | 50-80 | -1,15 | 4-10 | 7-9 |
N2H7*H2O | Гидразингидрат | ГГ | 85-95 | 8-10 | 4-12 | |
N2H4*BH3= | Гидразинборан | ГБ | 20-25 | Хз | 8-10 | 0,5-1,5 |
CH2O | Формалин | Ф | 18-25 | -1,09 | 11-13 | 0,5-1,5 |
Боргидрид натрия
разлагается при pH<13.
Диметилборан годится для металлизации не термостойких материалов, лёгких металлов и сплавов, которые не корродируют в нейтральной среде.
Гидразинборан рекомендовали для нанесения первого, тонкого слоя металла на поверхность диэлектрика, а затем уже по такому слою, за счёт технологий электроосаждения, наращивали толстые слои необходимых металлопокрытий, например – меди.
Силу восстановителя можно восстановить исходя из его равновесного потенциала. Чем более отрицательный потенциал, тем сильнее должен быть восстановитель. Здесь более важно соотношение между потенциалом восстановителя и потенциалом осаждаемого металла. Движущая сила процесса будет тем больше, чем более положительным будет потенциал металлопокрытия. Но потенциал металлопокрытия будет зависеть от состава электролита, наличия лигандов, pH раствора, концентрации, температуры. На движущую силу мы сможем влиять.
Важно, сколько
электронов может поставлять восстановитель
в ходе своего окисления. Количество
электронов будет зависеть от механизма
процесса, который будет реализовываться
в конкретных условиях, и не всегда
реализуются максимальные условия
поставки электронов в ходе окисления
восстановителя. Например, максимальное
количество электронов для боргидрида
– 8, для аминоборанов – 6, для гидразинов
– 4, для гипофосфита – 2. В реальности,
количество поставляемых электронов в
два раза меньше.
Количество
электронов будет зависеть от механизма
процесса, который будет реализовываться
в конкретных условиях, и не всегда
реализуются максимальные условия
поставки электронов в ходе окисления
восстановителя. Например, максимальное
количество электронов для боргидрида
– 8, для аминоборанов – 6, для гидразинов
– 4, для гипофосфита – 2. В реальности,
количество поставляемых электронов в
два раза меньше.
Важное свойство восстановителей – возможность получения с их помощью сплавов, включающих металл и не металл, которые обладают важными функциональными свойствами.
Вид сплава металла с неметаллом будет зависеть от вида восстановителя и вида ионов металлопокрытия.
ГФ | БГ | ДМАБ | Ф | ГГ | |
Ni2+ | Ni-P | Ni-B | Ni-B | — | Ni |
Co2+ | Co-P | Co-B | Co-B | — | — |
Fe2+ | Fe-P | Fe-B | Fe-B | — | — |
Pd2+ | Pd-P | — | Pd-B | — | Pd |
Cu2+ | Cu | Cu-B | Cu-B | Cu | — |
Au+ | Au | Au | Au | — | — |
Подбирая
восстановитель и нужные ионы металла,
можно получать как двухкомпонентные
сплавы, так и многокомпонентные. Например,
Ni-Co-F
или Ni-Fe-B.
В практике, наиболее широко применяются
химические покрытия из меди, никеля,
золота и, реже, серебра. Химическое
меднение широко применяется в производстве
печатных плат, для металлизации внутренних
поверхностей отверстий, которые соединяют
слои платы между собой. В результате
формирования таких отверстий методом
сверления связь между частями платы
нарушается, и внутренняя поверхность
отверстий достаточно малого размера
должна быть токопроводящей. Процесс
химического меднения позволяет, после
специальной подготовки, нанести металл
и соединить внутренние слои платы между
собой.
Например,
Ni-Co-F
или Ni-Fe-B.
В практике, наиболее широко применяются
химические покрытия из меди, никеля,
золота и, реже, серебра. Химическое
меднение широко применяется в производстве
печатных плат, для металлизации внутренних
поверхностей отверстий, которые соединяют
слои платы между собой. В результате
формирования таких отверстий методом
сверления связь между частями платы
нарушается, и внутренняя поверхность
отверстий достаточно малого размера
должна быть токопроводящей. Процесс
химического меднения позволяет, после
специальной подготовки, нанести металл
и соединить внутренние слои платы между
собой.
Другое направление
химического меднения – создание первого
электропроводящего слоя на поверхности
пластмасс под декоративную отделку.
После специальной подготовки, на
поверхность диэлектрика наносится
тонкий слой химической меди (не более
1,5 мкм), который делает поверхность
диэлектрика электропроводной, а значит,
по этому слою можно дополнительно
наращивать гальванически другие слои
металла, вплоть до получения многослойных
покрытий. Например, слой гальванической
меди, слой никеля и верхний слой хрома.
Такая технология используется для
декоративной отделки деталей приборов
или деталей автомобилей. Используется
дешёвый и доступный формалин.
Например, слой гальванической
меди, слой никеля и верхний слой хрома.
Такая технология используется для
декоративной отделки деталей приборов
или деталей автомобилей. Используется
дешёвый и доступный формалин.
Наиболее широкое применение имеет процесс химического никелирования. Он позволяет получать фосфор- или борсодержащие никелевые покрытия, которые обладают высокой коррозионной стойкостью, очень высокой твёрдостью и износостойкостью, термостойкостью на воздухе, а также теми свойствами, которые нужны для изделий электронной техники и приборостроения, для проведения сборочных операций. Размеры детали могут быть различными, от турбин ГЭС и до деталей часовой техники.
Достаточно широко
применяются процессы химического
золочения. Этот процесс реализуется в
электронной технике для замены
традиционного гальванического золочения.
Цель – экономия драгоценных металлов.
Такая экономия достигается за счёт
повышения равномерности толщины и за
счёт того, что не нужны аноды из драгоценных
металлов и не нужны токоподводы, куда
неизбежно будет осаждаться золото.
Процесс химического золочения особенно выгоден на различных микроизделиях, где существуют различные, не связанные между собой в единую цепь, участки, подлежащие металлизации. При химическом золочении толщину покрытий можно менять, используя те или иные растворы. Первоначально, толщина золотого покрытия должна была быть порядка 3-3,5 мкм, и, в случае использования электроосаждения, толщина получалась примерно в 2 раза больше, идёт перерасход. В последнее время применяется тонкослойное золотое покрытие, где для проведения сборочных операций достаточно толщины в 1,5 мкм и менее. В этом случае процесс химического золочения ещё более выгоден, т.к. такие скорости металлизации реализуются практически во всех растворах химического золочения.
Покрытия из других
благородных металлов используются
реже; серебряные покрытия используют
в различных электрических контактах,
такие покрытия, за счёт атмосферных
воздействий, ухудшают свои электрические
характеристики. Для ответственных
деталей и различных контактов можно
использовать покрытия из палладия, так
как он является более твёрдым по сравнению
с серебром и золотом и контакты могут
служить более длительное время.
Для ответственных
деталей и различных контактов можно
использовать покрытия из палладия, так
как он является более твёрдым по сравнению
с серебром и золотом и контакты могут
служить более длительное время.
Во времена роста экономики, использование химически осаждённых покрытий в год увеличивалось на 15-50%.
Лекция 2. 11/11/15
Гальваника — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 272
Гальванопокрытие — это процесс нанесения одного металла на другой путем гидролиза, чаще всего в декоративных целях или для предотвращения коррозии металла. Существуют также особые виды гальванического покрытия, такие как меднение, серебрение и хромирование. Гальваническое покрытие позволяет производителям использовать недорогие металлы, такие как сталь или цинк, для большей части продукта, а затем наносить различные металлы на внешнюю сторону, чтобы обеспечить внешний вид, защиту и другие свойства, желаемые для продукта. Поверхность может быть металлической или даже пластиковой.
Гальваническое покрытие позволяет производителям использовать недорогие металлы, такие как сталь или цинк, для большей части продукта, а затем наносить различные металлы на внешнюю сторону, чтобы обеспечить внешний вид, защиту и другие свойства, желаемые для продукта. Поверхность может быть металлической или даже пластиковой.
Введение
Иногда отделка носит исключительно декоративный характер, например, продукты, которые мы используем в помещении или в сухой среде, где они вряд ли будут подвержены коррозии. На эти типы продуктов обычно наносится тонкий слой золота или серебра, что делает их привлекательными для потребителя. Гальваника широко используется в таких отраслях, как автомобилестроение, авиастроение, электроника, ювелирные изделия и игрушки. В общем процессе гальванического покрытия используется электролитическая ячейка, которая состоит из нанесения отрицательного заряда на металл и погружения его в раствор, содержащий соль металла (электролиты), которые содержат положительно заряженные ионы металла. Затем из-за отрицательного и положительного зарядов два металла притягиваются друг к другу.
Затем из-за отрицательного и положительного зарядов два металла притягиваются друг к другу.
Цели гальваники:
- Внешний вид
- Защита
- Специальные свойства поверхности
- Инженерные или механические свойства
Исходная информация
Катод представляет собой деталь, подлежащую покрытию, а анод может представлять собой расходуемый анод или инертный анод, обычно платиновый или углеродный (графитовая форма). Иногда покрытие происходит на стеллажах или бочках для повышения эффективности при покрытии многих продуктов. Пожалуйста, обратитесь к электролизу для получения дополнительной информации. На рисунке ниже Ag 9Ионы 0044 + притягиваются к поверхности ложки, и в конце концов она покрывается металлом. Процесс осуществляется с использованием серебра в качестве анода и винта в качестве катода. Электроны переходят от анода к катоду и претерпевают раствор, содержащий серебро.
Рисунок 1 : Нанесение серебра на ложку.
История гальваники
Гальванизация была впервые открыта Луиджи Бруньятелли в 1805 году благодаря использованию процесса электроосаждения для гальванического покрытия золота. Однако его открытие не было отмечено, так как его игнорировала Французская академия наук, а также Наполеон Бонапарт. Но спустя пару десятилетий Джону Райту удалось использовать цианистый калий в качестве электролита для золота и серебра. Он обнаружил, что цианид калия на самом деле является эффективным электролитом. Позже, в 1840 году, двоюродные братья Элкингтон использовали цианистый калий в качестве электролита и сумели создать реальный метод гальванического покрытия золота и серебра. Они получили патент на гальваническое покрытие, и этот метод получил широкое распространение по всему миру из Англии. Метод гальванического покрытия постепенно становился все более эффективным и совершенным за счет использования более экологичных формул и источников питания постоянного тока.
Выбор электролитов
Существует множество различных металлов, которые можно использовать для гальванопокрытий, поэтому выбор правильного электролита важен для качества гальванопокрытий. Некоторые электролиты представляют собой кислоты, основания, соли металлов или расплавленные соли. При выборе типа электролита следует помнить о таких вещах, как коррозия, сопротивление, яркость или отражательная способность, твердость, механическая прочность, пластичность и износостойкость.
Некоторые электролиты представляют собой кислоты, основания, соли металлов или расплавленные соли. При выборе типа электролита следует помнить о таких вещах, как коррозия, сопротивление, яркость или отражательная способность, твердость, механическая прочность, пластичность и износостойкость.
Подготовка поверхности
Целью подготовки поверхности перед началом нанесения на нее другого металла является обеспечение ее чистоты и отсутствия загрязнений, которые могут помешать склеиванию. Загрязнение часто предотвращает осаждение и отсутствие адгезии. Обычно это делается в три этапа: очистка, обработка и ополаскивание. Очистка обычно заключается в использовании определенных растворителей, таких как щелочные очистители, вода или кислотные очистители, для удаления слоев масла с поверхности. Обработка включает модификацию поверхности, заключающуюся в упрочнении деталей и нанесении металлических слоев. Промывка приводит к получению конечного продукта и является последним штрихом гальванического покрытия. Два определенных метода подготовки поверхности — это физическая очистка и химическая очистка. Химическая очистка заключается в использовании растворителей, которые являются либо поверхностно-активными химическими веществами, либо химическими веществами, вступающими в реакцию с металлом/поверхностью. При физической очистке применяется механическая энергия для удаления загрязнений. Физическая очистка включает трение щеткой и ультразвуковое перемешивание.
Два определенных метода подготовки поверхности — это физическая очистка и химическая очистка. Химическая очистка заключается в использовании растворителей, которые являются либо поверхностно-активными химическими веществами, либо химическими веществами, вступающими в реакцию с металлом/поверхностью. При физической очистке применяется механическая энергия для удаления загрязнений. Физическая очистка включает трение щеткой и ультразвуковое перемешивание.
Типы гальванического покрытия
Существуют различные процессы, с помощью которых люди могут гальванизировать металлы, такие как массовая гальваника (также гальваническая гальваника), гальваническая гальваника, непрерывное гальванопокрытие и гальваническое покрытие. Каждый процесс имеет свой собственный набор процедур, которые позволяют получить идеальное покрытие.
| Массовое покрытие | Не подходит для деталей с деталями, поскольку неэффективен для предотвращения царапин и запутывания. Тем не менее, этот процесс эффективно размещает большое количество объектов. Тем не менее, этот процесс эффективно размещает большое количество объектов. |
|---|---|
| Покрытие стойки | Дороже, чем массовое покрытие, но эффективно как для крупных, так и для хрупких деталей. Часто имеет детали, погруженные в растворы со «стойками». |
| Непрерывное покрытие | Такие детали, как провода и трубки, постоянно проходят через аноды с определенной скоростью. Этот процесс немного дешевле. |
| Линейное покрытие | Дешевле, так как используется меньше химикатов и используется производственная линия для нанесения покрытия на детали. |
Гальванические металлы
Большинство гальванических покрытий можно разделить на следующие категории:
| Жертвенное покрытие | Декоративное покрытие | Функциональные покрытия | Мелкие металлы | Необычное металлическое покрытие | Покрытия из сплава |
|---|---|---|---|---|---|
используется в основном для защиты. Металл, используемый для покрытия, расходуется в реакции. Общие металлы включают: цинк и кадмий (в настоящее время запрещены во многих странах). Металл, используемый для покрытия, расходуется в реакции. Общие металлы включают: цинк и кадмий (в настоящее время запрещены во многих странах). | используется в основном для привлекательности и привлекательности. Общие металлы включают: медь, никель, хром, цинк и олово. | — это покрытия, сделанные в зависимости от необходимости и функциональности металла. Обычные металлы включают: золото, серебро, платину, олово, свинец, рутений, родий, палладий, осмий и иридий. | обычно представляют собой железо, кобальт и индий, потому что на них легко наносить покрытие, но они редко используются для покрытия. | — это металлы, которые еще реже используются для гальванического покрытия, чем второстепенные металлы. К ним относятся: As, Sb, Bi, Mn, Re, Al, Zr, Ti, Hf, V, Nb, Ta, W и Mo. | Сплав — это вещество, обладающее металлическими свойствами и состоящее из двух или более элементов. Эти покрытия изготавливаются путем нанесения двух металлов в одну и ту же ячейку. Общие комбинации включают: золото-медь-кадмий, цинк-кобальт, цинк-железо, цинк-никель, латунь (сплав меди и цинка), бронза (медь-олово), олово-цинк, олово-никель и олово-цинк. кобальт. Эти покрытия изготавливаются путем нанесения двух металлов в одну и ту же ячейку. Общие комбинации включают: золото-медь-кадмий, цинк-кобальт, цинк-железо, цинк-никель, латунь (сплав меди и цинка), бронза (медь-олово), олово-цинк, олово-никель и олово-цинк. кобальт. |
Ссылки
- Канани, Н. Гальваника: основные принципы, процессы и практика; Передовые технологии Elsevier: Оксфорд, Великобритания, 2004 г. .
- Ловенхайм, Фридрих Адольф. Современная гальваника . 3-е изд. Нью-Йорк, штат Нью-Йорк: J. Wiley and Sons, 1974. .
- Блюм, Уильям и Джордж Б. Хогабум. Принципы гальваники и гальванопластики (электротипирование) . 3-е изд. Нью-Йорк, штат Нью-Йорк: McGraw-Hill Book Company Inc., 19.49. Печать.
- Петруччи, Ральф Х., Харвуд, Уильям С., Херринг, Ф.Г., и Мадура Джеффри Д. Общая химия: принципы и современные приложения. 9-е изд. Река Аппер-Сэдл: Pearson Education, Inc., 2007. .

Проблемы
- Каковы цели гальваники?
- Как работает гальваника?
- Почему важно подготовить поверхность перед началом гальванического покрытия?
- Какие бывают виды гальваники?
- Какие разные металлы можно использовать? (имя 5)
Ответы
- Обычно гальваническое покрытие используется либо в декоративных, либо в функциональных целях, а также для предотвращения коррозии металла.
- Гальванические работы через электролизер с катодом и анодом. Катод — это металл, который необходимо покрыть.
- Важно подготовить поверхность перед началом процедуры, так как иногда на поверхности есть загрязнения, которые могут привести к плохим результатам гальванического покрытия.
- Различают следующие типы гальваники: массовая гальваника (также гальваническая гальваника), гальваническая гальваника, непрерывное гальванопокрытие и гальваническое покрытие.
- Пять металлов, которые можно использовать в гальванике: цинк, кобальт, железо, олово и платина
Авторы и ссылки
- Вайшали Миттал (Калифорнийский университет в Дэвисе)
Гальваника распространяется под лицензией CC BY-NC-SA 4. 0 и была создана, изменена и/или курирована LibreTexts.
0 и была создана, изменена и/или курирована LibreTexts.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Лицензия
- CC BY-NC-SA
- Версия лицензии
- 4,0
- Показать страницу TOC
- № на стр.
- Теги
- гальваническое покрытие
Определение, процесс, пример и уравнение
- Как работает гальваническое покрытие
- Факторы, влияющие на гальваническое покрытие [7]
- Применение [1] металл на другой контролируемым электролизом.
 В результате этого процесса на поверхность дешевого металла наносится тонкий слой драгоценного металла. Он в основном используется для изменения внешнего вида вещества, делая тусклую поверхность блестящей. Многие металлы, такие как золото, серебро, медь, никель и хром, покрываются таким образом. Неметалл, такой как пластик, дерево или стекло, который не проводит электричество, должен быть сделан проводящим перед нанесением покрытия [1-4] .
В результате этого процесса на поверхность дешевого металла наносится тонкий слой драгоценного металла. Он в основном используется для изменения внешнего вида вещества, делая тусклую поверхность блестящей. Многие металлы, такие как золото, серебро, медь, никель и хром, покрываются таким образом. Неметалл, такой как пластик, дерево или стекло, который не проводит электричество, должен быть сделан проводящим перед нанесением покрытия [1-4] .Итальянский химик Луиджи Валентино Бруньятелли изобрел гальваническое покрытие в 1805 году.
Как работает гальваническое покрытие
Гальваническое покрытие работает по принципу электролиза и происходит в электролизере. Ячейка состоит из анода и катода, погруженных в электролит. Анод изготавливается из металла, подлежащего покрытию. Катод – это металл, на котором происходит осаждение. Концы двух электродов соединены через батарею. Анод подключается к положительному концу, а катод подключается к отрицательному концу.
 Электролит состоит из раствора соли осаждаемого металла [1-6] .
Электролит состоит из раствора соли осаждаемого металла [1-6] .Когда батарея включена, по цепи протекает ток. Окисление происходит на аноде, где металл теряет электроны и растворяется в растворе электролита. Эти растворенные ионы металлов из электролита мигрируют к катоду. Восстановление происходит на катоде, где металл получает электроны и осаждается. Ток, проходящий через цепь, регулируется таким образом, чтобы скорость растворения анода равнялась скорости покрытия катода.
Пример
Рассмотрим пример гальваники. Предположим, что медь была покрыта цинком. В этом случае должны быть медный анод, цинковый катод и раствор соединения на основе меди, такого как сульфат меди.
При включении батареи электроды заряжаются. Положительно заряженные ионы меди притягиваются к отрицательно заряженному катоду. Они мигрируют и осаждаются поверх цинка, образуя тонкий слой. С другой стороны, отрицательно заряженные ионы сульфата движутся к положительно заряженному аноду и освобождают свои электроны.


