1)Дайте определение понятиям :раствор, растворитель, растворенное вещество. Современная классификация плазмозаменяющих растворов в медицине.
В растворах протекает большее количество химических реакций организма. Раствор – это идеальная транспортная система, которая доставляет необходимые лекарственные средства непосредственно во внутреннюю среду организма. Также растворённые препараты лучше усваиваются организмом.
Раствор — это гомогенная система переменного состава, состоящая из двух и более независимых компонентов и продуктов их взаимодействия.
Растворитель — компонент, агрегатное состояние которого не изменяется при образовании раствора. При одинаковых агрегатных состояниях компонентов растворителем считают то вещество, содержание которого в растворе больше.
Растворенное вещество-компонент, молекулы или ионы которого равномерно распределены в объеме растворителя.
Плазмозаменяющие растворы( классификация):
1)Гемодинамические(
противошоковые) растворы — предназначены для лечения шока
различного происхождения и восстановления
гемодинамики, в том числе микроциркуляции,
при использовании аппаратов искусственного
кровообращения для разведения крови
во время операции.
2)Дезинотоксикационные растворы, применяемые при интоксикации различной этилогии. К лекарственным средствам этой группы относятся такие препараты, как гемодез, неогемодез, глюконеодез и др. Помимо поливинилпирролидона в состав растворов входят ионы магния, калия, кальция, натрия и хлора.
3)Регуляторы водно-солевого баланса и кислотно-основного состояния: солевые растворы (растворы электролитов), осмотические диуретики (глицерол, маннитол и мочевина)
4)Растворы для парентерального питания, которые служат для обеспечения энергетических ресурсов организмв, доставки питательных веществ к органам и тканям. Например, растворы аминокислот, жировые эмульсии, поливитаминные комплексы и микроэлементы; комбинированные препараты.
5)Переносчики кислорода, восстанавливающие дыхательную функцию крови( растворы модифицированного гемоглобина человека; эмульсии порфторуглеродов (ПФУ) например, перфторан)
6)Комплексные
( полифункциональные) растворы,
обладающие широким диапазоном действия,
которые могут состоять из нескольки
групп плазмозаменяющих растворов.
2)Дайте определения, поясните физический смысл следующих способов выражения концентраций веществ в растворе: массовая доля, молярная концентрация, титр.
Массовая доля растворенного вещества w(Х)- величина равная отношению массы растворенного вещества m(Х) к массе раствора. Массовая доля вещества в растворе величина безразмерная, она показывает , сколько граммов растворенного вещества содержится в 100 г раствора. Используется для характеристики лекарственных препаратов, физиологических растворов.
Молярная концентрация вещества в растворе с(Х)- величина, равная отношению количества растворенного вещества к объему раствора. Молярная концентрация вещества в растворе показывает, какое количество растворенного вещества содержится в 1 л раствора. Основная единица измерения в СИ — моль/м3, на практике-моль/л. Применяется для выражения концентрации различных веществ в биологических жидкостях.
Титр растворенного
вещества T(X)- это масса растворенного
вещества Х, содержащаяся в 1 мл
раствора. Измеряется в г/см3, допускается
записать г/мл. Это способ используется
в микробиологии, общей гигиене,
иммунологии.
Измеряется в г/см3, допускается
записать г/мл. Это способ используется
в микробиологии, общей гигиене,
иммунологии.
3)
Молярная концентрация эквивалента вещества Х, с(1X) –величина, равная отношению количества вещества эквивалента n(z1X) в растворе к объему этого раствора. Запись «0,1 н. h3SO4» означает, что молярная концентрация эквивалента вещества h3SO4 равна 0,1 моль/л, т.е. в 1 л раствора содержится 0,1 моль эквивалента вещества h3SO4.
Моляльная концентрация вещества Х в растворе, сm(Х) – это величина, равная отношению количества вещества к массе растворителя. Запись «сm(h3SO4) = 0,15 моль/кг» означает, что в 1 кг раствори- теля содержится 0,15 моль вещества h3SO4.
Молярная
доля растворенного вещества N(X) – величина, равная отношению количества
вещества данного компонента к сум
марному количеству всех компонентов,
входящих в состав раствора, включая
растворитель n(A).
Эквивалент- реальная или условная частица вещества Х, которая в данной кислотно-основной реакции может присоединять, отдавать или быть каким-либо другим образом эквивалентна одному иону водорода или одному электрону в данной ОВР.
Фактор эквивалентности fэкв(Х) — число, показывающее, какая доля реальной частицы вещества Х эквивалентна одному иону водорода в данной кислотно-основной реакции или одному электрону в данной ОВР.
4)Укажите основные способы приготовления растворов. Дайте краткую характеристику этим способам.
Существует 3 способа приготовления растворов заданных концентраций: 1.Из навески твердого вещества 2.Разбавлением более концентрированного раствора. 3.Из фиксанала.
Приготовление
раствора из навески тв. вещества. 1.Рассчитать
массу вещества.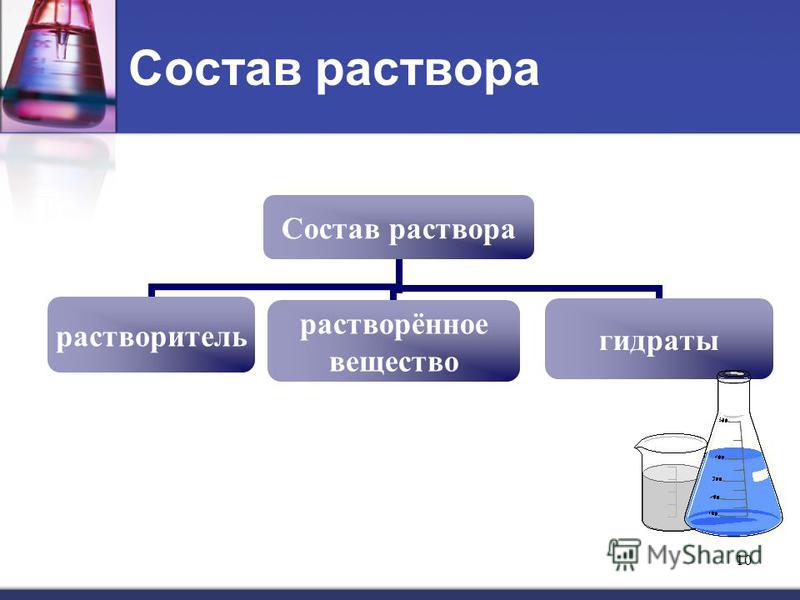 2.Сделать расчет
навески.
3.Взвесить на аналитических
весах (для приготовления первичного
стандартного раствора) или на технических
(для приготовления вторичного).
4.Перенести
навеску в мерную колбу нужного
объема.
5.Добавить воду в колбу до метки
и перемешать.
6.Стандартизировать
вторичный стандартный раствор.
2.Сделать расчет
навески.
3.Взвесить на аналитических
весах (для приготовления первичного
стандартного раствора) или на технических
(для приготовления вторичного).
4.Перенести
навеску в мерную колбу нужного
объема.
5.Добавить воду в колбу до метки
и перемешать.
6.Стандартизировать
вторичный стандартный раствор.
Приготовление раствора из фиксанала. 1.Выбрать мерную колбу в соответствии с требуемым объемом приготовляемого раствора. 2.Обмыть ампулу фиксанала и разбить бойком над воронкой в колбе. 3.Перенести содержимое ампулы через воронку в выбранную мерную колбу. 4.Промыть ампулу через воронку в колбу. 5.Добавить воду в колбу до метки и перемешать.
Приготовление
раствора разбавлением конц.
раствора. 1.Определить
плотность исходного концентрированного
раствора с помощью ареометра.
2.Сделать
расчет объема концентрированного
раствора.
3.Отмерить необходимый объем
концентрированного раствора
цилиндра.
4.Перенести концентрированный
раствор: а) в мерную колбу нужного
объема,
б) в немерную химическую посуду
для приготовления раствора с массовой
долей вещества в раствора.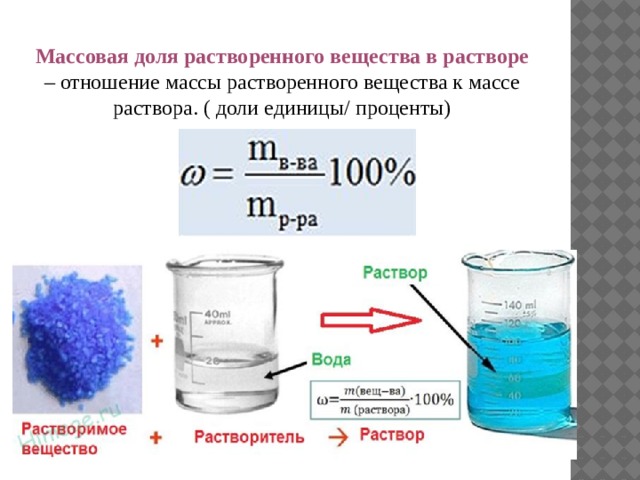
5)Что такое титриметрический анализ? Какое правило лежит в основе этого метода. Укажите его математическое выражение. Какие требования предъявляют к реакциям, лежащим в основе титриметрического анализа.
Титриметрический анализ — метод количественного анализа, основанный на точном измерении объема раствора реагента, израсходованного на эквивалентное взаимодействие с определяемым веществом.
В основе анализа определяемого вещества титриаметрическим методом лежит проведение химической реакции и установление состояния эквивалентности между взаимодействующими веществами
Требования: 1.
Вещества, вступающие в реакцию должны
реагировать в строго определенных
количественных соотношениях.
2.Реакции
должны протекать быстро и количественно
, т.е быть практически необратимыми.
Закон эквивалентов: В химических реакциях число моль эквивалентов всех веществ, вступивших в реакцию и образовавшихся в ней, всегда равны между собой.
Математическое выражение: С(f экв A)*V(A) = С(f экв B)*V (B)
Растворы. Растворители. 9-й класс
- Алексеева Любовь Сергеевна, учитель химии и биологии
Класс: 9
Цели:
- Организовать деятельность учащихся по восприятию, осмыслению таких
понятий как: раствор, растворитель, полярный растворитель, неполярный
растворитель.
 Усвоение закономерностей, которым подчиняются растворы.
Усвоение закономерностей, которым подчиняются растворы. - Развивать умения выделить главное, существенное в изучаемом материале.
- Обеспечить закрепление знаний и способов деятельности учащихся.
Ход урока
I. Организационный момент.
II. Подготовка учащихся к работе на основном этапе.
Четвёртый лишний. (Приложение. Слайд 1.)
- Морская вода.
- Клеточный сок.
- Минеральная вода “Аршан”.
- Дистиллированная вода.
Лишняя дистиллированная вода (т.к. всё остальное растворы).
Эпиграфом урока предлагаю взять слова академика Карпинского А.П (Cлайд 3):
““Растворы – это живая кровь, которая создает жизнь там, где ее не было”.
Рассмотрим биологическую роль растворов для живых организмов. (Cлайд 4 “видеофрагмент”.)
“Значение растворов в природе в возникновении и развитии жизни на земле
трудно переоценить. Именно в первичном океане впервые развились живые организмы
и из этого раствора они получили молекулы и ионы необходимые для их роста и
жизни. С течением времени живые организмы развивались и изменялись, что
позволило им покинуть водную среду, перейти на сушу и затем подняться в воздух.
Они приобрели эту способность сохранив в своих организмах водный раствор в виде
жидкости содержащих необходимый запас ионов и молекул. Внутри нас в каждой нашей
клеточке воспоминание о первичном растворе в котором зародилась жизнь. Водные
растворы обеспечивающие саму жизнь.” [1]
Именно в первичном океане впервые развились живые организмы
и из этого раствора они получили молекулы и ионы необходимые для их роста и
жизни. С течением времени живые организмы развивались и изменялись, что
позволило им покинуть водную среду, перейти на сушу и затем подняться в воздух.
Они приобрели эту способность сохранив в своих организмах водный раствор в виде
жидкости содержащих необходимый запас ионов и молекул. Внутри нас в каждой нашей
клеточке воспоминание о первичном растворе в котором зародилась жизнь. Водные
растворы обеспечивающие саму жизнь.” [1]
Вспоминаем понятие раствор (Слайд 5):
В трёх стаканах находятся (немаловажным, для детей видеть эти три стакана):
– песок и вода
– вода и медный купорос
– масло и вода
Где по вашему мнению находится раствор? Что такое раствор?
Растворы – однородная система, состоящая из двух и более компонентов (растворителя
и растворённого вещества).
III. Усвоение новых знаний и способов действия.
Лабораторные опыты:
- В пробирку насыпать немного перманганата калия и добавить воды. Разделить пробирку на две пробирки. Во вторую пробирку добавить ещё воды. Одинаковы ли количества перманганата калия, содержащиеся в обоих растворах? А растворителя?
- Попытайтесь растворить очень небольшие количества серы, кристаллического йода, поваренной соли и карбоната натрия в воде (полярный растворитель) и в бензине (неполярный растворитель). Представьте результаты опыта в виде таблицы. (Слайд 6,7.)
| Вещество | Растворимость | |
| В воде | В бензине | |
| NaCl | ||
| Na2CO3 | ||
| S | ||
| I2 | ||
Можно ли найти универсальный растворитель – жидкость, в которой можно
растворить любое вещество? (Слайд
8. )
)
Проанализируем результаты опыта и сделаем вывод:
Такого растворителя быть не может. Вещества с ионной связью, как и вещества с
ковалентной полярной связью, хорошо растворяются в полярных растворителях (например,
в воде), а вещества с неполярной связью – в неполярных растворителях (например,
в бензине).
Это правило было установлено ещё в средневековье, после длительных
поисков универсального растворителя, “алькагеста”, сформулировали правило
“Подобное растворяется в подобном”.
Проделанный нами эксперимент ещё раз показывает , что растворимость веществ
зависит от природы растворителя. От чего ещё зависит растворимость? (Слайд
9.)
Растворимость зависит от температуры. При увеличении температуры растворимость
веществ увеличивается. Но есть вещества, растворимость которых при нагревании
раствора уменьшается. Вы обращали когда-нибудь внимание на то, как ведет себя
вода в чайнике незадолго до того, как закипеть? Перед кипением, а иногда и
раньше, с самого начала нагревания, на внутренних стенках чайника или кастрюли
появляются пузырьки воздуха. Почему? (Слайд 10.)
Действительно при нагревании растворимость газов уменьшается, что приводит к
улетучиванию кислорода.
Почему? (Слайд 10.)
Действительно при нагревании растворимость газов уменьшается, что приводит к
улетучиванию кислорода.
Проанализируйте рисунок со слайда 11 и сформулируйте вывод о физиологической потребности в кислороде у рыб.
IV. Закрепление.
Пополнилась ли ваша “копилка знаний” сегодня? Если да, то что вы узнали?
Какой растворитель можно использовать для растворения P, HCl, NaI, почему? (Слайд
12.)
V. Первичный контроль. (Cлайд 13.)
Совместите части:
Вариант 1.
| 1. Полярный растворитель | А. Вода |
| 2.Неполярный растворитель | Б. Сера |
| 3. Диполь | В. Соляная кислота |
Вариант 2.
1. Полярный растворитель Полярный растворитель |
А. Йод |
| 2. Неполярный растворитель | Б. Вода |
| 3. Диполь | В. Поваренная соль |
VI. Рефлексия. (Слайд 14.)
– Выберите из ниже предложенных утверждений, соответствующее вашему мнению и настроению, и закончите фразу согласно вашему выбору.
Очередные 45 драгоценных минут моей не менее драгоценной жизни:
- потеряны безвозвратно, т.к…
- прошли с пользой, т.к…
VII . Домашнее задание. (Слайд 15.)
§6 Немного о растворителях.
“4” – с. 21 вопросы 1.
“5” – с. 21 вопрос 3.
Задание для учеников интересующихся химией: подготовить сообщение по теме: “Виды растворителей”
Творческий проект: “Какие растворы встречаются в организме человека и какова их роль?”
Литература.
- Диск Кирилла и Мефодия . Биология 10–11 класс.
- Кузнецова Н.Е. и др. Химия: Учебник для учащихся 9 класса общеобразовательных учреждений.– М.: Вентана-Граф, 2003. – 320 с.: ил.
- Кузнецова Н.Е., Шаталов М.А. Обучение химии на основе межпредметной интеграции: 8–9 классы: Учебно-методическое пособие.– М.: Вентана-Граф, 2004. – 352с.
- Зуева М.В., Гара Н.Н. Школьный практикум. Химия 8–9 кл. – М.: Дрофа, 1999.– 128 с.: ил.
В чем разница между раствором и растворителем
Ключевое различие между раствором и растворителем заключается в том, что раствор представляет собой смесь двух или более компонентов, тогда как растворитель — это отдельный компонент, который может способствовать получению раствора.
Термины раствор и растворитель тесно связаны друг с другом, поскольку растворитель составляет основу раствора. Однако между раствором и растворителем есть несколько различий.
Однако между раствором и растворителем есть несколько различий.
СОДЕРЖАНИЕ
1. Обзор и ключевые отличия
2. Что такое решение
3. Что такое растворитель
4. Решение и растворитель в табличной форме
5. Резюме – решение и растворитель
Что такое решение?
Раствор представляет собой смесь двух или более веществ, находящихся в основном в жидком состоянии. Как правило, раствор состоит из двух основных компонентов: растворителя и растворенного вещества. Мы можем растворить растворенные вещества в подходящем растворителе. Это смешение происходит в зависимости от полярности растворенных веществ и растворителя («подобное растворяется в подобном» — полярные растворенные вещества растворяются в полярных растворителях, а неполярные растворенные вещества растворяются в неполярных растворителях, но полярные растворенные вещества не растворяются в растворителях). Кроме того, природа раствора является гомогенной, что означает, что растворитель и растворенное вещество равномерно распределены по всей этой смеси.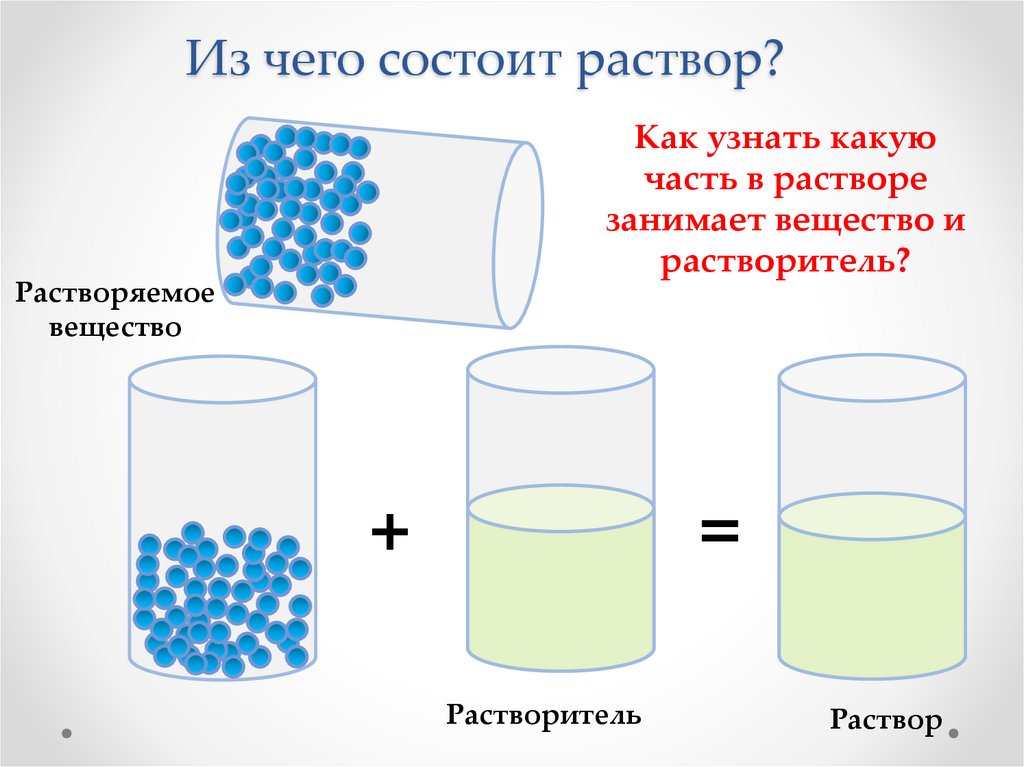
Рисунок 01: Раствор перманганата калия
Раствор обычно представляет собой прозрачное жидкое вещество без мутности. Кроме того, раствор очень стабилен и быстро диффундирует. Частицы в растворе имеют размер менее 1 нанометра. Поэтому эти частицы невозможно увидеть невооруженным глазом. Кроме того, эти частицы не оседают самопроизвольно; мы можем оседать частицы в растворе только с помощью центрифугирования. Кроме того, мы не можем разделить их частицы путем фильтрации или осаждения.
Что такое растворитель?
Растворитель – это вещество, обладающее растворяющей способностью. Таким образом, он может растворять другое вещество. Растворители также могут находиться в жидком, газообразном или твердом состоянии. Однако чаще всего мы используем жидкости в качестве растворителей. Кроме того, среди жидкостей вода распространена как универсальный растворитель, поскольку она может растворять гораздо больше веществ, чем любой другой растворитель. Более того, мы можем растворять газ, твердое вещество или любое другое жидкое растворенное вещество в жидких растворителях. Но в газовых растворителях растворяются только растворенные газы.
Но в газовых растворителях растворяются только растворенные газы.
Кроме того, существует ограничение на количество растворенных веществ, которое мы можем добавить к определенному количеству растворителя. Мы говорим, что раствор стал насыщенным, если мы добавили к растворителю максимальное количество растворенных веществ. Существует два типа растворителей: органические и неорганические растворители. Например, эфир, гексан и метиленхлорид являются органическими растворителями, тогда как вода является неорганическим растворителем.
Рисунок 02: MOED в различных растворителях
Существуют также две широкие категории растворителей: полярные растворители и неполярные растворители. Молекулы полярного растворителя имеют разделение зарядов и поэтому способны растворять полярные растворенные вещества. В процессе растворения могут возникать диполь-дипольные взаимодействия или индуцированные диполем дипольные взаимодействия. Далее мы можем разделить полярные растворители на полярные протонные и полярные апротонные растворители. Полярные протонные растворители способны образовывать водородные связи с растворенными веществами. Следовательно, они сольватируют анионы водородными связями. Вода и метанол являются полярными протонными растворителями. Полярные апротонные растворители не могут образовывать водородные связи. Однако они обладают большими дипольными моментами, образуют диполь-дипольные взаимодействия с растворенными ионами и сольватируют их. Ацетон — полярный апротонный растворитель.
Полярные протонные растворители способны образовывать водородные связи с растворенными веществами. Следовательно, они сольватируют анионы водородными связями. Вода и метанол являются полярными протонными растворителями. Полярные апротонные растворители не могут образовывать водородные связи. Однако они обладают большими дипольными моментами, образуют диполь-дипольные взаимодействия с растворенными ионами и сольватируют их. Ацетон — полярный апротонный растворитель.
В чем разница между раствором и растворителем?
Раствор и растворитель являются родственными терминами с некоторыми различиями между ними. Ключевое различие между раствором и растворителем заключается в том, что раствор представляет собой смесь двух или более компонентов, тогда как растворитель — это один компонент, который может способствовать получению раствора. Например, водный раствор хлорида натрия является гомогенным раствором, а растворителем в этом растворе является вода.
Приведенная ниже инфографика представляет различия между раствором и растворителем в табличной форме для параллельного сравнения.
Резюме – раствор против растворителя
Раствор представляет собой смесь двух или более веществ, которые в основном находятся в жидком состоянии. С другой стороны, растворитель — это вещество, обладающее растворяющей способностью. Таким образом, он может растворять другое вещество. Ключевое различие между раствором и растворителем заключается в том, что раствор представляет собой смесь двух или более компонентов, тогда как растворитель — это один компонент, который может способствовать получению раствора.
Артикул:
1. «Растворитель». Encyclopædia Britannica , Encyclopædia Britannica, Inc.
Изображение предоставлено:
1. «Раствор перманганата калия в стеклянной колбе», профессиональный фотограф Марко Верч (CC BY 2.0), через Flickr
2. «MOED в различных растворителях» LarsO96 — собственная работа (CC BY-SA 4.0) через Commons Wikimedia
Учебное пособие по растворителям и растворителям
Скоро появятся инструменты Creator, чтобы вдохновить!
Присоединяйтесь к списку рассылки, чтобы узнать, когда мы запустимся.
Химия
Общая химия
Вода
Растворенные вещества и растворители Учебное пособие
Кристалл
5-PS1-1
Однородная смесь двух или более веществ называется раствором, и ее получают путем смешивания растворенного вещества и растворителя.
Оглавление
ВВЕДЕНИЕ
Знаете ли вы, что промывание ран также можно проводить физиологическим раствором? Солевой раствор представляет собой раствор поваренной соли и воды. Но что такое раствор в химии? Давайте разбираться!
Что такое растворенное вещество?
То, что растворяется в растворе, называется растворенным веществом. Количество растворителя в жидком растворе всегда больше количества растворенного вещества. Соль и вода — два растворенных вещества, с которыми мы чаще всего сталкиваемся ежедневно. Поскольку соль растворяется в воде, она служит растворенным веществом. Объект, который растворитель может растворить в растворе, называется растворенным веществом. Решение может принимать несколько форм. Он может существовать в твердом, жидком или газообразном состояниях.
Объект, который растворитель может растворить в растворе, называется растворенным веществом. Решение может принимать несколько форм. Он может существовать в твердом, жидком или газообразном состояниях.
Что такое растворитель?
Самый распространенный компонент в растворе называется растворителем. Это вещество, в котором растворилось растворенное вещество. Обычно растворитель представляет собой жидкость. Самым сильным растворителем, по общей информации в интернете и описаниям в некоторых публикациях, является вода. Поскольку он может растворять практически любой материал более эффективно, чем любая другая жидкость, его также называют «универсальным растворителем». Вода также является отличным растворителем из-за ее полярности.
РАСТВОР
Однородная смесь двух или более веществ называется раствором.
КОМПОНЕНТЫ РАСТВОРА
Раствор образуется путем смешивания растворенного вещества и растворителя. Итак, что такое растворяемое и растворяющее? Растворенное вещество – это вещество, растворенное в растворяющей среде, называемой растворителем.
Например, когда мы делаем раствор соли, соль растворяется в растворяющей среде, которой является вода. Здесь соль является растворенной, так как она растворяется в воде растворяющей среды, которая является растворителем.
То же самое относится к сахарному раствору. Сахар растворяется, а вода растворяется. Еще одна вещь, о которой следует помнить, это то, что растворенное вещество находится в ограниченном количестве, а растворитель в избытке.
Важное различие между растворенным веществом и растворителем
Фундаментальное различие между растворенным веществом и растворителем заключается в том, что одно растворяет, а другое действует как растворяющая среда. Растворенные вещества — это вещества, которые добавляют к растворителям для создания растворов, что является их основным различием. При создании раствора растворитель представляет собой материал, который диспергирует частицы растворенного вещества.
| Параметр | Раствор | Растворитель |
|---|---|---|
| Значение | вещество, растворяющее | Это растворяющая среда |
| Точка кипения | Выше, чем у растворителя | Ниже растворенного вещества |
| Надежность | Растворимость зависит от свойств растворенного вещества | Растворимость зависит от свойств растворителя |
| Физическое состояние | Найден в твердом, жидком или газообразном состоянии | В основном находится в жидком состоянии, но может быть и в газообразном состоянии |
ВОДНЫЕ РАСТВОРЫ
Когда растворителем, используемым для приготовления раствора, является вода, раствор называется водным. Раствор соленой воды представляет собой водный раствор. Растворенная часть, которая является растворенным веществом, может находиться в любом состоянии: твердом, жидком или газообразном. Например, кислотные растворы — это кислоты, растворенные в воде, такие как уксус, морская вода — это раствор многих солей в воде, а сироп от кашля — это раствор многих лекарств, растворенных в воде.
Раствор соленой воды представляет собой водный раствор. Растворенная часть, которая является растворенным веществом, может находиться в любом состоянии: твердом, жидком или газообразном. Например, кислотные растворы — это кислоты, растворенные в воде, такие как уксус, морская вода — это раствор многих солей в воде, а сироп от кашля — это раствор многих лекарств, растворенных в воде.
Но образуется ли раствор только тогда, когда растворитель жидкий? НЕТ!
Типы растворителей
Существуют две категории растворителей в зависимости от полярности: полярные и неполярные. Полярность растворителя определяет, может ли он растворять какое-либо растворенное вещество.
Когда молекулы воды притягиваются к электрически заряженным молекулам растворенного вещества, говорят, что растворенное вещество растворяется, если сила притяжения достаточно сильна, чтобы разбить молекулы растворенного вещества и равномерно распределить их по растворителю. Жиры, масла и смазки являются неполярными растворенными веществами, которые не растворяются в воде. Они объединяются, образуя эмульсию. Такие же большие неполярные молекулы растворенного вещества притягиваются к неполярным растворителям за счет группировки электронов на одной стороне молекулы. Все неполярные растворенные вещества растворяются в неполярных жидкостях с помощью этого процесса.
Они объединяются, образуя эмульсию. Такие же большие неполярные молекулы растворенного вещества притягиваются к неполярным растворителям за счет группировки электронов на одной стороне молекулы. Все неполярные растворенные вещества растворяются в неполярных жидкостях с помощью этого процесса.
Примеры решения
• Когда мы объединяем соль (часто поваренную соль) и воду, мы получаем соленую воду. Растворителем в данном случае является вода, а растворенным веществом – соль. • При смешивании сахара и воды получается сахарная вода. • Жидкость для полоскания рта состоит из нескольких химических веществ, растворенных в воде. • Кристаллы йода растворяют в спирте для получения йодной настойки. • Сахар, углекислый газ, краситель и другие ингредиенты содержатся в газированных напитках.
ВЕРНОЕ РЕШЕНИЕ
Истинный раствор – это гомогенная смесь двух или более веществ, в которой размер частиц растворенного вещества составляет менее 1 нм.
Когда мы подмешиваем соль в воду, что происходит через некоторое время?
Соль начинает оседать на дне стакана?
Нет, этого не происходит, потому что это верное решение. Таким образом, истинным раствором является раствор, в котором растворенное вещество не отделяется, если его выдерживают в течение неопределенного времени. Другими примерами истинных растворов являются раствор сахара и воды, воздух и т. д.
Таким образом, истинным раствором является раствор, в котором растворенное вещество не отделяется, если его выдерживают в течение неопределенного времени. Другими примерами истинных растворов являются раствор сахара и воды, воздух и т. д.
ЗАКЛЮЧЕНИЕ
- Раствор: Однородная смесь двух или более веществ называется раствором.
- Образуется путем смешивания растворенного вещества (меньшее количество) и растворителя (большее количество). Растворенное вещество и растворитель могут находиться в любом состоянии.
Часто задаваемые вопросы:
1. Могут ли песок и вода при смешивании образовывать раствор?
Нет, песок и вода не смешиваются в однородную смесь. Таким образом, они не делают решения.
2. Является ли воздух водным раствором?
Нет, воздух не является водным раствором; что касается водных растворов, растворителем должна быть вода. Но воздух — это смесь газов.
3.
