Это устройство с батарейками защитит ваш автомобиль от коррозии
Мастер показал, как сделать очень простое но в тоже время очень эффективное устройство для борьбы с очагами коррозии на автомобиле. Приспособление настолько простое, что его может сделать даже ребенок. Для его изготовления нам понадобятся обычные соляные батарейки, причем на них должно быть так и написано, что это солевые батарейки. Обычно это самые дешевые батарейки.
Алкалиновые батарейки нам не подойдут, так как у них корпус не из цинка, а у этих корпус сделан из чистого цинка 99,9 процентов.
Товары для изобретателей Ссылка на магазин.
Берем одну батарейку и зачищаем ее корпус от изоляционной пленки. Для этого достаточно пленку просто разрезать. Понадобится кусочек провода. Оборачиваем этот провод вокруг батарейки, но чтобы провод хорошо держался, обернем его обычной канцелярской резинкой.
Электроника для самоделок вкитайском магазине.
На обратный конец закрепляем электрическую прищепку. Затем понадобятся обычные ватные диски. Берем один диск, оборачиваем им батарейку и закрепляем его с помощью резинки. В итоге получилось устройство для защиты авто от коррозии металла.
Затем понадобятся обычные ватные диски. Берем один диск, оборачиваем им батарейку и закрепляем его с помощью резинки. В итоге получилось устройство для защиты авто от коррозии металла.
Далее берем обычную паяльную кислоту ортофосфорную и смачиваем ватку, которую мы закрепили на батарейки. Ну вот и все ребята, устройство готово. Осталось его только подключить к автомобильному аккумулятору.
Подключаем электрическую прищепку прибора к плюсовой клемме аккумулятора и теперь мы можем удалить ржавчину, не просто удалять, а даже оцинковывать металл.
Типичный очаг коррозии на колесной арке автомобиля. Даже не будем очищать эту ржавчину, будем сразу обрабатывать это место устройством. Просто прижимаем смоченную ватку к месту коррозии, сама ржавчина уйдет, а металл, который был ржавый, покроется слоем цинка.
Нужно просто прижать и подержать несколько минут. Цинк из корпуса батарейки перейдет на металл на кузове автомобиля и это место в дальнейшем больше ржаветь не будет.
Видно, как ржавчина уже практически вся ушла. После оцинковки от ржавчины не осталось и следа, появился только небольшой тонкий слой цинка. Это хорошо видно — он имеет серебристый цвет.
Нейтрализуем кислоту
После того, как ржавое место обработано с помощью ручного оцинковщика, нужно нейтрализовать действие кислоты. Для этого нам понадобится обычная пищевая сода. Насыпаем немножко в стаканчик, разбавляем водой и состав для нейтрализации действия кислоты у нас готов. Просто смачиваем ватный диск в этом растворе и обрабатываем место, которое мы оцинковали. Посмотрите, как шипит — это нейтрализуется кислота, которую мы использовали в качестве электролита.
Покраска лаком
Бюджет на закрасить это место можно обычным лаком для ногтей. Подбираете лак под цвет своей машины. Будет самый дешевый карандаш для подкраски сколов на машине.
Такой бюджетный ремонт получился. С расстоянии двух метров это место практически незаметно, а самое главное — больше ржаветь не будет.
Если вам понравился мой метод борьбы с ржавчиной, ставьте лайки.
Обработка металла от ржавчины перед покраской
Повышенная влажность, перепады температур, агрессивные реагенты на дорогах и другие факторы провоцируют появление ржавчины на кузове автомобиля. Современные иномарки подвержены этому недугу в меньшей степени по сравнению с отечественными автомобилями. Но вне зависимости от страны производства, от коррозии не защищены машины, у которых было повреждены и некачественно восстановлены лакокрасочное покрытие и оцинковка. Появление ржавчины не только портит внешний вид. Со временем повреждённый участок расширяется и углубляется, и деталь приходится менять полностью.Статья по теме 5 самых надежных способов защитить кузов автомобиля в дальних поездках
При обычной эксплуатации хорошие условия хранения и своевременная антикоррозийная обработка являются основным условием отсутствия ржавчины на машине. Но если очаг коррозии появился, то его нужно постараться побыстрее локализовать. Естественное окисление и другие химические реакции, происходящие с металлом, удалить практически невозможно. Однако есть способы замедлить процесс и ограничить его распространение.
Но если очаг коррозии появился, то его нужно постараться побыстрее локализовать. Естественное окисление и другие химические реакции, происходящие с металлом, удалить практически невозможно. Однако есть способы замедлить процесс и ограничить его распространение.
Виды ржавчины
Коррозия металлов бывает:
- В зависимости от протекающего процесса: химическая и электрохимическая.
- По типу разрушения: равномерная и неравномерная (местная).
- В зависимости от коррозионной среды: атмосферная, почвенная, газовая, жидкостная (щелочная, кислотная или солевая).
Выбор технологии обработки ржавчины зависит от степени поражения коррозией, которая классифицируется следующим образом:
- Поверхностные пятна малой глубины.
- Мелкие точки глубокого проникновения. На следующих стадиях приводят к появлению сквозных повреждений.
- Сквозное проникновение.
- Подпленочная ржавчина, вызывающая местное вспучивание красочного покрытия. Считается наиболее опасной, так как приводит к разрушению металла.

5-покраска
- Купите баллончик с краской, максимально близкой к цвету вашего авто.
- Для наилучшего подбора, найдите информацию о том оттенке краски, который использовался при заводской краске вашей модели автомобиля, и выбирайте краску по каталогу.
- Перед самой покраской, обработайте загрунтованную поверхность мелкоабразивной (400) наждачной бумагой, смоченной в воде. Это позволит создать ровную гладкую поверхность. Затем промойте грунтовку мыльным раствором и высушите.
- Круску наносите тонким слоем, в несколько подходов.
- Обычно краска сохнет 24-36 часов.
Механический способ
Эффективным и надежным считается механический метод антикоррозионной очистки с применением ручного инструмента или специального оборудования. Используют проволочные щетки, зачистные и шлифовальные круги, гидропескоструйное устройство, установку пескоструйной обработки.
Строение пескоструйного аппарата
Незначительные участки поражения зачищают перед покраской проволочными щетками. Щетки также пригодны для предварительной очистки толстых слоев ржавчины и сварных швов.
Щетки также пригодны для предварительной очистки толстых слоев ржавчины и сварных швов.
Работа сопровождается образованием большого количества пыли, что является существенным недостатком.
Использование шлифовальных и зачистных кругов дает лучший результат по качеству очищенной поверхности. Круги эффективны при обработке небольших и средних по размеру участков.
Абразивный инструмент для удаления следов коррозии и очистки поверхности под окрашивание от следов краски выбирают с соблюдением нескольких условий:
- твердость обрабатываемого материала должна быть значительно ниже твердости круга;
- зернистость подойдет средняя;
- диаметр круга подбирают в соответствии с площадью обработки.
Как оцинковать кузов подручными средствами
Бытует мнение, что цинковый слой, оставленный преобразователями ржавчины, более уязвим, нежели аналог, полученный в результате электрохимической реакции. Факты – тому подтверждение: неокрашенные участки после «Цинкаря» покрываются ржавчиной спустя неделю, тогда как надежно оформленный электрохимический слой не подает дефектных признаков после полугода года ежедневной зимней эксплуатации.
Для оцинковки потребуется следующий инструмент:
- Дешевая солевая батарейка размером побольше. Ее содержимое упаковано в цинковый корпус, который нам и понадобится. Чтобы удостовериться, что в руках нужная батарейка – поднесите к ней магнит. Соляные источники питания не магнитятся.
- Паяльная кислота. Используется в качестве электролита и как дополнительный источник цинка.
- Лампа Р21/5W. Используется в качестве сопротивления на «плюсовой» ветке.
- Ветошь, провода и сопутствующая электрооснастка, заимствованная у предшествующей операции травления.
- Пищевая сода. Потребуется на финише.
От батарейки нужен только корпус, который будет служить электродом. Поэтому, извлекаем любыми доступными способами содержимое батарейки и вырезаем пластинку оптимальных габаритов. Собираем схему: «минус» — на кузов, «плюс»: АКБ-лампа-электрод. Наматываем на электрод ветошь, макаем в паяльную кислоту и быстрыми круговыми движениями обрабатываем металл.
Важно учесть, что реакция идет с выделением большого количества теплоты. Поэтому, поглядываем на тряпочку – она может подгореть. По аналогии с травлением необходимо помнить, что короткое замыкание цинкового электрода на кузов ни к чему. Наличие лампы – обязательно. Она ограничивает ток, читай, способствует нанесению равномерного слоя цинка. Электрод необходимо периодически менять.
После всех манипуляций соляную кислоту, оставленную на кузове батарейкой, необходимо вытравить. Для этого используется раствор воды и пищевой соды. Разводим столовую ложку в стакане воды и наносим кистью на оцинкованный участок. Как только перестанет шипеть – обработка закончена. Смываем водой и приступаем к контролю.
Так, спустя сутки намеков на ржавчину быть не должно. Если таковые есть, то травление ржавчины и нанесение цинка повторяется.
Не стоит оставлять цинк в открытом состоянии более, чем на 48 часов. Покрытие непассивировано, а потому слой цинка от контакта с влагой постоянно уменьшается. Матировать оцинкованный металл воспрещено – сразу же наносится кислотный грунт и далее по сценарию…
Матировать оцинкованный металл воспрещено – сразу же наносится кислотный грунт и далее по сценарию…
Особенности процесса
К недостаткам применения кругов относится большой расход абразивного инструмента и необходимость навыка подобной работы.
Пескоструйная и гидроабразивная чистка незаменима при работе в труднодоступных местах, куда нельзя достать щеткой или кругом. Технология позволяет избавиться не только от ржавчины, но и от нагара, окалины, старой краски.
Процесс пескоструйной обработки подразумевает воздействие на металл песчаными струями, подаваемыми под давлением. В установку входит компрессор, емкость с песком и пистолет для подачи абразива.
При гидроабразивной или гидропескоструйной обработке подается смесь абразивного материала с водой. Подача происходит с высоким, низким или сверхвысоким уровнем давления. Низкая интенсивность дает экономию материала, но после высыхания поверхности проступают признаки вторичной коррозии.
Высокое давление подачи почти полностью удаляет все наслоения.
На отдельных участках иногда появляются следы черных окислов и прочного покрытия. Сверхвысокое давление подачи абразива позволяет получить абсолютно чистую поверхность.
Оба метода применимы только в производственных условиях.
Профилактика
Периодически проводите полный профилактический осмотр автомобиля для выявления коррозийных повреждений. Это можно делать в специализированном сервисном центре или своими силами.
Осматриваемая поверхность должна быть чистой, иначе под слоем грязи невозможно будет заметить небольшое коричневое пятно — очаг распространения ржавчины. Осмотр нужно проводить не только сверху, но и снизу, загнав машину на подъёмники или поставив на «яму». Можно периодически заглядывать под обивку салона. Особенно, если в автомобиле было сыро. Особое внимание нужно уделять местам соединения деталей — сварочным швам и стыкам металла с уплотнителями.
Если автомобиль лишился какой-нибудь декоративной детали (молдинг, шильдик, предмет обвеса), то перед тем, как вернуть машине прежний вид, обработайте крепёжное отверстие каким-нибудь консервирующим составом. Этим же препаратом нужно обработать место нарушения лакокрасочного покрытия, появившееся после незначительного ДТП.
Этим же препаратом нужно обработать место нарушения лакокрасочного покрытия, появившееся после незначительного ДТП.
Химическая очистка
Химическое удаление следов ржавчины осуществляется путем нанесения химических преобразователей. Очистка металла от коррозии – трудоемкий процесс. Химпром выпускает средства химической очистки трех видов:
- жидкость;
- гель;
- аэрозоль.
Действует любой из преобразователей ржавчины по такому принципу. Основным действующим веществом средства является ортофосфорная кислота. После нанесения кислота вступает в активное взаимодействие с поверхностью непроницаемой пленки микроскопической толщины. Таким образом, блокируется доступ окислителя к поверхности, химическая реакция прекращается и не происходит дальнейшее разрушение металла.
Проведение работ требует строгого выполнения правил безопасности и рекомендаций производителя по применению средства.
Категории химических веществ
Смываемые – после обработки ними металл следует помыть, хорошо просушить и нанести антикоррозионный состав.
В противном случае появляются новые признаки коррозии после взаимодействия с водой.
Несмываемые или грунт-преобразователи – обработка средством такого типа не требует последующей промывки, что исключает повторное появление ржавчины.
Поможет в борьбе со ржавчиной обработка металла кислотным нейтрализатором ВСН-1. Удаляет следы коррозии и оставляет на поверхности защитную пленку спрей с содержанием цинка Цинкор-Авто. Раскислитель ржавчины Berner справляется даже с заржавленными деталями. Преимуществом антикоррозионного кислотного геля В-52 является отсутствие растекания и активное воздействие на ржавчину.
При самостоятельном приготовлении преобразователя ржавчины смешивают равные части щавелевой или лимонной кислоты с водой. В раствор добавляют чайную ложку соды из расчета на 1 л воды. Мягкую ветошь увлажняют в растворе и тщательно протирают пораженные участки на металлической поверхности.
Хороший результат получается после обработки ортофосфорной кислотой. Наносят на металл 20–30% раствор кислоты. В результате химической реакции на поверхности формируется ортофосфат железа в виде прочного защитного слоя. Усиливает эффект добавление в раствор винной кислоты (15 мл на 1 литр) или бутилового спирта (5 мл на 1 литр).
Наносят на металл 20–30% раствор кислоты. В результате химической реакции на поверхности формируется ортофосфат железа в виде прочного защитного слоя. Усиливает эффект добавление в раствор винной кислоты (15 мл на 1 литр) или бутилового спирта (5 мл на 1 литр).
Слишком ржавый металл обрабатывается составом из вазелинового масла и молочной кислоты (100 мл/50 мл). После нанесения состав стирают ветошью с вазелиновым маслом.
Вазелиновое масло поможет бороться с ржавчиной
Технология обработки
В первую очередь место с очагом коррозии тщательно очищается от грязи, краски и грунтовки до металла. Обычно это делается с помощью абразивной бумаги с крупным зерном. Зачищенное место обрабатывается «преобразователем ржавчины». После его полного высыхания поверхность кузова готовится к покраске — чистится, грунтуется и шпатлюется. Для улучшения результата можно использовать антикоррозийную грунтовку. Финальная часть — покраска и полировка кузова.
Если повреждён совсем небольшой участок или нет возможности проведения вышеописанных работ, то можно использовать антикоррозийный лак. Его состав содержит ингибиторы коррозии, которые проникают в повреждённый участок и нейтрализуют ржавчину. Это прозрачное покрытие не требует глубокой очистки, а наносится на промытую и тщательно высушенную поверхность.
Его состав содержит ингибиторы коррозии, которые проникают в повреждённый участок и нейтрализуют ржавчину. Это прозрачное покрытие не требует глубокой очистки, а наносится на промытую и тщательно высушенную поверхность.
Важно провести обработку правильно, соблюдая технологию и просушивая все слои. Иначе все усилия просто пропадут, а в худшем случае спровоцируют развитие коррозии.
Статья по теме
Как самостоятельно устранить мелкие царапины на автомобиле
Термический способ
Очистка металла от признаков коррозии часто выполняется термическим способом. Для нагрева используется кислородно-ацетиленовая горелка. Горелкой обрабатывается вся ржавая поверхность. После выполнения процедуры застаревшая краска, ржавчина и прокатная окалина выгорает и легко удаляется.
С целью предупреждения повторного образования ржавчины, металлические изделия рекомендуется обрабатывать антикоррозионными составами.
4-подготовка к покраске
- После того, как преобразователь ржавчины полностью высохнет, поверхность металла и краски вокруг него нужно мягко отполировать мелкозернистой (120) наждачной бумагой.

- Затем наступает этап грунтовки поверхности. Перед нанесением грунтовки, нужно обезжирить поверхность растворителем или WD-40. Грунтовка наносится согласно инструкции, обычно хватает 3-х слоев. Между нанесением каждого стоит выждать несколько минут.
- Краску наносят только после полного высыхания грунтовки. Обычно ждать приходится 10-12 часов.
Самостоятельно или на сервисе?
Владелец нового автомобиля скорее всего обратится на сервис — пусть это и дорого. Выходец из «гаражного сообщества» былых времен предпочтет самостоятельную возню: его не испугают ни зачистка, ни грунтовка. А вот среднему потребителю, у которого не ни лишних денег, ни «гаражных» навыков, стоит посмотреть на препараты современной автохимии. Примером могут служить так называемые мовили — когда-то имя «Мовиль» образовалось от имен двух столиц, Москва и Вильнюс. Но сегодня термин стал нарицательным: мовилей в продаже довольно много.
Несколько советов:
- запаситесь фонариком и при каждой мойке внимательно осматривайте участки под крыльями, бамперами, колесными арками;
- уделите внимание щелям между кузовом и навесными элементами;
- не упустите из виду места вокруг фар, боковых зеркал, окон, антенны, люка на крыше;
- проверяйте окна по периметру: там скапливается влага;
- проверьте состояние металлических поверхностей внутри авто (это особенно важно, если вы проживаете во влажном климате).

Удалять ржавчину народными способами, например, рыбьим жиром или керосином, – рискованное занятие
Проверить состояние днища можно только при помощи подъемника. Настаивайте на этой манипуляции во время очередного ТО в хорошем автосервисе. Заодно специалисты протестируют и состояние картера двигателя, тормозных шлангов, ручного тормоза.
Если с коррозией не бороться, она может вступить в реакцию с агрессивным влажным воздухом, с солью и антигололедными реагентами, а там и рукой подать до повреждений днища, рулевого управления, трансмиссии. Не затягивайте с антикоррозийной обработкой и будьте начеку – коварный враг металла не дремлет!
Гальваническая батарея – Проект Джозефа Генри
Описание Джозефом Генри своей батареи
Appelton-Cyclopedia.pdf
» Первая батарея – Резюме доклада Вольты 1800 г. в Королевском обществе (JSTOR)
Выдержки, относящиеся к гальванике Генри Аккумулятор
Заметки Генри К. Кэмерона. Лекция 11 февраля.
Лекция 11 февраля.
«Простейшая форма гальванической батареи состоит из стакана с кислотой, в который погружены два металла, к которым кислота имеет притяжение. Кислота, слегка растворяя один (или, скорее, оксид одного, чистый металл не подвергается воздействию), получает от него часть, оставляя его отрицательным, и передает его другому, делая его положительным. Направление тока от металла, на который действует кислота, к другому металлу, а оттуда обратно к первому металлу, когда есть соединение, тонкая платиновая проволока, помещенная в соединение, при прохождении тока становится красной. . Единственным известным гальванометром была лягушка. У сэра Х. Дэви была комната, в которой он держал своих лягушек и убивал их по мере использования. Комната по-прежнему показана. Если ток гальванического электричества направить над магнитной стрелкой, он заставляет ее поворачиваться под прямым углом, и этот факт дает гальванометр. Проволока часто обвивается вокруг свободно поддерживаемой иглы, и с помощью этого инструмента мы обнаруживаем малейшее количество гальванизма.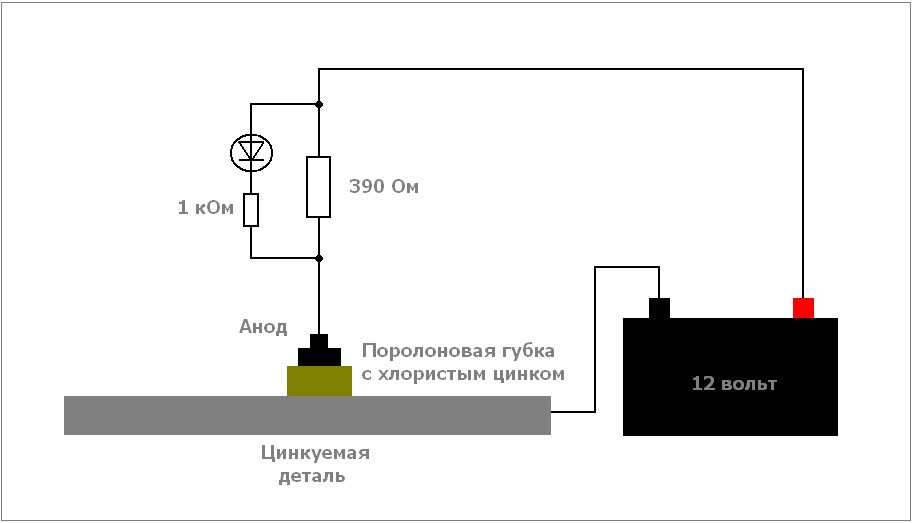
 д. К обоим концам присоединены провода, которые, соединяясь вместе, замыкают цепь. В этом случае первая положительная пластина получает определенное количество электричества от отрицательной пластины через кислоту, которое передается следующей пластине (отрицательной). Вторая положительная пластина получает от второй отрицательной пластины не только количество, полученное от раствора кислоты, но и количество, полученное от первой пластины, и так до ста пластин, которые будут иметь 100 А. Увеличивая таким образом количество и поверхность пластин, мы получаем мощную батарею. Вольта в 1798 обнаружил сваю (только модификацией которой является батарея. Она состоит из пластин цинка, лежащих на пластинах меди, с фланелью, пропитанной кислотой между каждой парой. дно. Затем действие относилось к простому контакту. Круикшенкс превратил его в гальванический желоб, который представляет собой только груду на боку. Пластины цинка и меди спаяны вместе, а кислота находится между парами. Принцип этого был Объяснение выше.
д. К обоим концам присоединены провода, которые, соединяясь вместе, замыкают цепь. В этом случае первая положительная пластина получает определенное количество электричества от отрицательной пластины через кислоту, которое передается следующей пластине (отрицательной). Вторая положительная пластина получает от второй отрицательной пластины не только количество, полученное от раствора кислоты, но и количество, полученное от первой пластины, и так до ста пластин, которые будут иметь 100 А. Увеличивая таким образом количество и поверхность пластин, мы получаем мощную батарею. Вольта в 1798 обнаружил сваю (только модификацией которой является батарея. Она состоит из пластин цинка, лежащих на пластинах меди, с фланелью, пропитанной кислотой между каждой парой. дно. Затем действие относилось к простому контакту. Круикшенкс превратил его в гальванический желоб, который представляет собой только груду на боку. Пластины цинка и меди спаяны вместе, а кислота находится между парами. Принцип этого был Объяснение выше.
Доктор Хэйр из Филадельфии уделял большое внимание усовершенствованию и совершенствованию аппаратуры и сделал много ценных изобретений и т. д., особенно в отношении гальванических батарей. Для одного из них пластины были так закреплены, что их можно было снимать без ограничений. Он назвал это дефлагратором, и причина его изобретения заключалась в том, что хотя батарея сначала действовала мощно, но постепенно она становилась все слабее и, наконец, почти перестала действовать. Причина этого была неизвестна до недавнего времени. Причиной износа сваи или батареи являются (1) образование сульфата цинка, который, диффундируя в раствор, оседает (в виде металлического цинка) на медь; таким образом создается противоток электричества, который в некоторой степени нейтрализует старый: (2) Местное действие. Промышленный цинк очень нечистый, содержит железо и т. д., поэтому [???] электричества, вырабатываемого цинком, нейтрализуется таким образом.
Гальваническое действие объясняется с помощью химической теории, автором которой является Воллартон (sp?). Дэви Беккилер, Фарадей и Генри значительно улучшили его. Предполагается, что атомы разных тел существуют в разных электрических состояниях, т.е. кислород естественно отрицательный, а водород положительный. Соединяясь вместе, они притягиваются, объединяются и образуют каплю воды. Кислота никогда не действует на чистый металл; его необходимо предварительно окислить; этот оксид растворяется кислотой; это постоянно представляет новую поверхность для действия и т.д. Оксид образуется при соединении кислорода в воде с цинком, водород как бы незаметно выходит на медь. Цинк, являющийся положительным, заставляет кислород или отрицательный конец атома воды по индукции занимать приблизительное положение, и, следовательно, мы имеем ряд атомов, расположенных, как на первом рисунке напротив.
За последние несколько лет в батарею было внесено много усовершенствований. (1) Между пластинами вводится пористая мембрана, через которую действует кислота, но которая препятствует переходу сульфата цинка в медь. (2) Используя различные жидкости на разных сторонах мембраны. Выделившийся водород, являясь непроводником, проникает в медную пластину, тем самым препятствуя ее действию. На поверхность медной пластины наливаем азотную кислоту, часть кислорода которой соединяется с образующимся водородом, образуя воду, и сама восстанавливается до азотистой кислоты. Таким образом предотвращается образование пленки, и получается новый ток, который добавляется к предыдущему току от пластины к пластине. (3) Мы предотвращаем влияние местного действия, используя чистый или амальгамированный цинк. Покрытый ртутью, он противостоит действию кислоты, но все же производит электрический ток. Мы также можем использовать пластину из платинированной меди между 2 пластинами из цинка. Постоянная батарея Даниэля состоит из куска чистого или амальгамированного цинка в бумажном конверте, содержащем сульфат меди (или серную кислоту, ПРИМЕЧАНИЕ: похоже, что серная кислота была написана поверх сульфата меди), все это находится в цилиндрическом сосуде, состоящем из меди.
(2) Используя различные жидкости на разных сторонах мембраны. Выделившийся водород, являясь непроводником, проникает в медную пластину, тем самым препятствуя ее действию. На поверхность медной пластины наливаем азотную кислоту, часть кислорода которой соединяется с образующимся водородом, образуя воду, и сама восстанавливается до азотистой кислоты. Таким образом предотвращается образование пленки, и получается новый ток, который добавляется к предыдущему току от пластины к пластине. (3) Мы предотвращаем влияние местного действия, используя чистый или амальгамированный цинк. Покрытый ртутью, он противостоит действию кислоты, но все же производит электрический ток. Мы также можем использовать пластину из платинированной меди между 2 пластинами из цинка. Постоянная батарея Даниэля состоит из куска чистого или амальгамированного цинка в бумажном конверте, содержащем сульфат меди (или серную кислоту, ПРИМЕЧАНИЕ: похоже, что серная кислота была написана поверх сульфата меди), все это находится в цилиндрическом сосуде, состоящем из меди.
Батарея Грейва, которая на сегодняшний день является самой мощной из всех используемых, состоит из серной кислоты с одной стороны и азотной кислоты с другой. Цинковая пластина помещается в первую, а медная пластина (которую в более мощных заменяет платина) вставляется во вторую и т. д. Азотная кислота воздействовала бы на медь, и таким образом индуцировался бы противоток, который существенно мешал бы действию. Поэтому мы используем платину. Теория Ома в отношении рабочей мощности батареи дала желаемое, которого научный мир искал в течение долгого времени. Это то, что эффективная или рабочая мощность батареи прямо пропорциональна электродвижущей силе и обратно пропорциональна сопротивлению или A = n*E/(n*R+r), где E = электродвижущая сила, R = сопротивление кислоты, r = сопротивление провода и n = количество пластин.
Лекция 13 февраля.
” Эксперименты в гальванизме и т. д.
Постоянная батарея Даниэля была показана в действии сегодня утром. Он состоял из 22 цилиндрических медных кувшинов, расположенных таким образом, что образовывал то, что французы называют couronne des tasses1 (по-французски «венец из очков»), каждый из которых содержал пластину из амальгамированного цинка, разделенную, однако, перегородкой из бумаги, сульфата меди. помещают в каждую ячейку, чтобы поглощать водород, как только он образуется. Количество гальванизма зависит от размера пластин, интенсивность от их количества. Эта батарея давала искры и влияла на электрометр, тем самым показывая идентичность гальванической и электрической жидкости. Двенадцать чашек батареи Гроувса по действию равны большим батареям в Философском зале, состоящим из 300 пластин по плану д-ра Хора для внезапного [??].
Он состоял из 22 цилиндрических медных кувшинов, расположенных таким образом, что образовывал то, что французы называют couronne des tasses1 (по-французски «венец из очков»), каждый из которых содержал пластину из амальгамированного цинка, разделенную, однако, перегородкой из бумаги, сульфата меди. помещают в каждую ячейку, чтобы поглощать водород, как только он образуется. Количество гальванизма зависит от размера пластин, интенсивность от их количества. Эта батарея давала искры и влияла на электрометр, тем самым показывая идентичность гальванической и электрической жидкости. Двенадцать чашек батареи Гроувса по действию равны большим батареям в Философском зале, состоящим из 300 пластин по плану д-ра Хора для внезапного [??].
Энергия находится в нестабильном состоянии. Некоторые считают, что мозг представляет собой гальваническую батарею, и что, когда мы проявляем нашу волю в отношении движения какой-либо части нашего тела, поток электричества проходит вдоль нерва, заставляя мышцу сокращаться и т. д. Но это не исследовано. Исследования Matteuci (sp?), выдающегося итальянца, склонялись к тому, чтобы показать, что сокращения мышц происходят из-за электрического тока, существующего в самой мышце, а не проводящегося туда нервом из мозга. . .
д. Но это не исследовано. Исследования Matteuci (sp?), выдающегося итальянца, склонялись к тому, чтобы показать, что сокращения мышц происходят из-за электрического тока, существующего в самой мышце, а не проводящегося туда нервом из мозга. . .
Если мы погрузим провод батареи в воду, он разложится на свои элементы водород и кислород, первый станет отрицательным, а второй положительным. Если мы поместим перевернутый стеклянный сосуд над каждым полюсом, чтобы получать образующиеся газы, мы обнаружим, что на одну часть кислорода приходится две части водорода. После этого газы могут быть сожжены и т. д. Никакого действия не происходит между полюсами (по крайней мере, микроскопическое наблюдение ничего не обнаруживает), но происходит над каждым полюсом. Если гальваническую жидкость пропустить через смесь водорода и кислорода, она произведет взрыв, заставив их объединиться и снова превратиться в воду».
- Google Книги: Элементы электричества и электрохимии
Теория гальванической батареи Генри
Батарея Джозефа Генри была одним из самых ранних и простых типов батарей. Он состоял из медного и цинкового электродов, погруженных в раствор разбавленной серной кислоты и соединенных внешним проводником.
Он состоял из медного и цинкового электродов, погруженных в раствор разбавленной серной кислоты и соединенных внешним проводником.
Чтобы понять работу батареи Генри на языке современной химии, проще всего начать с понимания работы аналогичной батареи, элемента Даниэля. Идеальная ячейка Даниэля состоит из медного электрода, погруженного в 1М раствор сульфата меди, и цинкового электрода, погруженного в 1М раствор сульфата цинка. Два раствора соединены солевым мостиком или пористой мембраной, которая пропускает положительные ионы, но предотвращает смешивание растворов.
Электрохимические элементы, такие как элемент Даниэля, работают благодаря протеканию определенного типа химической реакции, реакции окисления/восстановления или «окислительно-восстановительной». Окислительно-восстановительная реакция происходит, когда один металл отдает электроны, что известно как окисление, а другой металл одновременно получает эти электроны, что является восстановлением. Место, где происходит восстановление, называется катодом, а место, где происходит окисление, — анодом. Чтобы записать эти реакции, используя химическую терминологию, окисление некоторого данного металла M записывается как:
Чтобы записать эти реакции, используя химическую терминологию, окисление некоторого данного металла M записывается как:
M → M n+ + ne –
Точно так же восстановление данного металла записывается как:
M n+ + ne – →M 900 03
В этом случае n — число электронов, связанных с реакцией. Например, в окислении цинка участвуют два электрона, так что реакция будет записана как:
Zn → Zn 2+ + 2e –
С другой стороны, в восстановлении водорода участвует только один электрон, поэтому такая реакция будет:
H + + e – →H
Очень важно отметить, что невозможно окисление без восстановления, и наоборот. Всякий раз, когда что-то окисляется, что-то еще должно быть восстановлено. Каждая из этих реакций называется полуреакцией, а полная электрохимическая реакция представляет собой простую сумму двух полуреакций. В ячейке Даниэля соответствующими реакциями являются восстановление меди и окисление цинка. Реакция восстановления меди:
В ячейке Даниэля соответствующими реакциями являются восстановление меди и окисление цинка. Реакция восстановления меди:
Cu 2+ + 2e – →Cu
Комбинируя это с приведенной выше реакцией окисления цинка, общая реакция для ячейки Даниэля:
Cu 2+ + Zn →Cu + Zn 9004 5 2+
Для того, чтобы понять, как эта реакция образует батарею, необходима еще одна очень важная идея — концепция электродного потенциала. Электродный потенциал представляет собой электрический потенциал (измеряемый в вольтах), связанный с каждой окислительно-восстановительной реакцией. Этот потенциал возникает из-за того, что не все металлы имеют одинаковую электроотрицательность, которая является мерой того, насколько легко элемент может быть ионизирован. Электроотрицательность обычно измеряется по безразмерной шкале от 0,7 до 3,3, которая откалибрована по тому, насколько легко различные элементы образуют и разрывают связи. Электроотрицательность также можно рассматривать как меру того, насколько сильно металл хочет удерживать свои электроны. Если соединить два металла с разной электроотрицательностью, металл с более низкой электроотрицательностью будет стремиться отдать свои электроны другому металлу. Именно эта тенденция вызывает разность потенциалов и, следовательно, поток электронов.
Электроотрицательность также можно рассматривать как меру того, насколько сильно металл хочет удерживать свои электроны. Если соединить два металла с разной электроотрицательностью, металл с более низкой электроотрицательностью будет стремиться отдать свои электроны другому металлу. Именно эта тенденция вызывает разность потенциалов и, следовательно, поток электронов.
Различные электроотрицательности
[ПРОДОЛЖЕНИЕ СЛЕДУЕТ]
Теория гальванической батареи Генри
Батарея Джозефа Генри была одним из самых ранних и простых типов батарей. Он состоял из медного и цинкового электродов, погруженных в раствор разбавленной серной кислоты и соединенных внешним проводником.
Чтобы понять работу батареи Генри на языке современной химии, проще всего начать с понимания работы аналогичной батареи, элемента Даниэля. Идеальная ячейка Даниэля состоит из медного электрода, погруженного в 1М раствор сульфата меди, и цинкового электрода, погруженного в 1М раствор сульфата цинка. Два раствора соединены солевым мостиком или пористой мембраной, которая пропускает положительные ионы, но предотвращает смешивание растворов.
Два раствора соединены солевым мостиком или пористой мембраной, которая пропускает положительные ионы, но предотвращает смешивание растворов.
Электрохимические элементы, такие как элемент Даниэля, работают благодаря протеканию определенного типа химической реакции, реакции окисления/восстановления или «окислительно-восстановительной». Окислительно-восстановительная реакция происходит, когда один металл отдает электроны, что известно как окисление, а другой металл одновременно получает эти электроны, что является восстановлением. Место, где происходит восстановление, называется катодом, а место, где происходит окисление, — анодом. Чтобы записать эти реакции, используя химическую терминологию, окисление некоторого данного металла M записывается как:
M → M n+ + ne –
Точно так же восстановление данного металла записывается как:
M n+ + ne – →M 900 03
В этом случае n — число электронов, связанных с реакцией. Например, в окислении цинка участвуют два электрона, так что реакция будет записана как:
Например, в окислении цинка участвуют два электрона, так что реакция будет записана как:
Zn → Zn 2+ + 2e –
С другой стороны, в восстановлении водорода участвует только один электрон, поэтому такая реакция будет:
H + + e – →H
Очень важно отметить, что невозможно окисление без восстановления, и наоборот. Всякий раз, когда что-то окисляется, что-то еще должно быть восстановлено. Каждая из этих реакций называется полуреакцией, а полная электрохимическая реакция представляет собой простую сумму двух полуреакций. В ячейке Даниэля соответствующими реакциями являются восстановление меди и окисление цинка. Реакция восстановления меди:
Cu 2+ + 2e – →Cu
Комбинируя это с приведенной выше реакцией окисления цинка, общая реакция для ячейки Даниэля:
Cu 2+ + Zn →Cu + Zn 9004 5 2+
Для того чтобы понять, как эта реакция образует батарею, необходима еще одна важная идея — концепция электродного потенциала. Электродный потенциал представляет собой электрический потенциал (измеряемый в вольтах), связанный с каждой окислительно-восстановительной реакцией. Этот потенциал возникает из-за того, что не все металлы имеют одинаковую электроотрицательность, которая является мерой того, насколько легко элемент может быть ионизирован. Электроотрицательность обычно измеряется по безразмерной шкале от 0,7 до 3,3, и более подробное объяснение можно найти в конце этого раздела. Электроотрицательность также можно рассматривать как меру того, насколько сильно металл хочет удерживать свои электроны. Если соединить два металла с разной электроотрицательностью, металл с более низкой электроотрицательностью будет стремиться отдать свои электроны другому металлу. Именно эта тенденция вызывает разность потенциалов и, следовательно, поток электронов. В этом случае напряжение, связанное с восстановлением меди, составляет 0,340 вольт, а напряжение, связанное с окислением цинка, составляет -0,763 вольта. Общая разница напряжений между двумя ячейками представляет собой простую разницу между этими двумя напряжениями: 0,340 – 9 В.
Электродный потенциал представляет собой электрический потенциал (измеряемый в вольтах), связанный с каждой окислительно-восстановительной реакцией. Этот потенциал возникает из-за того, что не все металлы имеют одинаковую электроотрицательность, которая является мерой того, насколько легко элемент может быть ионизирован. Электроотрицательность обычно измеряется по безразмерной шкале от 0,7 до 3,3, и более подробное объяснение можно найти в конце этого раздела. Электроотрицательность также можно рассматривать как меру того, насколько сильно металл хочет удерживать свои электроны. Если соединить два металла с разной электроотрицательностью, металл с более низкой электроотрицательностью будет стремиться отдать свои электроны другому металлу. Именно эта тенденция вызывает разность потенциалов и, следовательно, поток электронов. В этом случае напряжение, связанное с восстановлением меди, составляет 0,340 вольт, а напряжение, связанное с окислением цинка, составляет -0,763 вольта. Общая разница напряжений между двумя ячейками представляет собой простую разницу между этими двумя напряжениями: 0,340 – 9 В. 0045 – .763 = 1,103 В
0045 – .763 = 1,103 В
Трудно определить напряжение, связанное с данной окислительно-восстановительной реакцией, поскольку полуреакции не могут протекать независимо, и можно непосредственно измерить только разницу в напряжениях. Чтобы решить эту проблему, восстановление/окисление водорода было определено как имеющее электродный потенциал 0 В, а все потенциалы полуэлемента представляют собой разницу между окислением/восстановлением рассматриваемого элемента и окислением/восстановлением водорода – положительные значения. означают, что элемент вызывает окисление водорода, а отрицательные значения означают, что он вызывает восстановление водорода. Все эти напряжения определяются экспериментально, и доступно множество таблиц для различных элементов.
Кроме того, потенциалы определены для электрода из чистого металла, погруженного в 1М раствор его ионов при 25°С, что важно, поскольку и температура, и концентрация ионов влияют на создаваемое напряжение. Этот эффект описывается уравнением Нернста, которое дает изменение напряжения от стандартного потенциала, вызванное изменениями концентрации и температуры.
Этот эффект описывается уравнением Нернста, которое дает изменение напряжения от стандартного потенциала, вызванное изменениями концентрации и температуры.
Поскольку медь имеет более высокую электроотрицательность (1,90), чем цинк (1,65), электроны имеют тенденцию покидать атомы цинка и перемещаться к меди, создавая ток через соединительный провод. Cu 9Ионы 0045 2+ подхватывают эти электроны и превращаются в атомы Cu, которые осаждаются на медном электроде. Атомы Zn на цинковом электроде превращаются в ионы Zn 2+ , которые переходят в раствор, что в конечном итоге приводит к полной коррозии цинкового электрода. Для предотвращения дисбаланса заряда одновременно положительные ионы H + будут перетекать через пористую мембрану из сульфата цинка в сульфат меди, а SO 4 – – в обратном направлении. Поток электронов через провод, соединяющий цинковый и медный электроды, представляет собой ток, обеспечивающий эффективность батареи.
Батарейки, которые использовал Джозеф, немного, но существенно отличались от описанной выше. Они по-прежнему использовали цинковые и медные электроды, но электроды не были разделены в двух контейнерах и не были погружены в растворы их ионов, а просто были помещены вместе в раствор разбавленной серной кислоты (насколько разбавленным в настоящее время является вопросом некоторой неопределенности). Это означает, что реакция коренным образом отличается от реакции в ячейке Даниэля, потому что медь больше не является восстановителем, поскольку в растворе, подлежащем восстановлению, нет свободных ионов меди. Вместо этого восстановителем становится водород, поэтому реакция становится
2H + + Zn →H 2 + Zn 2+
Когда медь и цинк соединяются вместе за счет внешней проводимости, на поверхности меди заметно образуются пузырьки водорода, указывающие на то, что это реакция происходит.
Это снижает теоретическое напряжение батареи — поскольку водород определяется как 0 В, теоретическое напряжение становится всего 0,763 вольта. Однако для концентрации кислоты 0,8 М это становится примерно 0,87 вольт, что было измерено экспериментально.
Однако для концентрации кислоты 0,8 М это становится примерно 0,87 вольт, что было измерено экспериментально.
Внутреннее сопротивление аккумуляторов Генри трудно точно определить. Реплики его аккумуляторов имели измеренное сопротивление 3-5 Ом, что довольно много (большинство современных аккумуляторов имеют внутреннее сопротивление менее 0,1 Ом). Однако неясно, какой молярности была его кислота, и чем выше концентрация кислоты, тем ниже внутреннее сопротивление до определенного предела. Большая площадь поверхности также снижает внутреннее сопротивление. Однако его эксперименты с магнитом Олбани и другими, кажется, предполагают, что его батареи имели довольно низкое внутреннее сопротивление. Одно из возможных объяснений состоит в том, что его кислоты были не более концентрированными, а на самом деле гораздо более разбавленными, чем 0,8М, при которой были сделаны некоторые предварительные измерения. При погружении в кислоту 0,8 М цинк подвергается коррозии, выделяя газообразный водород, который пузырится на поверхности в результате реакции, отличной от той, которая создает батарею. Эта реакция продолжается независимо от того, присоединен ли цинк к медному электроду или нет, и протекает более или менее бурно в зависимости от концентрации кислоты. Большое количество пузырьков, образующихся на цинковом электроде, эффективно удаляет почти всю площадь поверхности, что может привести к резкому увеличению внутреннего сопротивления. Если бы концентрация кислоты была достаточно низкой, чтобы не возникала эта коррозия, тогда была бы открыта гораздо большая площадь поверхности цинка, и тогда внутреннее сопротивление уменьшилось бы пропорционально. Необходимы дальнейшие исследования в этой области.
Эта реакция продолжается независимо от того, присоединен ли цинк к медному электроду или нет, и протекает более или менее бурно в зависимости от концентрации кислоты. Большое количество пузырьков, образующихся на цинковом электроде, эффективно удаляет почти всю площадь поверхности, что может привести к резкому увеличению внутреннего сопротивления. Если бы концентрация кислоты была достаточно низкой, чтобы не возникала эта коррозия, тогда была бы открыта гораздо большая площадь поверхности цинка, и тогда внутреннее сопротивление уменьшилось бы пропорционально. Необходимы дальнейшие исследования в этой области.
battery_background.pdf
Новый материал может превратить кузов вашего автомобиля в гигантскую батарею
Присоединяйтесь к топ-менеджерам в Сан-Франциско 11-12 июля и узнайте, как бизнес-лидеры опережают революцию генеративного ИИ . Узнать больше
Новое изобретение Имперского колледжа Лондона может навсегда изменить наши представления об аккумуляторах и, если на то пошло, о двигателях автомобилей. Исследователи запатентовали смесь углеродного волокна и полимера, которая может накапливать и разряжать электричество, а это означает, что в конечном итоге корпус вашего автомобиля также может работать от двигателя.
Исследователи запатентовали смесь углеродного волокна и полимера, которая может накапливать и разряжать электричество, а это означает, что в конечном итоге корпус вашего автомобиля также может работать от двигателя.
Эта технология может изменить правила игры по трем причинам. Во-первых, этот материал может заменить литий-ионные батареи в качестве источника энергии для подключаемых к сети автомобилей, бытовой электроники, электрических сетей и многого другого. Поскольку запасы лития сокращаются и становятся дорогими, это может стать следующим лучшим вариантом в ближайшее время. Это связано со второй причиной, которая заключается в том, что если использовать этот материал для кузовов автомобилей, он может значительно расширить ассортимент электрических и подключаемых гибридных автомобилей, сделав их более коммерчески жизнеспособными. И в-третьих, поскольку это вещество настолько легкое, его можно использовать для бесконечного множества потребительской электроники, такой как mp3-плееры, ноутбуки и тому подобное.
Мало что известно о плотности хранения материала, разрабатываемого в Imperial. Но если он достаточно высок, от литий-ионных элементов можно вообще отказаться. До сих пор исследователи молчали о том, из чего сделан этот материал и что именно с ним можно сделать. Но логично, что если бы структурные части автомобилей или ноутбуков можно было сделать из самих накопителей энергии, можно было бы добиться значительного снижения веса. В конце концов, самая тяжелая и занимающая много места часть большинства этих продуктов, таких как, например, родстер Tesla Motors, — это аккумуляторная батарея.
Электромобили, изготовленные из нового материала (при условии, что он имеет тот же вес, что и стандартное углеродное волокно), будут значительно легче, чем нынешние цельнометаллические конструкции из стали. Та же прочность и жесткость могут быть достигнуты при четверти веса. Более высокая зарядка в более легкой раме означает увеличенный запас хода, лучший расход бензина в гибридах и более высокие максимальные скорости — три показателя, ограничивающие широкое распространение автомобилей с подключаемыми модулями как таковых. Если бы этот материал полностью заменил аккумуляторную батарею в Chevy Volt, его общий вес уменьшился бы на 375 фунтов.
Если бы этот материал полностью заменил аккумуляторную батарею в Chevy Volt, его общий вес уменьшился бы на 375 фунтов.
Звучит как поразительный прорыв. Одна заминка? Расходы. Само углеродное волокно намного дороже, чем сталь и даже алюминий. Титан не всегда дешевле, но его больше. Поэтому, когда мы говорим о принятии этого нового материала на рынок, гораздо более вероятно, что батареи не будут полностью заменены. Скорее, из материала будут сделаны небольшие панели, такие как панели крыши или багажника, чтобы немного увеличить запас хода автомобиля здесь и там. И это все равно будет недешево.
Даже до такого применения технологии еще далеко. Будет интересно посмотреть, как быстро компания выйдет из исследовательской группы и какой будет ее стратегия для возможной коммерциализации. Прямо сейчас кажется, что когда-нибудь это будет уместно для потенциального гибрида Lamborghini, но не для вашей будущей Toyota Prius.
Миссия VentureBeat состоит в том, чтобы стать цифровой городской площадью, на которой лица, принимающие технические решения, могут получить знания о трансформирующих корпоративных технологиях и заключать сделки.
