Виды, устройство и принцип работы автомобильного аккумулятора
работаем 24/7 | круглосуточно и без выходных
БлогВиды, устройство и принцип работы автомобильного аккумулятора
Характеристики АКБ
9772
35 мин
Автомобильный аккумулятор – это прямоугольный моноблок с двумя выходными контактами для подключения плюсовой и минусовой клеммы. В зависимости от фирмы производителя устройство автомобильного аккумулятора отличается в деталях, но в целом АКБ устроен стандартно.
Основные элементы АКБ
Автомобильный аккумулятор или АКБ – это один из типов электрического аккумулятора, применяемый в автомобилях. Энергия аккумулятора используется в первую очередь для работы стартера, инжектора, светового оборудования и блока управления двигателем (ECU). Транспортные средства с двигателем внутреннего сгорания (ДВС) без напряжения в бортовой сети работать по назначению не смогут. Во время работы ДВС электроэнергия вырабатывается генератором, а аккумуляторная батарея запасает электрический ток и отдаёт его, когда в этом возникает необходимость.
Производители чаще используют свинцово-кислотные АКБ. Но в современных моделях авто, например, Porsche Cayenne 2017 г, начали устанавливать литий-ионные LFP.
В этой статье разберем, какие есть виды АКБ, как устроена аккумуляторная батарея и как правильно ее хранить и использовать.
Назначение аккумулятора в автомобиле
Аккумулятор отвечает за накопление и хранение электроэнергии в бортовой сети при неработающем двигателе и далее за запуск двигателя. Главная задача АКБ – произвести прокрутку двигателя. Это происходит с помощью стартера, который получает электроэнергию от батареи. В общем можно сказать, что АКБ призвана выполнять следующие функции:
Если двигатель не работает – батарея подает ток на источники света и все электропотребители в автомобиле;
Если двигатель запускается – постоянный ток подается на обмотку стартера, на свечи зажигания для работы двигателя;
Если двигатель уже работает – АКБ становится становиться буферной аккумуляторной системой для электроэнергии, производимой от генератора, и дополнительным источником питания, если вдруг генератор не справится с нагрузкой.

Как только запускается двигатель, нагрузку на электропитание берет на себя генератор. Только в том случае, если производительности генератора не хватает, АКБ включается без промедления в систему подачи электроэнергии и обеспечивает автономное питание.
Батарея располагается в разных местах, в зависимости от конструкции авто. Чаще АКБ располагается в подкапотном пространстве, в микроавтобусах – под полом в проходе пассажирского отсека, в некоторых грузовых авто – на выносной полке снаружи. В машинах премиум-сегмента (Мерседес, Порше, БМВ) батареи устанавливают под передним или задним сидением , реже – в багажном отсеке. |
Параметры АКБ
Параметры аккумуляторной батареи зависят во многом от автомобиля и его типа. Выбор емкости АКБ зависит от энергобаланса при проектировании авто, т.е. зависит от количества и мощности потребителей на борту авто.Это можно увидеть в таблице:
Емкость аккумулятора, А-ч | Объем двигателя, Л | Транспортное средство |
90 | 1. | Внедорожники, Грузовой автомобиль средней грузоподъемности |
140 | 3.8 — 10.9 | Грузовые |
190 | 7.2 — 12 | Экскаваторы и бульдозеры |
200 | 7.5 — 17 | Фуры и автопоезда |
Характеристики могут меняться из-за слишком высоких или низких температур. Важно учитывать и пусковой ток, который дает аккумулятор для запуска двигателя. Разные машины могут потребовать выдавать ток от 250 А до 1300 А. В идеальных условиях АКБ выдает указанный производителем ток в течение 30 секунд, но зимой это время может увеличиться.
Согласно методикам тестирования на лабораторном стенде, АКБ должна выдавать ток в течение 30 секунд – время при котором полностью замерзшая АКБ при -18 градусов после 24 часов хранения в морозильнике должна выдержать ток холодной прокрутки, указанный на этикетке до падения напряжения на клеммах 7,2 В.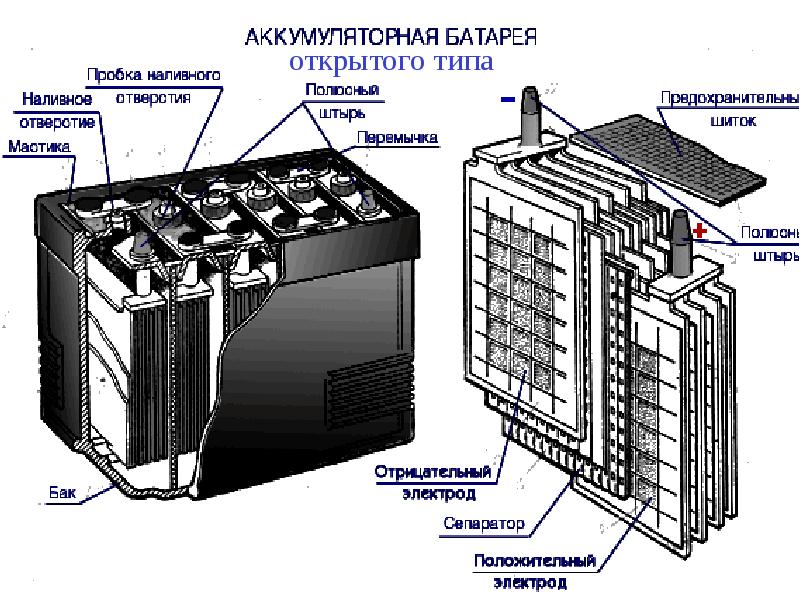 При более низких температурах время выдачи тока АКБ может уменьшиться.
При более низких температурах время выдачи тока АКБ может уменьшиться.
Устройство аккумулятора
Разберем, из чего состоит аккумулятор автомобиля:
- Корпус;
- Крышка;
- Электроды;
- Сепараторы;
- Ячейки;
- Клеммы/вывода;
- Электролит.
Аккумуляторная батарея напряжением 12В, состоит из 6 аккумуляторных ячеек/блоков/банок,с напряжением 2В в каждой. Каждая из 6 ячеек разделяется на 2 полублока из плюсовых и минусовых пластин (электродов), которые разделены сепараторами. Эти полублоки имеют по несколько пластин, количество которых зависит от номинальной емкости АКБ. Компоновка полублоков положительных и отрицательных пластин спроектирована так, что они установлены поочередно в блок, как игральные карты в колоде.
Каждый блок пластин погружен в определенный объем жидкого электролита, причем блоки огражден друг от друга внутренней стенкой корпуса (ячейками корпуса). Блоки внутри герметичны и никак не сообщаются с соседними, кроме электрического контакта.
Блоки внутри герметичны и никак не сообщаются с соседними, кроме электрического контакта.
В пластинах заряженной АКБ накоплена активная аккумуляторная масса в виде свинцовых химических соединений. Масса называется активной, потому что ждет определенного момента, когда сможет начать «разряжаться».
АКБ работает в двух режимах: заряд и разряд. Блоки пластин (их активная масса) выделяют электрический ток за счет химической реакции превращения свинцовой активной массы в сульфаты свинца. Эти блоки пластин при выделении электрического тока накапливают сульфаты свинца, теряя активную массу.
Корпус и крышка
В корпусе располагаются все элементы АКБ. Обычно он изготовлен из термостойкого и противоударного сополимера полипропилена. Этот материал нейтрален к кислоте.
Крышка закрывает верхнюю часть корпуса, она также выполнена из сополимера полипропилена. Конструкцией современных АКБ предусмотрены следующие элементы крышки:
- заливочные отверстия, в которые устанавливаются пробки для обслуживания и проверки;
- газовые каналы, соединяющие отверстия;
- лабиринтная полость для улавливания паров воды.

Пластины
Пластины относятся к положительному и отрицательному полублоку. Пластины (электроды) состоят из решеток (токоотводов) и нанесенных на них активных масс.
На «+» пластине нанесена активная масса из диоксида свинца, на «–» пластине – металлический пористый свинец. Их можно различить по цвету – первая имеет темно-коричневый цвет, вторая – серый. Пусковой ток создается за счет количества установленных в блок пластин в результате химической реакции этих двух пластин.
Сами решетки изготовлены из свинцовых сплавов с добавлением либо кальция и олова, либо сурьмы (зависит от технологии у производителя АКБ).
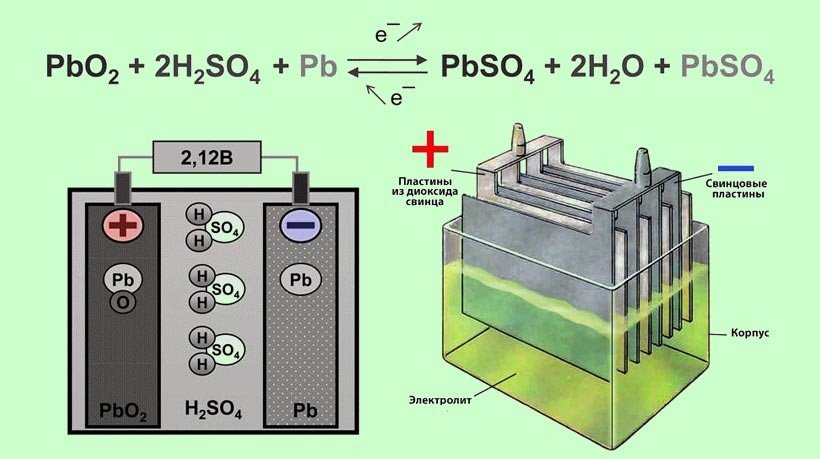
Электролит
Отрицательная и положительная пластина помещается в смесь серной кислоты и дистиллированной воды – в электролит. Полностью заряженный аккумулятор состоит из 36% кислоты и 64% воды. Плотность электролита обычно находится в значениях 1,25-1,30 г/см3 (зимний вариант) и от 1,20 до 1,27 (летний вариант).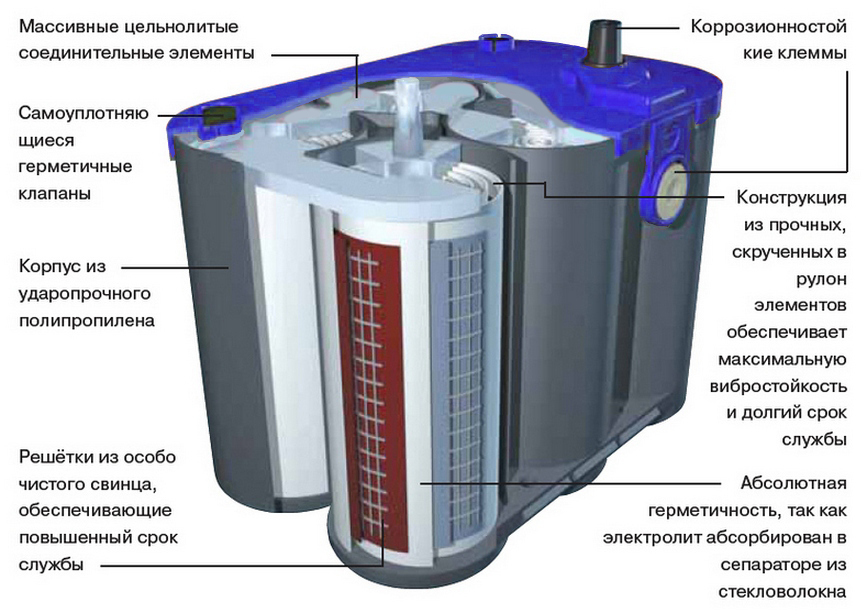
Вещества в электролите реагируют на заряд и разряд, из-за чего меняется их соотношение. Например, при разряде серной кислоты в электролите становится меньше, в то время как количество воды увеличивается. При заряде баланс восстанавливается.
Сепаратор
Между пластинами помещены сепараторы – это тонкие пористые изоляторы, которые нужны для предотвращения короткого замыкания. Эти изоляторы в АКБ с жидким электролитом выполняют из высокопористого п/э или ПВХ. А в АКБ AGM ставят сепараторы из стекловолокна. Сепараторы делают в виде конвертов, запаянных сбоку.
Клеммы и пробки
Клеммы (клеммные электрические выводы) – это изделия из свинца, с помощью которого происходит подключение АКБ к сети автомобиля. Для клемм нужна высокая проводимость и устойчивость к нагреву.
Пробки закрывают доступ к каждой банке (секции) АКБ. Если их открутить, можно проверить уровень электролита, его цвет и плотность.
Принцип действия аккумуляторов в автомобиле
Весь принцип работы аккумуляторной батареи строится на цикле – сначала разряд, а потом заряд. АКБ работает через электрохимическую реакцию окисления свинца. Это реакция происходит между пластинами и электролитом, то есть в растворе серной кислоты и воды.
Реакция при разряде | Реакция при заряде |
На отрицательной пластине происходит растворение свинца в электролите. Серная кислота вступает в реакцию с металлом на пластине, окисляя его. В это время как на положительной пластине происходит частичное восстановление свинца из диоксида свинца. При данных условиях появляется потенциал, который способствует выделению э/энергии. Этому способствует расход серной кислоты из электролита, который при полном разряде АКБ может принимать значения плотности 1,1 гр/см3 или ниже. | Происходит обратная реакция – количество диоксида и металлического “губчатого” свинца в пластинах увеличивается, количество серная кислоты в электролите также повышается, при этом плотность электролита должна быть не менее 1,27 гр/см3. |
Реакция на анод: Реакция на катод: | Реакция на анод: Реакция на катод: |
При разрядке АКБ меняется количество серной кислоты и воды. Кислоты становится меньше, а воды больше. При заряде – обратная ситуация. При этом нужно не допускать глубокого разряда. Глубокий разряд – когда аккумулятор разряжается ниже допустимого уровня. Такое может случиться даже с дорогой иностранной машиной.
Зарядка, хранение и зависимость от температуры
Срок работы аккумулятора зависит от правильного хранения и заряда. Попеременные запуски двигателя, дополнительное подключение электронных устройств, недолгие поездки на пару метров снижают эффективность работы АКБ и значительно сокращают ее срок службы.
Температура – тоже важный фактор влияния на работу батареи – чем ниже температура на улице, тем меньше емкости АКБ будет доступно для запуска авто и тем быстрее будет разряжаться аккумулятор. а
Обслуживание аккумуляторной батареи
Нужно постоянно проверять аккумулятор и заряд на соответствие требованиям. К этим требования относятся:
- Проверка уровня и плотности электролита: по необходимости восполнить его недостаток;
- Чистка креплений электрических соединений металлическими щеточками, наждачной бумагой или специальными авто-химическими средствами;
- Профилактика коррозии клемм с помощью войлочных противоокислительных прокладок и смазывание поверхности клемм литолом;
- Проверка качества и надежности крепления и фиксации клемм, их контактов,
- Систематический анализ степени заряженности АКБ с помощью тестеров.
Водителям достаточно содержать батарею в чистоте и протирать корпус водным раствором соды.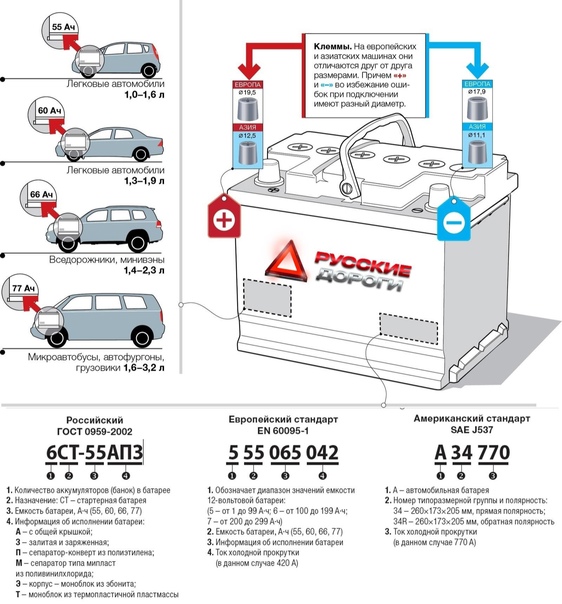
Как происходит зарядка аккумуляторной батареи?
Перед зарядкой АКБ нужно подготовить все газовые каналы. Важно отслеживать напряжение, ток зарядки и время. В процессе зарядки напряжение должно расти, а ток наоборот – уменьшаться.
Автовладельцы используют 2 режима зарядки: с помощью постоянного тока и постоянного напряжения.
Зарядка происходит последовательно:
- На зарядном устройстве нужно установить силу тока. Его значение – в 10 раз меньше емкости аккумулятора.
- Когда батарея заряжается – напряжение снижается;
- Ток можно снизить в 2 раза, когда напряжение достигнет значения 14,4 Вт. Повторить еще раз, когда напряжение будет на отметки в 15 Вт. ;
- Если напряжение и ток не меняется пару часов, значит, аккумулятор заряжен.
Если выбран заряд постоянным напряжением, то нужно установить его значения в пределах 14,4–14,5 В. В этом случае время зарядки колеблется в пределах 24 часов. Удобнее использовать современные зарядные устройства с автоматическим зарядом при постоянном напряжении.
Удобнее использовать современные зарядные устройства с автоматическим зарядом при постоянном напряжении.
Сколько по времени происходит зарядка аккумулятора?
Зарядка постоянным током происходит всего за 10-15 часов. Максимум, сколько можно держать на заряде аккумулятор – 24 часа. При большем заряде электролит начинает терять воду и понижать свой уровень, что может привести к короткому замыканию между оголенными верхними участками пластин.
Эксплуатация аккумуляторных батарей
Есть несколько правил по эксплуатации аккумулятора для автомобилей:
- Нужно контролировать натяжение ремня генератора;
- Не допускать работу электропотребителей при выключенном двигателе;
- Следить за «утечкой» тока от АКБ;
- Можно дополнительно подсоединить «массовый провод» – он уменьшает потеть напряжение батареи во время запуска двигателя;
- Контроль за электролитом и измерять напряжение на полюсных клеммах.
 Делать это лучше через 8-10 часов после затухания двигателя.
Делать это лучше через 8-10 часов после затухания двигателя.
Типы аккумуляторов
Характеристики автомобильных батарей будут различаться. По типу эксплуатации АКБ можно классифицировать:
- по составу активного вещества;
- по типу электролита.
Разберем основные виды аккумуляторов для автомобилей.
Свинцово-кислотные
Чаще всего можно встретить именно этот тип аккумуляторных батарей для автомобиля. В статье мы разбирали заряд и разряд именно на основе свинцово-кислотных АКБ. Это проверенные временем батареи, которые показали свои преимущества не раз. Они заключаются в низком саморазряде, минимальном обслуживании и высокой токоотдачи. К недостаткам можно отнести крупные габариты, низкую энергоемкость, экологическую опасность и ограниченное количество циклов заряда-разряда.
EFB
Батареи данного типа появились недавно. Они работают по принципу, аналогичному классическим свинцово-кислотным АКБ с жидким электролитом, но являются более улучшенной версией. Отличительные особенности:
Они работают по принципу, аналогичному классическим свинцово-кислотным АКБ с жидким электролитом, но являются более улучшенной версией. Отличительные особенности:
- Усиленные пластины за счет другой рецептуры электродных паст/активных масс и применения конструктивных решений для исключения быстрого “осыпания” пластин;
- другой тип решеток;
- измененные сплавы решеток;
- сепаратор с дополнительный ребрами для снижения эффекта «расслоения» плотности электролита.
Такие батареи имеют высокий прием заряда, т.е. успевают восстанавливаться за короткий промежуток времени и могут выдержать большое количество циклов разряда и заряда. Ввиду особенностей строения АКБ EFB нужно строго соблюдать условия заряда и не допускать “кипения” электролита.
AGM
Такие АКБ имеют более крепкий герметичный корпус с крышкой, чем у классической батареи или АКБ EFB. Данная технология АКБ относиться к классу необслуживаемых закрытого типа, конструкция крышки которой имеет встроенную клапанную регулирующую систему, поддерживающую небольшое избыточное давление внутри корпуса при эксплуатации батареи.
Сепаратор используется из стекловолоконного материала, который пропитан жидким электролитом. Микропоры этого материала заполнены электролитом не полностью. Свободный объём пор используется для рекомбинации газов. АКБ AGM можно долго использовать в автомобиле – средний срок службы от 5 до 10 лет в зависимости от условий эксплуатации. Эта модель более устойчива к глубоким разрядам. К недостаткам можно отнести высокую стоимость, чувствительность к перезаряду и высокие массо-габаритные характеристики с учетом требуемой емкости в сравнении с АКБ с жидким электролитом.
Гелевые
Гелевые аккумуляторы также относятся к классу необслуживаемых закрытого типа и имеющих клапанную систему, как и AGM. В этих АКБ установлен сепаратор из ПВХ или фенол-формальдегидных смол, а электролит не жидкий, а гелеобразный, что максимально исключает “опадение” активной массы с пластин при эксплуатации.Такие батареи служат достаточно долго, до 15 лет. Как и AGM, гелевые АКБ не боятся глубоких разрядов, но отличаются тем, что количество циклов заряд-глубокий разряд выше, чем у AGM.
Как и AGM, гелевые АКБ не боятся глубоких разрядов, но отличаются тем, что количество циклов заряд-глубокий разряд выше, чем у AGM.
Заключение
Аккумулятор – одна из ключевых частей в автомобиле. Это специально разработанное устройство, где выработка энергии происходит благодаря химическим процессам. Энергия, выделяемая при химических реакциях, преобразовывается в электрическую, далее отдает заряд для различных приборов и устройств машины.
Водителю важно знать, как работает аккумулятор, какие типы его бывают, и как правильно проводить его обслуживание, чтобы он прослужил как можно дольше. Важно иметь представление о зарядке, хранении и эксплуатации АКБ.
Ассортимент АКБ для разных видов транспорта можно найти в нашем каталоге . Мы сотрудничаем только с проверенными производителями и постоянно тестируем новинки аккумуляторного рынка.
Предыдущая статья Следующая статья
АКБ: купить новый или реанимировать старый
Предыдущая статья Следующая статья
На что обращать внимание при покупке аккумулятора?
Читайте также
Подбор АКБ
29 мин
Как выбрать автомобильный аккумулятор?
Аккумулятор (аккумуляторная батарея) автомобиля выступает вспомогательным источником электроэнергии в бортовой сети при неработающем двигателе и для запуска двигателя. К выбору АКБ стоит отнестись максимально ответственно. Расскажем, как выбрать аккумуляторную батарею. Рассмотрим основные нюансы, на
К выбору АКБ стоит отнестись максимально ответственно. Расскажем, как выбрать аккумуляторную батарею. Рассмотрим основные нюансы, на
Пуско-зарядное устройство
17 мин
Как выбрать пуско-зарядное устройство: рекомендации для автомобилистов
В ситуации, когда аккумулятор разрядился или его емкости не хватает для запуска двигателя, пускозарядное устройство решит проблему и позволит завести машину. Также его можно использовать в качестве классического зарядного устройства, что очень удобно. Этот тип оборудования занимает немного места и м
Сайт использует файлы Cookie (куки-файлы)
Продолжая использовать сайт Вы соглашаетесь на сбор данных о Вашем посещении сайта.
Error
Sorry, the requested file could not be found
More information about this error
Jump to…
Jump to…Новостной форумВстречи с АТб-18А2Встреча с АВСб-18Z1,2Лекции по дисциплинеhttps://meet.google.com/art-hjtd-cgjМатериалы по дисциплинеЗадание №1Ответы на задание №1 (Внешние световые приборы)Задание №2Ответы на задание №2 (рулевое управление)Задание №3Ответы на задание №3 (Определение токсичности отработавших газов)Задание №4Ответы на задание №4 (Определение шумности выхлопа)Итоговый тест по дисциплинеВстреча с АВСб-18Z 16.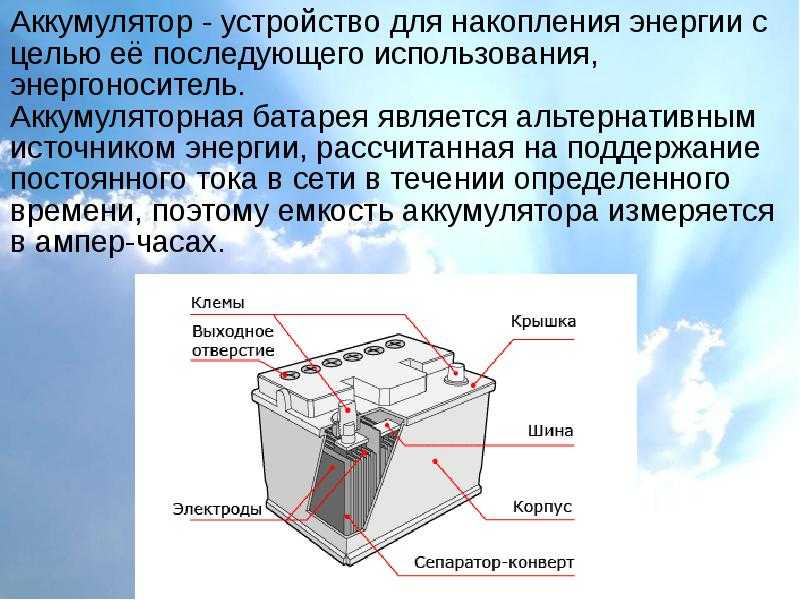 03.2022Ссылка на встречи АТб-17А2МУ Диагн сист впрыскаВопросы к экзам по СИСТ ПИТ и УПРМУ по выполнению контрольной работыСписок АВСб18Z1Список АВСб18Z2Выполненная КРПракт №1 ОСПУАД (Бенз)Ответы на задание №1Практ №2 ОСПУАД (Диз)Ответы на задание №2Практ №3 ОСПУАД (Газ)Ответы на задание №3Итоговый тест по дисциплинеЗадание №1Отправка задания «Практика АТб-19″Материалы по практикеЗадание №2 до 20.04.20Ответы на задание №2Задание №3 до 04.05.20Ответы на задание №3Задание №4Ответы на задание №4Расписание занятий АТб-19А1Задание для отчета по учебной практике 1 курсОтчеты по практикеРАсписание на летнюю (соср) уч практикуВласов Тех обсл и ремонт а/мЗадание на уч. практику 2 (Летняя)Отчеты по учебной практике 2 (Летняя)Задание для отчёта по прктике АТб-19А1Материалы по практикеОтчеты по учебной практике №3Задание по практике№1Отправка задания «Практика АТб-18″Ответы на задание №2Задание №2 до 16.04.20Материалы по практикеЗадание №3 до 30.04.20Ответы на задание №3Задание №4 до 14.05.20Ответы на задание №4Расписание занятий АТб18А1Расписание занятий АТб18А2Задание №5 до 29.
03.2022Ссылка на встречи АТб-17А2МУ Диагн сист впрыскаВопросы к экзам по СИСТ ПИТ и УПРМУ по выполнению контрольной работыСписок АВСб18Z1Список АВСб18Z2Выполненная КРПракт №1 ОСПУАД (Бенз)Ответы на задание №1Практ №2 ОСПУАД (Диз)Ответы на задание №2Практ №3 ОСПУАД (Газ)Ответы на задание №3Итоговый тест по дисциплинеЗадание №1Отправка задания «Практика АТб-19″Материалы по практикеЗадание №2 до 20.04.20Ответы на задание №2Задание №3 до 04.05.20Ответы на задание №3Задание №4Ответы на задание №4Расписание занятий АТб-19А1Задание для отчета по учебной практике 1 курсОтчеты по практикеРАсписание на летнюю (соср) уч практикуВласов Тех обсл и ремонт а/мЗадание на уч. практику 2 (Летняя)Отчеты по учебной практике 2 (Летняя)Задание для отчёта по прктике АТб-19А1Материалы по практикеОтчеты по учебной практике №3Задание по практике№1Отправка задания «Практика АТб-18″Ответы на задание №2Задание №2 до 16.04.20Материалы по практикеЗадание №3 до 30.04.20Ответы на задание №3Задание №4 до 14.05.20Ответы на задание №4Расписание занятий АТб18А1Расписание занятий АТб18А2Задание №5 до 29.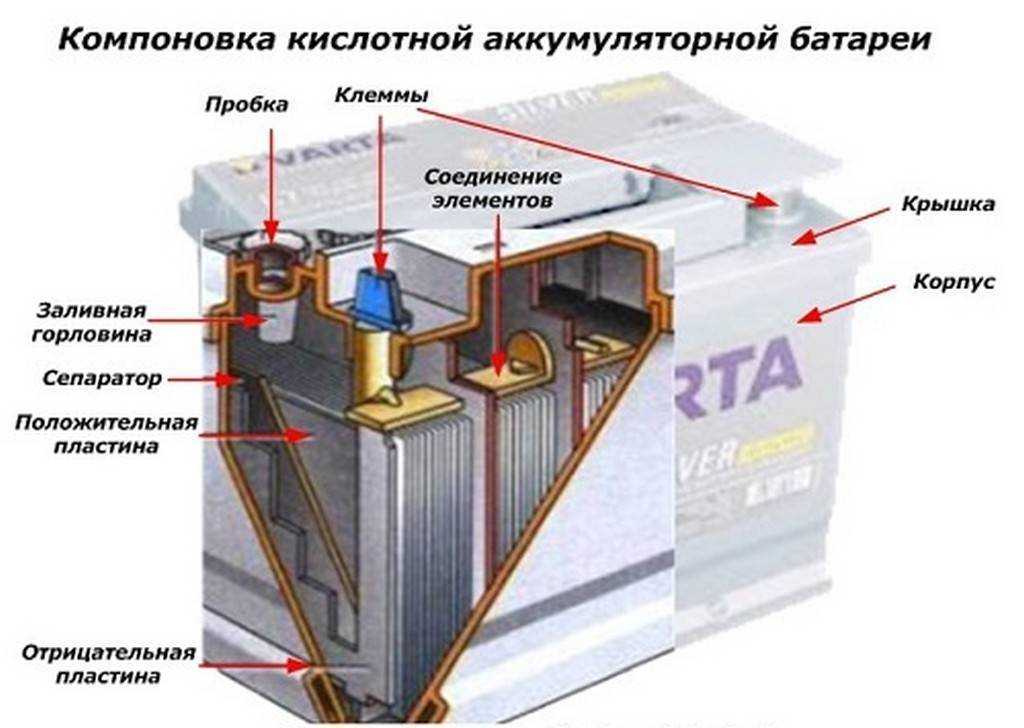

 03.21)Задание на практ работу №1Выполненные задания по практической работе №1Задание на практ работу №2Выполненные задания по практической работе №2Задание на лабор работуОтчеты по лабор работеИтоговый тест по дисциплинеДля АТб-17А2 https://meet.google.com/vzc-kyyj-rchОтправка задания для зачетаВопросы к зачету по дисциплине ЭСАЭлектронные и микропроцессорные системы автомобилейУчеб пособиеИтоговое тестирование по дисциплинеОтправка заданий для зачетаКадровое обеспечение системы автосервисаас предприятияВопросы для зачетаВстречи с ПОб-19ZЭлектронные и микропроцессорные системы автомобилейУчеб пособиеКР ДЭиЭСКонтрольная работаВопросы к зачету по дисциплине ДЭиЭСОтветы на вопросы по дисциплинеИтоговый тест по дисциплинеВстреча с ДВСб-19А1 Вопросы по дисциплине ЭиЭСУСИСТЕМЫ ЭЛЕКТРОСНАБЖЕНИЯ И ЗАЖИГАНИЯ АВТОМОБИЛЕЙ Методические указания к лабораторным работам-5Задание для заочВопросы к экз по ЭиЭСУДВстреча с ДВСб-18А1 17.09.21Материалы по дисциплинеЗадание для ДВСб-18А1 на 01.11Ответы на задание ДВСб-18А1 на 01.
03.21)Задание на практ работу №1Выполненные задания по практической работе №1Задание на практ работу №2Выполненные задания по практической работе №2Задание на лабор работуОтчеты по лабор работеИтоговый тест по дисциплинеДля АТб-17А2 https://meet.google.com/vzc-kyyj-rchОтправка задания для зачетаВопросы к зачету по дисциплине ЭСАЭлектронные и микропроцессорные системы автомобилейУчеб пособиеИтоговое тестирование по дисциплинеОтправка заданий для зачетаКадровое обеспечение системы автосервисаас предприятияВопросы для зачетаВстречи с ПОб-19ZЭлектронные и микропроцессорные системы автомобилейУчеб пособиеКР ДЭиЭСКонтрольная работаВопросы к зачету по дисциплине ДЭиЭСОтветы на вопросы по дисциплинеИтоговый тест по дисциплинеВстреча с ДВСб-19А1 Вопросы по дисциплине ЭиЭСУСИСТЕМЫ ЭЛЕКТРОСНАБЖЕНИЯ И ЗАЖИГАНИЯ АВТОМОБИЛЕЙ Методические указания к лабораторным работам-5Задание для заочВопросы к экз по ЭиЭСУДВстреча с ДВСб-18А1 17.09.21Материалы по дисциплинеЗадание для ДВСб-18А1 на 01.11Ответы на задание ДВСб-18А1 на 01.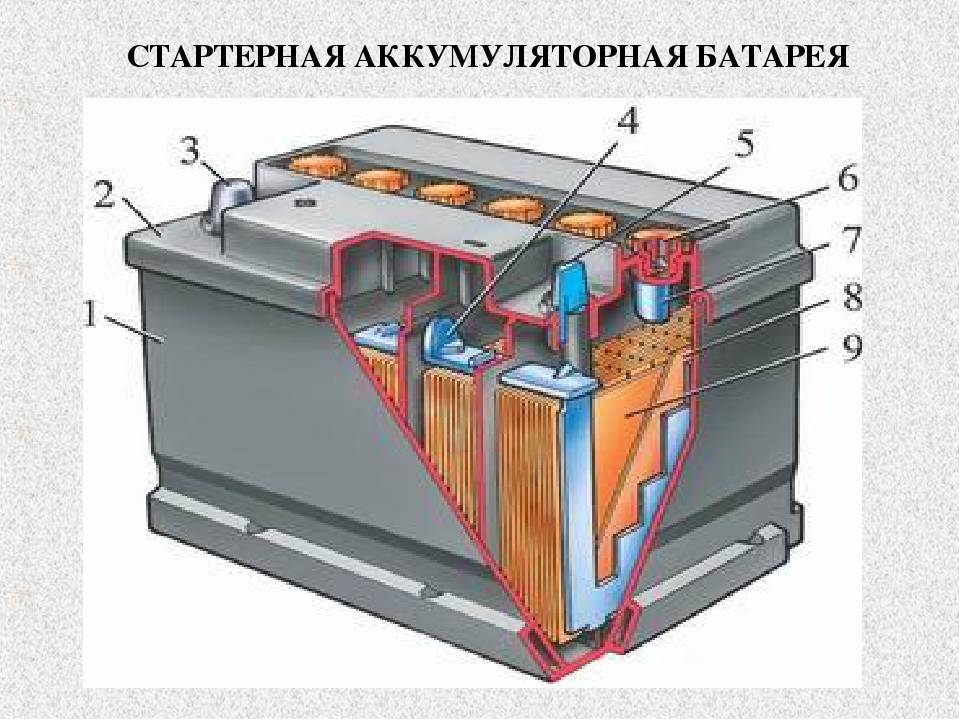

 Бизнес-планирование предприятий автомобильного сервисаРаздел 4. Организация работы с потребителемРаздел 5. Организация и нормирование труда в автосервисном предприятииТеоретические материалыПрактическая работа 1 АВСб-20ZПрактическая работа 1 АВСб-20ZПрактическая работа 2 АВСб-20ZПрактическая работа 2 АВСб-20ZПрактическая работа 3 АВСб-20ZПрактическая работа 3 АВСб-20ZЗадание для АТб-20А2 на 01-06.11.21Задание по лекциям на 01-06.11.21 АТб-20А2Задание по практическим на 01-06.11.21 для АТб-20А2Тесты ООФАСВсё для экзаменаОтветы на вопросы экзаменаПрактическая работа №1 (АТб-20А2)Практическая работа №2Итоговый тестСсылка на встречу в Google MeetАТб-22Т1 Задание для отчета по учебной практике 1 курсАТб-22Т2 Задание для отчета по учебной практике 1 курсНСб-22Т1 Задание для отчета по учебной практике 1 курсОтчеты по практике АТб (Задание №1)Отчеты по практике НСб (Задание №1)Титульный образецСписок использованных источников. Правила оформленияЗадание для заочного ф-таМатериалы по дисциплинеВидеоматериалы по дисциплинеЗадание №1Задание №2Видеовстречи ДВСбИтоговый тест по дисциплинеМатериалы по дисциплинеЗадание к лабораторнойЗадание к лабораторнойЗадание на практ работу №1Практическое задание №1Задание на практ работу №2Практическая работа№2Опрос 1 Контр.
Бизнес-планирование предприятий автомобильного сервисаРаздел 4. Организация работы с потребителемРаздел 5. Организация и нормирование труда в автосервисном предприятииТеоретические материалыПрактическая работа 1 АВСб-20ZПрактическая работа 1 АВСб-20ZПрактическая работа 2 АВСб-20ZПрактическая работа 2 АВСб-20ZПрактическая работа 3 АВСб-20ZПрактическая работа 3 АВСб-20ZЗадание для АТб-20А2 на 01-06.11.21Задание по лекциям на 01-06.11.21 АТб-20А2Задание по практическим на 01-06.11.21 для АТб-20А2Тесты ООФАСВсё для экзаменаОтветы на вопросы экзаменаПрактическая работа №1 (АТб-20А2)Практическая работа №2Итоговый тестСсылка на встречу в Google MeetАТб-22Т1 Задание для отчета по учебной практике 1 курсАТб-22Т2 Задание для отчета по учебной практике 1 курсНСб-22Т1 Задание для отчета по учебной практике 1 курсОтчеты по практике АТб (Задание №1)Отчеты по практике НСб (Задание №1)Титульный образецСписок использованных источников. Правила оформленияЗадание для заочного ф-таМатериалы по дисциплинеВидеоматериалы по дисциплинеЗадание №1Задание №2Видеовстречи ДВСбИтоговый тест по дисциплинеМатериалы по дисциплинеЗадание к лабораторнойЗадание к лабораторнойЗадание на практ работу №1Практическое задание №1Задание на практ работу №2Практическая работа№2Опрос 1 Контр.
Типы батарей — Curious
Наши старые друзья
Свинцово-кислотный
Когда вам в последний раз приходилось вытаскивать рукоятку заводной рукоятки, вставлять ее в коленчатый вал автомобиля и крутить хорошенько, чтобы двигатель завелся? Никогда? Это потому, что у нас есть свинцово-кислотные аккумуляторы, подключенные к двигателям наших автомобилей, которые обеспечивают импульс мощности, необходимый двигателю для запуска. Они были изобретены Гастоном Планте в 1859 году.
Они были изобретены Гастоном Планте в 1859 году.
Как следует из названия, в этих батареях есть свинец. На самом деле оба электрода (проводники, по которым электричество входит или выходит из батареи) содержат некоторое количество свинца — анод (электрод с положительными изменениями) сделан из металлического свинца (Pb), а катод (отрицательно заряженный электрод) — из диоксида свинца (PbO). 2 ). Электроды помещают в раствор электролита серной кислоты (H 2 SO 4 ), который состоит из ионов водорода (H + ) и ионов бисульфата (HSO 4 ).
Свинец на аноде реагирует с бисульфатом из электролита, высвобождая часть электронов и образуя сульфат свинца, который образует кристаллы на аноде, и ионы водорода, которые переходят в электролит. Электроны перемещаются к катоду через внешнюю цепь, где они вместе с ионами бисульфата и водорода из электролита реагируют с катодом из диоксида свинца.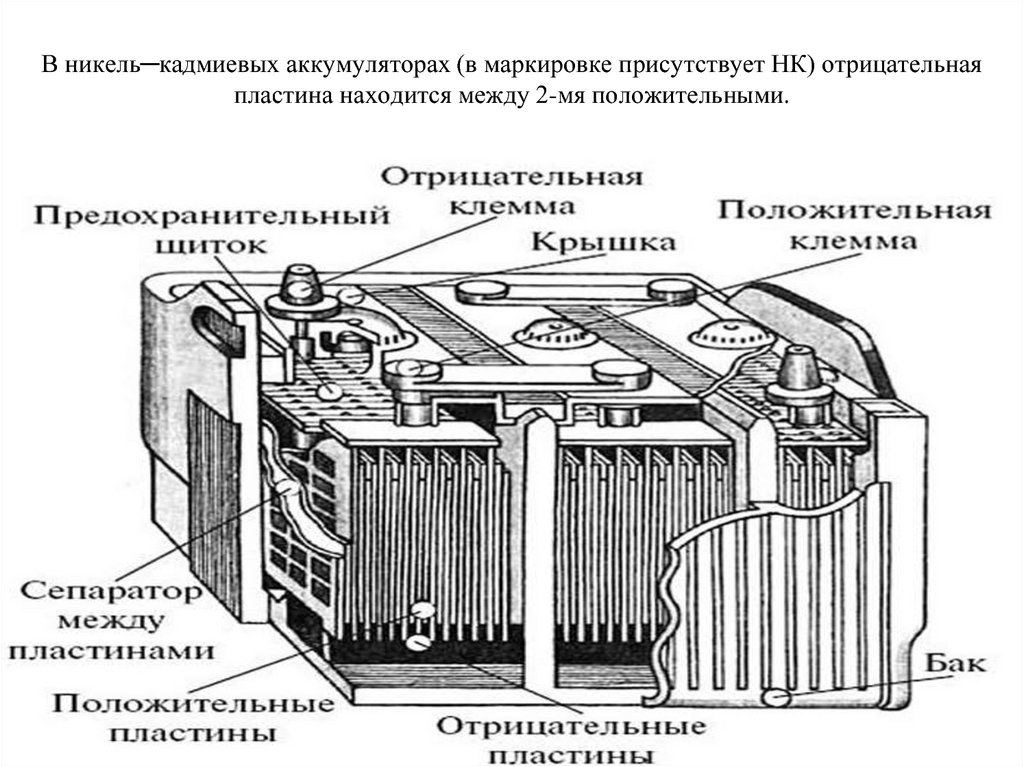 При этом также образуется сульфат свинца, который снова образует кристаллы, на этот раз на катоде.
При этом также образуется сульфат свинца, который снова образует кристаллы, на этот раз на катоде.
Свинцово-кислотные аккумуляторы можно перезаряжать — те, что в наших автомобилях, заряжаются с помощью небольшого генератора, подключенного к двигателю, называемого генератором переменного тока. Вот почему, когда вы оставили фары в машине включенными, а аккумулятор разрядился, рекомендуется некоторое время покататься после запуска двигателя, чтобы дать аккумулятору время снова зарядиться.
Когда батарея заряжается, химические реакции, описанные выше, которые производят электричество, запускаются в обратном направлении. Покрытия из сульфата свинца растворяются и вытесняются обратно в электролит в виде Pb2+ и SO 9 .0009 4 2- ионы. Затем ионы Pb 2+ захватывают два электрона и вновь осаждаются на аноде в виде нейтрального Pb.
На катоде ионы Pb 2+ отдают два электрона, образуя и реагируя с молекулами воды (H 2 O) с образованием нейтрального диоксида свинца на катоде и некоторых ионов бисульфата, которые возвращаются в раствор электролита.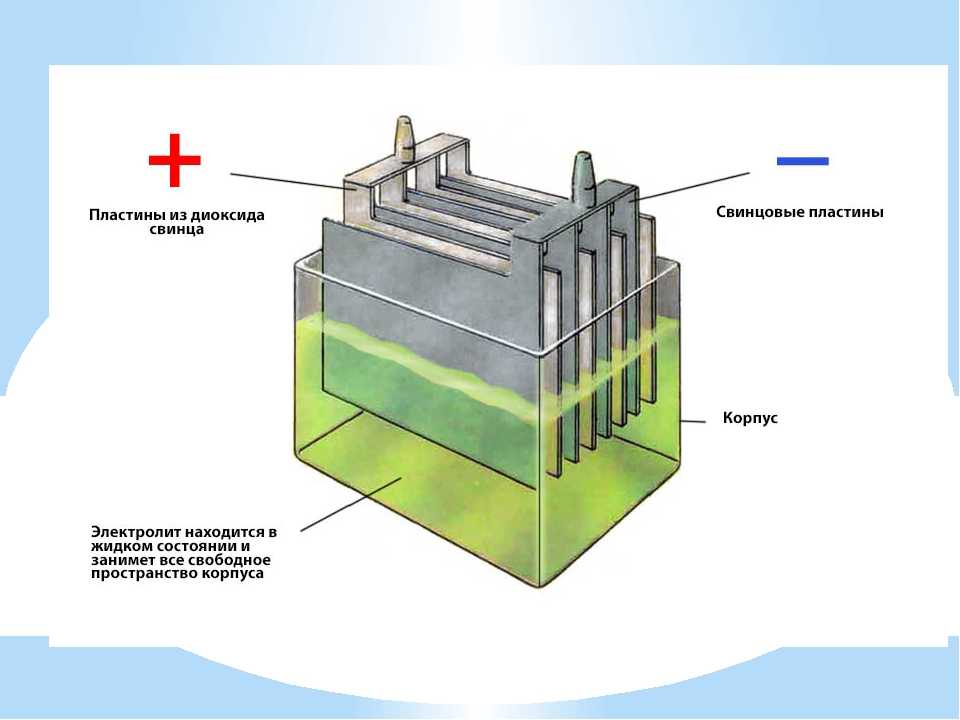
Однако, если свинцово-кислотный аккумулятор слишком сильно разряжается или слишком долго остается перед зарядкой, покрытия сульфата свинца образуют твердые кристаллы, которые невозможно удалить в процессе зарядки.
Ultrabattery
Ultrabattery, разработанная в CSIRO, представляет собой усовершенствованную версию традиционной свинцово-кислотной батареи. Он сочетает в себе стандартную технологию свинцово-кислотных аккумуляторов с суперконденсатором. Когда обычная свинцово-кислотная батарея разряжается, реакция, которая ее запускает, приводит к образованию кристаллов сульфата свинца как на аноде, так и на катоде. В процессе перезарядки эти покрытия удаляются, но электроды (и, следовательно, батарея) со временем изнашиваются. Кроме того, батарея не любит работать в частично заряженном состоянии — состоянии, при котором батарея подвергается повторяющимся коротким циклам разрядки и перезарядки, при этом батарея никогда полностью не разряжается и не заряжается. Этот режим частичной зарядки особенно важен для транспортных средств.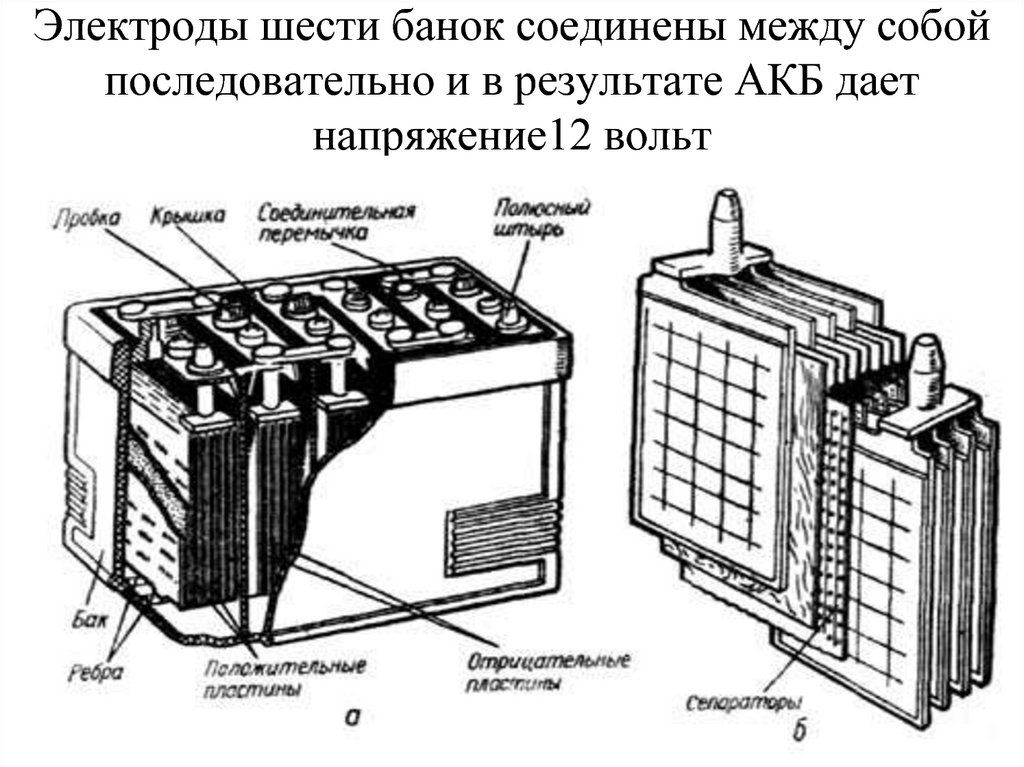
Ультрабатарея использует суперконденсатор для компенсации проблемных реакций свинцовых электродов в свинцово-кислотной батарее, увеличивая срок ее службы. Поскольку суперконденсатор может очень быстро накапливать и накапливать заряд, он может поглощать доступную мощность, а затем подавать ее в батарею с нужной скоростью. Ему удается уменьшить накопление сульфатов, возникающих в результате процесса разрядки-зарядки в стандартной свинцово-кислотной батарее.
UltraBattery относительно дешев в производстве, примерно на 70 процентов дешевле, чем литий-ионные батареи, используемые в настоящее время в гибридных электромобилях. Еще одним потенциальным применением UltraBattery могут быть электростанции для хранения и «сглаживания» энергии, производимой возобновляемыми источниками, такими как солнце и ветер. В крупномасштабных испытаниях ветряной электростанции в Австралии UltraBattery превзошла обычные свинцово-кислотные батареи.
- Что такое суперконденсатор?
Конденсатор похож на аккумулятор… но не совсем.
 Энергия батареи исходит от химической реакции между ее компонентами. Электричество генерируется потоком электронов в ходе окислительно-восстановительной реакции между анодом и катодом.
Энергия батареи исходит от химической реакции между ее компонентами. Электричество генерируется потоком электронов в ходе окислительно-восстановительной реакции между анодом и катодом.Конденсатор также дает энергию, но не в результате химической реакции. Конденсаторы состоят из двух проводящих пластин с диэлектриком или изолятором (вещество, которое не проводит электричество) между ними. Когда эти пластины подключены к электрическому току, ток течет в них; одна пластина хранит отрицательный заряд на своих поверхностных атомах, а другая — положительный заряд, опять же на поверхностных атомах. Поскольку эти разнозаряженные пластины разделены непроводящим диэлектриком, создается электрическое поле, которое накапливает электрическую энергию. Когда конденсатор подключен к другой цепи, он высвобождает (разряжает) электрическую энергию.
Конденсаторы обычно очень быстро высвобождают свою энергию — они обеспечивают быстрые выбросы энергии. Это делает их полезными для довольно специфических задач, таких как включение вспышки на камере.
 Вспышка быстро использует много энергии для создания яркого света, затем конденсатор перезаряжается от аккумулятора камеры, чтобы его можно было снова использовать для следующего снимка.
Вспышка быстро использует много энергии для создания яркого света, затем конденсатор перезаряжается от аккумулятора камеры, чтобы его можно было снова использовать для следующего снимка.Облако представляет собой конденсатор. Когда мелкие частицы льда в облаке сталкиваются друг с другом и другими частицами влаги, электроны могут выбиваться. Эти электроны имеют тенденцию накапливаться в нижних областях облака. Маленькие и теперь положительно заряженные частицы поднимаются к вершине облака. Это означает разделение зарядов и электрическое поле внутри облака. По мере того, как отрицательный заряд в нижней части облака увеличивается в силе, он отталкивает от себя другие отрицательные заряды — он толкает электроны на поверхности Земли глубже в землю, а это означает, что на поверхности накапливается положительный заряд. В итоге мы получаем отрицательно заряженную область (нижняя часть облака), отделенную от положительно заряженной области (земли) плохим проводником электричества (воздухом).
 Когда электрическое поле в облаке становится достаточно сильным, оно может «разбивать» окружающий воздух на ионизированные (заряженные) частицы, превращая его из непроводящего изолятора в проводник. Электрическая энергия, хранящаяся в облаке, мгновенно высвобождается во вспышке молнии.
Когда электрическое поле в облаке становится достаточно сильным, оно может «разбивать» окружающий воздух на ионизированные (заряженные) частицы, превращая его из непроводящего изолятора в проводник. Электрическая энергия, хранящаяся в облаке, мгновенно высвобождается во вспышке молнии.Суперконденсаторы — это просто сверхмощные конденсаторы с большей емкостью. Это означает, что они способны хранить гораздо больше электроэнергии, чем обычные конденсаторы.
Никель-кадмиевые
Хотя никель-кадмиевые (NiCad) аккумуляторы уже давно устарели, они были первыми перезаряжаемыми батареями, использовавшимися в электроинструментах, фонариках и других портативных устройствах. Это были парни из наших мобильных телефонов до того, как их вытеснили литий-ионные аккумуляторы. Иногда их до сих пор находят в виде старых аккумуляторов типа АА для фонариков и игрушек. Подобно свинцово-кислотным батареям, эта химия элементов существует уже давно — первые никель-кадмиевые батареи поступили в продажу в 1910! Никель-кадмиевые аккумуляторы
были первыми аккумуляторами, использовавшимися в электроинструментах, фонариках и других портативных устройствах. Источник изображения: цифровой интернет / Flickr.
Источник изображения: цифровой интернет / Flickr.Анод изготовлен из кадмия (Cd), а их катоды представляют собой гидроксид оксида никеля (NiO(OH) 2 ), обычно с электролитом из гидроксида калия (KOH).
Гидроксид оксида никеля является очень хорошим электродом, поскольку он может иметь большую площадь поверхности, что увеличивает активную площадь, доступную для реакции. Кроме того, он не вступает в реакцию с электролитом во время реакции, что сохраняет раствор электролита в чистоте и помогает ячейке прослужить (относительно) долгое время, прежде чем надоедливые побочные реакции приведут к ее деградации.
NiCad аккумуляторы имели несколько недостатков. Во-первых, они были подвержены так называемому «эффекту памяти», когда батареи «запоминали» предыдущие уровни разрядки и не заряжались должным образом. Это было вызвано образованием крупных, а не мелких кристаллов кадмия в процессе перезарядки. Обеспечение того, чтобы аккумулятор был правильно разряжен перед перезарядкой, помогло предотвратить эту проблему.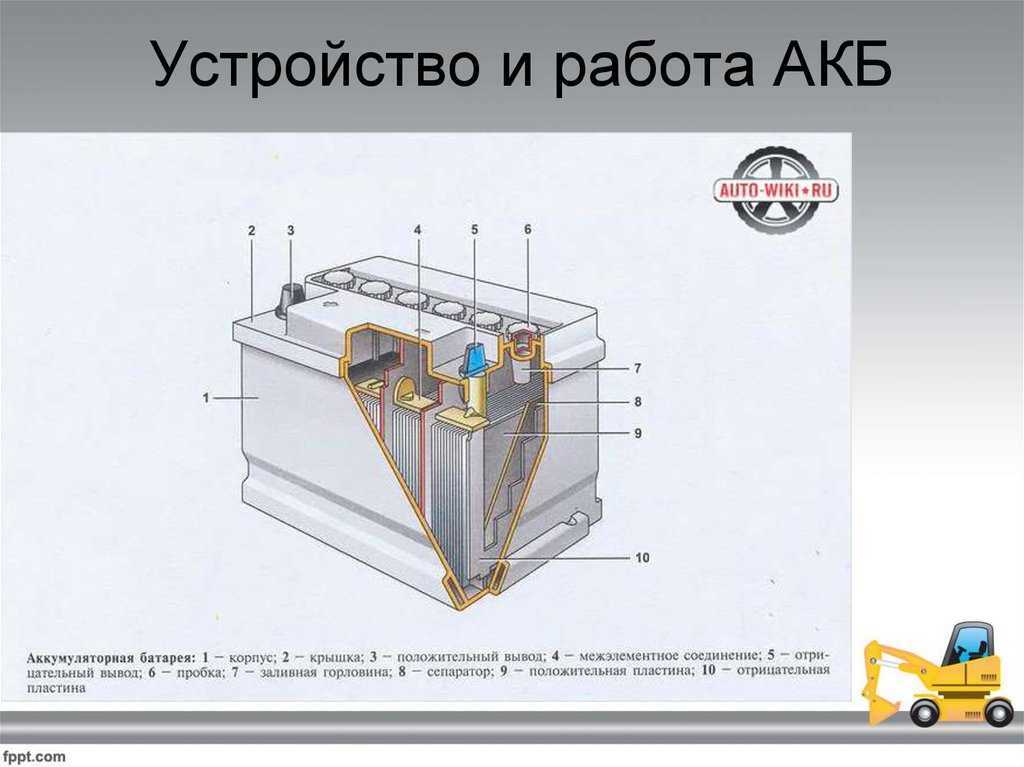 Но нужно быть осторожным — полная разрядка никель-кадмиевого аккумулятора также повреждает его.
Но нужно быть осторожным — полная разрядка никель-кадмиевого аккумулятора также повреждает его.
Во-вторых, скорость саморазряда никель-кадмиевой батареи составляет около 15–20 процентов в месяц. Это означает, что если они простояли на полке несколько месяцев, они потеряли большую часть своего заряда.
В-третьих, кадмий дорог и является токсичным тяжелым металлом, а это означает, что утилизация батарей вредна для окружающей среды.
Никель-металлогидридный (NiMH)
Эти проблемы с никель-кадмиевыми батареями привели к замене кадмиевого анода интерметаллическим сплавом, поглощающим водород (комбинация металлов с определенной кристаллической структурой), который может поглощать до 7% водорода по весу. По сути, анодом является водород; металлический сплав просто служит для него сосудом для хранения.
Наиболее распространенной комбинацией металлов для этого сплава являются металлы с высокой способностью к гидридообразованию, а также металлы со слабым гидридообразованием.
Еще одно соображение при сборке металлического сплава заключается в том, что когда некоторые металлы поглощают водород, в результате реакции выделяется тепло — она экзотермическая. Другие поглощают тепло в результате эндотермической реакции. На самом деле нам не нужна батарея, которая либо выделяет, либо поглощает тепло при разрядке, поэтому, наряду с сочетанием сильных и слабых гидридов, из которых сделан сплав, нам нужна комбинация экзотермических и эндотермических металлов.
Чаще всего электрод представляет собой комбинацию редкоземельных элементов, таких как лантан (La), церий (Ce), неодим (Nd) или празеодим (Pr), смешанный с никелем (Ni), кобальтом (Co), марганцем (Mn) или алюминий (Al).
Электроны, производящие электрический ток батареи, образуются в результате окисления атомов водорода, которые превращаются в протоны. Эти протоны реагируют с ионами гидроксида (OH —) из электролита с образованием воды. Металлический сплав, образующий анод вместе с водородом, не принимает участия в химической реакции, приводящей в движение элемент; это в основном свидетель, который просто обеспечивает дом для всех важных ионов гидрида.
Никель-металлогидридные батареи очень похожи на никель-кадмиевые батареи по напряжению, емкости и области применения. Эффект памяти менее проблематичен, чем у NiCad, и они имеют более высокую плотность энергии. Они до сих пор используются в качестве стандарта для перезаряжаемых батареек типа АА.
Щелочные
Щелочные батареи используются в игрушках, электронике, портативных проигрывателях компакт-дисков, которые мы использовали в девяностых, и в плеерах Walkman, которые были популярны в восьмидесятых. На их долю приходится основная часть аккумуляторов, которые производятся сегодня, хотя их место на вершине, скорее всего, скоро будет конкурировать с литий-ионными аккумуляторами в наших телефонах, ноутбуках и во все большем количестве других гаджетов.
Щелочные батареи бывают разных форм и размеров и составляют большую часть батарей, производимых сегодня. Источник изображения: Pulpolux/Flickr. Они популярны, потому что имеют низкую скорость саморазряда, обеспечивающую длительный срок хранения, и не содержат токсичных тяжелых металлов, таких как свинец или кадмий.
Эти батареи содержат цинк в качестве анода и диоксид марганца (MnO 2 ) в качестве катода. Однако их название происходит от щелочного раствора, используемого в качестве электролита. Обычно это гидроксид калия (КОН), который может содержать большое количество растворенных ионов. Чем больше ионов может поглотить раствор электролита, тем дольше может продолжаться окислительно-восстановительная реакция, приводящая в движение батарею.
Цинковый анод обычно имеет порошкообразную форму. Это дает ему большую площадь поверхности для реакции, что означает, что клетка может высвобождать свою энергию довольно быстро. Он отдает свои электроны катоду из диоксида марганца, к которому добавляется углерод в виде графита для улучшения его проводимости и сохранения формы. 9-$$
9-$$
Mn начинается с +4 и становится +3, когда получает один электрон.
Полная окислительно-восстановительная реакция:
$$\text{Zn(s)} + \text{2MnO}_2\text{(s)} \longleftrightarrow \text{Mn}_2\text{O}_3\text {(s)} + \text{ZnO(s)}$$
И это подводит нас к батареям, которые в наши дни питают большинство наших смартфонов и ноутбуков: литий-ионным батареям. Эти ребята настолько важны, что мы хотели относиться к ним с должным уважением (и подробностями), которых они заслуживают, поэтому вы можете прочитать о них в их собственной функции Nova.
Новички
Окислительно-восстановительный поток
В проточной окислительно-восстановительной батарее нет реактивных электродов и используется раствор электролита для переноса электронов, создающих ток. Проточная батарея по-прежнему имеет сторону анода и сторону катода, но вместо металлических электродов, которые отдают и принимают электроны, у нее есть два «резервуара», заполненных растворами электролитов, в которых растворены активные химические вещества. Существует два типа раствора: анолит, который заменяет анод типичной ячейки, и католит, который действует как катод. Эти растворы перекачиваются вокруг батареи и встречаются в реакционной ячейке или «стеке». Здесь они разделены мембраной, поэтому не смешиваются, однако ионами и электронами можно обмениваться через барьер. Они также встречаются с электродами.
Существует два типа раствора: анолит, который заменяет анод типичной ячейки, и католит, который действует как катод. Эти растворы перекачиваются вокруг батареи и встречаются в реакционной ячейке или «стеке». Здесь они разделены мембраной, поэтому не смешиваются, однако ионами и электронами можно обмениваться через барьер. Они также встречаются с электродами.
Поскольку раствор анолита содержит химические вещества с более высоким химическим потенциалом, чем в растворе католита, когда два раствора встречаются в реакционной ячейке, электроны от анолита направляются через ионопроницаемую мембрану на католит. Эти электроны перехватываются и отправляются выполнять свою полезную работу.
Опять же, это окислительно-восстановительная реакция, которая управляет генерацией электрического тока в батареях этого типа. Анолит окисляется, когда он теряет электроны, а католит восстанавливается, когда он принимает электроны. Когда весь анолит окислился, т. е. потерял все электроны, которые он должен был отдать, его емкость исчерпана и его необходимо перезарядить.
Когда весь анолит окислился, т. е. потерял все электроны, которые он должен был отдать, его емкость исчерпана и его необходимо перезарядить.
Одно из преимуществ проточных окислительно-восстановительных батарей заключается в том, что их емкость зависит от размера баков с раствором электролита. Если вам нужна батарея, которая может работать дольше, вам просто нужны баки большего размера с большим количеством раствора в них. Однако это также означает, что они довольно громоздкие. В основном они используются для операций в промышленных масштабах, таких как хранение энергии, производимой ветряными или солнечными электростанциями. В вашем ноутбуке никогда не будет проточной батареи.
Другая действительно интересная особенность проточных батарей заключается в том, что, поскольку они не имеют твердых электродов, они не подвержены большинству способов, которыми перезаряжаемые батареи изнашиваются со временем. В принципе, это дает им очень долгий срок службы — идеально подходит для использования в солнечных или ветряных электростанциях, в которых батареи заряжаются и разряжаются, по крайней мере, каждый день.
В проточных батареях чаще всего используется ванадий (V). Поскольку этот элемент может благополучно существовать в нескольких различных состояниях окисления — состояниях с разными химическими/окислительно-восстановительными потенциалами — и анолит, и католит могут быть изготовлены из разных форм ванадия. Это решает любые проблемы перекрестного загрязнения растворов электролитов, изготовленных из разных элементов.
Для подзарядки проточного аккумулятора система работает в обратном порядке. Прикладывается внешнее напряжение, и электроны, которые оказались в католите при использовании батареи, отбрасываются обратно в анолит, а положительные ионы возвращаются обратно в католит.
В результате нового исследования была получена проточная батарея, в которой используются ионы лития, и в основном она работает на том же химическом составе, что и литий-ионные батареи в наших телефонах и ноутбуках. Аккумулятор имеет анолит диоксида титана (TiO 2 ) и католит фосфата лития-железа (LiFePO 4 ).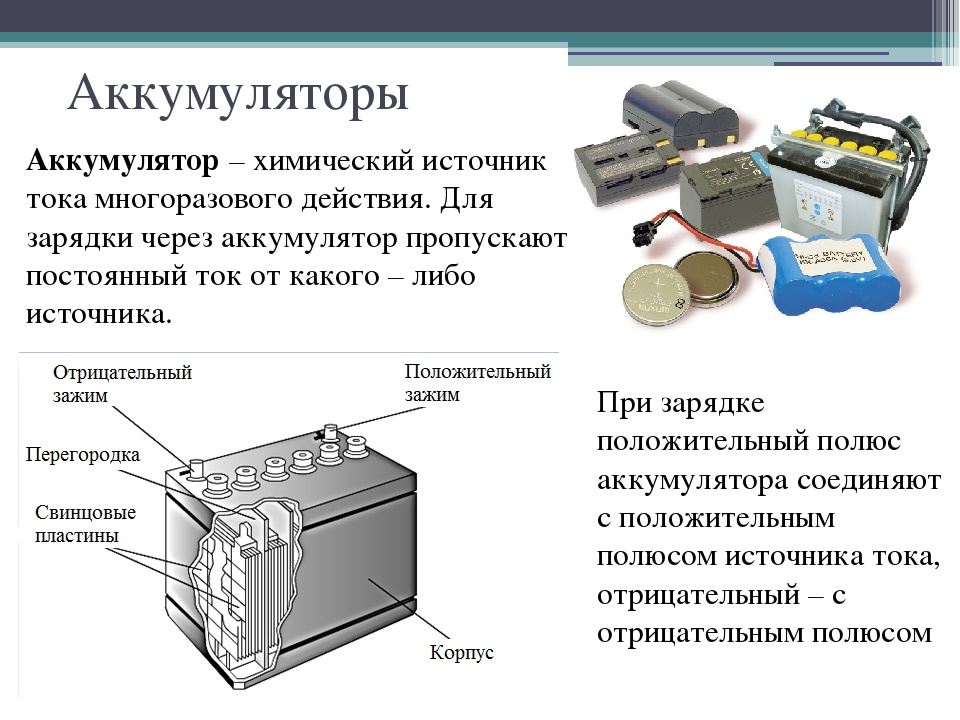 Ранее проблемы с мембраной, разделяющей растворы двух электролитов, препятствовали успешному применению литий-ионной технологии в контексте проточных аккумуляторов — они либо были слишком хрупкими, либо не позволяли эффективно пропускать ионы лития.
Ранее проблемы с мембраной, разделяющей растворы двух электролитов, препятствовали успешному применению литий-ионной технологии в контексте проточных аккумуляторов — они либо были слишком хрупкими, либо не позволяли эффективно пропускать ионы лития.
Потенциальная плотность энергии этой батареи в 10 раз выше, чем у других проточных батарей. Однако скорость, с которой он в настоящее время поставляет энергию, слишком мала для практического использования, поэтому исследователи ищут способы ее улучшить.
Основным недостатком проточных батарей является то, что их работа зависит от насосной системы для циркуляции растворов анолита и католита через реакционную ячейку. Это вводит ряд движущихся частей, которые необходимо регулярно обслуживать и обслуживать.
Литий-серные
Литий-серные батареи обещают стать дешевой альтернативой дорогим литий-ионным. Сера дешевая и ее много.
Анод литий-серной батареи представляет собой чрезвычайно тонкую (и легкую) полоску металлического лития.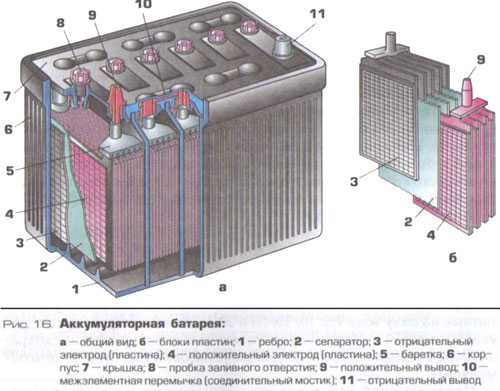 Катод будет… как вы уже догадались… серой (ну, смесью серы и углерода). Эта комбинация имеет очень хорошее потенциальное напряжение, и оба электрода будут легче, чем в обычных литий-ионных батареях, что делает плотность энергии батареи в пять раз выше.
Катод будет… как вы уже догадались… серой (ну, смесью серы и углерода). Эта комбинация имеет очень хорошее потенциальное напряжение, и оба электрода будут легче, чем в обычных литий-ионных батареях, что делает плотность энергии батареи в пять раз выше.
Реакция, происходящая во время разряда, включает окисление лития на аноде и образование сульфида лития. При этом высвобождаются электроны, обеспечивающие электрический ток. На катоде сера восстанавливается и также реагирует с литием, образуя последовательный ряд соединений с различным содержанием в них серы (полисульфиды).
$$\text{S}_8 \to \text{Li}_2\text{S}_8 \to \text{Li}_2\text{S}_6 \to \text{Li}_2\text{S }_4 \to \text{Li}_2\text{S}_2$$
Проблема в том, что эта батарейка не очень долговечна, так как серный катод не очень долгоживущий.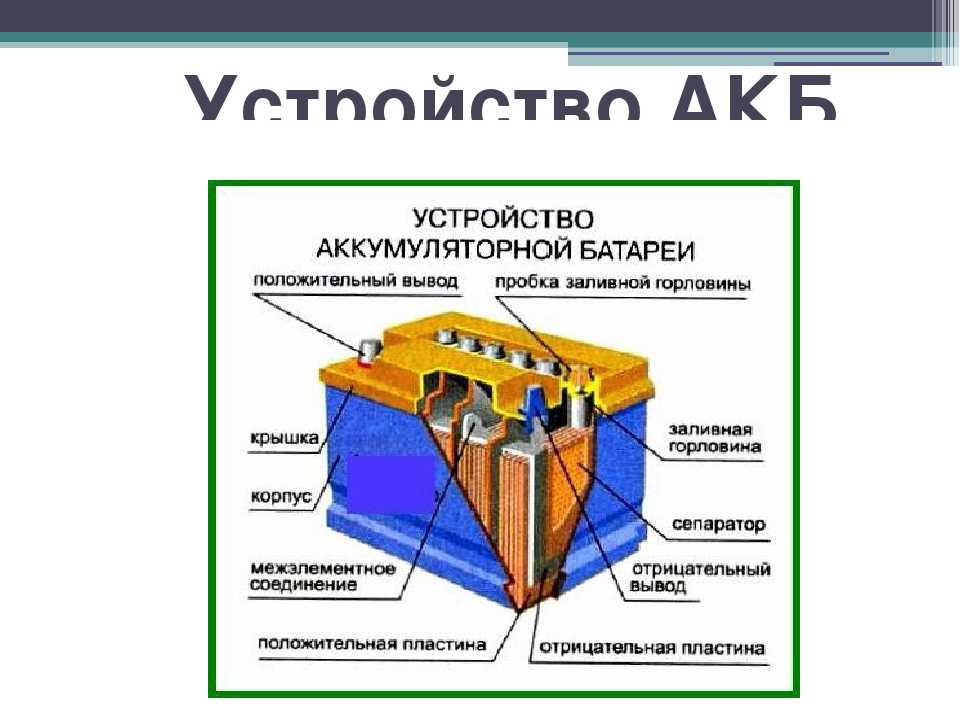 Многие полисульфиды легко растворяются в растворе электролита, а это означает, что во время каждого цикла разряда часть серы с катода безвозвратно теряется в растворе.
Многие полисульфиды легко растворяются в растворе электролита, а это означает, что во время каждого цикла разряда часть серы с катода безвозвратно теряется в растворе.
Другая проблема заключается в том, что по мере того, как литий реагирует с серой катода, объем образующегося соединения лития серы примерно на 80 процентов превышает объем серного катода до реакции. Это расширение вызывает разрушение катода.
Каким бы ни был их состав, батареи незаменимы в нашей повседневной жизни и останутся таковыми в будущем. Они будут иметь решающее значение для обеспечения непрерывного прогресса в портативных технологиях, позволяя совершенствовать и практичнее электромобили, а также обеспечивая то, что часто называют «недостающим звеном» возобновляемой энергии — способность накапливать избыточную электроэнергию, вырабатываемую ветром, солнцем и другими источниками энергии. источники для последующего использования.
Эта тема является частью нашей серии статей о батареях, состоящей из четырех частей. Для дальнейшего чтения узнайте, как работает аккумулятор, литий-ионные аккумуляторы и аккумуляторы будущего.
Для дальнейшего чтения узнайте, как работает аккумулятор, литий-ионные аккумуляторы и аккумуляторы будущего.Литий-ионные аккумуляторы — Curious
Эксперты-рецензенты
Доктор Ананд Бхатт
Руководитель исследовательской группы, Advanced Energy Storage Technologies
CSIRO
Профессор Рэй Уизерс FAA
Исследовательская школа химии
Австралийский национальный университет
Профессор Госю Ван
Директор Центра экологически чистых энергетических технологий
Технологический университет Сиднея
Основы
- Литий-ионные аккумуляторы повсеместно используются в нашей повседневной жизни — большинство из нас носит их с собой в телефоне.
- Существует несколько типов литий-ионных аккумуляторов. Основное различие между ними заключается в химическом составе катода.
- Разные типы литий-ионных аккумуляторов предлагают разные функции с компромиссом между стоимостью, эффективностью и безопасностью.

Наш лучший друг в наши дни — литий-ионный аккумулятор. Это тот, который питает наши мобильные телефоны и ноутбуки, устройства, которые внесли огромный вклад в изменение того, как мы работаем и взаимодействуем с нашими друзьями, коллегами, продавцами и даже незнакомцами. Потребляемая мощность наших смартфонов способна разрядить никель-кадмиевую или никель-металлгидридную батарею менее чем за час, но благодаря эффективности литий-ионной химии мы можем общаться с мамой, смотреть видео, отправлять сообщения друзьям, слушать музыку. под музыку, купить пару обуви в Интернете, получить инструкции по навигации и делать бесчисленное количество фотографий в течение всего дня.
Так что же такого особенного в литий-ионных батареях? Их главная фишка — плотность энергии — она примерно вдвое больше, чем у никель-кадмиевой батареи, а это означает, что батарея вдвое меньшего размера будет давать такое же количество энергии. Они легкие и компактные, а это значит, что они лучше подходят для таких вещей, как портативная электроника, чем тяжелые свинцово-кислотные батареи, которые заводят наши бензиновые автомобили. Сегодня литий-ионные аккумуляторы
Они легкие и компактные, а это значит, что они лучше подходят для таких вещей, как портативная электроника, чем тяжелые свинцово-кислотные батареи, которые заводят наши бензиновые автомобили. Сегодня литий-ионные аккумуляторы
Так что же такого в химическом составе литий-ионного элемента, что дает ему преимущество перед конкурентами?
Химия литий-ионных аккумуляторов
Как следует из названия, ионы лития (Li + ) участвуют в реакциях, приводящих в действие аккумулятор. Оба электрода в литий-ионном элементе изготовлены из материалов, которые могут интеркалировать или «поглощать» ионы лития (немного похоже на гидрид-ионы в NiMH батареях). Интеркаляция — это когда заряженные ионы элемента могут «удерживаться» внутри структуры материала-хозяина, не нарушая ее существенно. В случае литий-ионной батареи ионы лития «привязаны» к электрону внутри структуры анода. Когда батарея разряжается, интеркалированные ионы лития высвобождаются из анода, а затем проходят через раствор электролита, чтобы поглощаться (интеркалироваться) катодом.
Литий-ионный аккумулятор начинает свою жизнь в состоянии полного разряда: все его ионы лития интеркалированы внутри катода, а его химический состав еще не способен производить электричество. Прежде чем вы сможете использовать аккумулятор, его необходимо зарядить. Когда аккумулятор заряжается, на катоде происходит реакция окисления, а это означает, что он теряет часть отрицательно заряженных электронов. Для поддержания баланса зарядов на катоде в раствор электролита растворяют равное количество положительно заряженных интеркалированных ионов лития. Они перемещаются к аноду, где внедряются в графит. Эта реакция интеркаляции также откладывает электроны в графитовый анод, чтобы «связать» ион лития.
Показывать метки во время анимации Начать анимацию
Во время разряда ионы лития деинтеркалируются с анода и возвращаются через электролит к катоду. Это также высвобождает электроны, которые привязывали их к аноду, и они текут по внешнему проводу, обеспечивая электрический ток, который мы использовали для выполнения работы.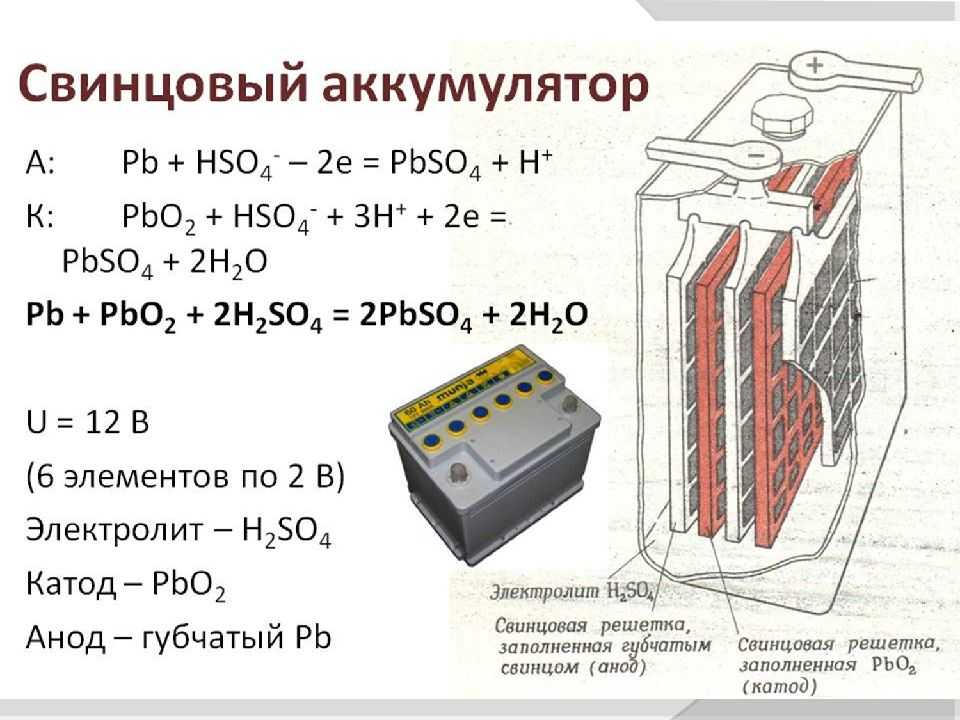 Именно соединение внешнего провода позволяет протекать реакции — когда электроны могут свободно перемещаться, то и положительно заряженные ионы лития уравновешивают движение своего отрицательного заряда.
Именно соединение внешнего провода позволяет протекать реакции — когда электроны могут свободно перемещаться, то и положительно заряженные ионы лития уравновешивают движение своего отрицательного заряда.
Когда катод заполняется ионами лития, реакция прекращается и батарея разряжается. Затем мы снова перезаряжаем наши литий-ионные батареи, и внешний электрический заряд, который мы прикладываем, выталкивает ионы лития обратно в анод от катода.
Показывать метки во время анимации Начать анимацию
Электролит в литий-ионном элементе обычно представляет собой раствор солей лития в смеси растворителей (таких как диметилкарбонат или диэтилкарбонат), разработанный для улучшения характеристик аккумулятора. Наличие солей лития, растворенных в электролите, означает, что раствор содержит ионы лития. Это означает, что отдельные ионы лития не должны совершать полный путь от анода к катоду, чтобы замкнуть цепь. По мере того как ионы выбиваются из анода, другие, которые уже находятся в электролите, вблизи поверхности электрода, могут легко поглощаться (интеркалироваться) катодом. Обратное происходит во время перезарядки.
Обратное происходит во время перезарядки.
Будучи маленьким и легким, большое количество лития может храниться (интеркалироваться) в обоих электродах. Именно это придает литий-ионным батареям высокую плотность энергии. Например, один ион лития может храниться на каждые шесть атомов углерода в графите, и чем больше ионов лития участвует в путешествии от анода к катоду (и обратно во время циклов перезарядки), тем больше электронов приходится на уравновешивают их движение и обеспечивают электрический ток.
Перенос ионов лития между электродами происходит при гораздо более высоком напряжении, чем в батареях других типов, и, поскольку они должны быть уравновешены равным количеством электронов, один литий-ионный элемент может создавать напряжение 3,6 вольта или выше. , в зависимости от материалов катода. Типичный щелочной элемент выдает всего около 1,5 вольт. Для стандартного свинцово-кислотного автомобильного аккумулятора требуется шесть 2-вольтовых элементов, соединенных вместе, чтобы получить 12 вольт.
Из-за их высокой плотности энергии и относительной легкости установка большого количества литий-ионных элементов вместе в одном месте позволяет получить аккумуляторную батарею намного легче и компактнее, чем стек, изготовленный из других типов батарей. Если мы сложим вместе достаточное количество литий-ионных элементов, мы сможем достичь довольно высокого напряжения, например, необходимого для запуска электромобиля. Конечно, во всех наших автомобилях уже есть аккумуляторы, но они нужны только для того, чтобы запустить бензиновый или дизельный двигатель, тогда всю работу делает топливо. Аккумулятор электромобиля — это его источник энергии и то, что дает ему возможность подняться на крутой холм. Таким образом, он обычно будет иметь 96 вольт или даже больше, что даже при высоком напряжении литий-ионного элемента требует довольно много элементов, сложенных вместе.
Объединение литий-ионных элементов вместе может создать напряжение, достаточное для работы электромобиля. Источник изображения: Хокан Дальстрём / Flickr.
Анод обычно графитовый. Однако многократное введение ионов лития в стандартную графитовую структуру типичной литий-ионной батареи в конечном итоге разрушает графит. Это снижает производительность батареи, и графитовый анод в конечном итоге сломается, и батарея перестанет работать. Исследователи работают над разработкой вариантов использования графена (листов углерода толщиной в один атом) вместо графита. Вы узнаете больше о графене и о том, чем он хорош, в следующей теме Nova.
Что касается материала, из которого изготавливается катод, существует довольно много вариантов — как правило, он состоит из комбинации лития, кислорода и какого-либо металла.
Катоды, используемые в литий-ионных батареях
Оксид лития-кобальта (LiCoO
2 ) Наиболее распространенные литий-ионные элементы имеют анод из углерода (C) и катод из оксида лития-кобальта (LiCoO 2 ). Фактически, литий-кобальт-оксидный аккумулятор был первым литий-ионным аккумулятором, который был разработан на основе новаторских работ Р. Язами и Дж. Гуденафа и продан Sony в 1919 г.91. Кобальт и кислород соединяются вместе, образуя слои октаэдрических структур оксида кобальта, разделенные листами лития. Важно, что эта структура позволяет ионам кобальта изменять свои валентные состояния между Co +3 и Co +4 (терять и приобретать отрицательно заряженный электрон) при зарядке и разрядке.
Язами и Дж. Гуденафа и продан Sony в 1919 г.91. Кобальт и кислород соединяются вместе, образуя слои октаэдрических структур оксида кобальта, разделенные листами лития. Важно, что эта структура позволяет ионам кобальта изменять свои валентные состояния между Co +3 и Co +4 (терять и приобретать отрицательно заряженный электрон) при зарядке и разрядке.
Из всех различных литий-ионных аккумуляторов эти ребята имеют наибольшую плотность энергии, поэтому в настоящее время они используются в наших телефонах, цифровых камерах и ноутбуках. Их недостатком является термическая нестабильность. Их аноды могут перегреваться, а при высоких температурах катод из оксида кобальта может разлагаться с образованием кислорода. Если вы объедините кислород и тепло, у вас есть довольно хорошие шансы начать пожар, и, поскольку химические вещества, иногда используемые в растворе электролита, такие как диэтилкарбонат, легко воспламеняются, с этой батареей могут возникнуть некоторые проблемы с безопасностью.
Литий-ионные аккумуляторы имеют встроенную защиту для предотвращения перегрева и полного разряда аккумулятора, что также может привести к повреждению. Кроме того, эти схемы защиты иногда можно использовать для предотвращения перезарядки литий-ионных аккумуляторов, что может иметь серьезные последствия. Литий-ионные батареи бывают самых разных форм и размеров, а некоторые из них содержат встроенные защитные устройства, такие как вентиляционные крышки, для повышения безопасности.
Фосфат лития железа (LiFePO
4 ) Этот элемент имеет высокую скорость разряда, а поскольку фосфат (PO 4 ) может выдерживать высокие температуры, батарея обладает хорошей термической стабильностью, что повышает ее безопасность. Это делает его хорошим выбором для таких вещей, как электромобили и электроинструменты, а также для хранения энергии на электростанциях. Он также имеет длительный срок службы, что означает, что его можно разряжать и заряжать много раз. Однако он имеет более низкую плотность энергии, чем элемент из оксида лития-кобальта, и более высокую скорость саморазряда.
Литий-железо-фосфатный элемент аналогичен литий-кобальтовому оксидному элементу. Анод по-прежнему графитовый, и электролит почти такой же. Разница в том, что катод из диоксида лития-кобальта был заменен более стабильным фосфатом лития-железа. Фактически, в катоде из фосфата железа (FePO4) полностью заряженного элемента не остается ионов лития или железа. Ионы лития могут внедряться в катодный материал или из него через четко определенные туннели в его структуре без значительного изменения каркаса из фосфата железа.
Катод этого типа элементов изготовлен из отрицательно заряженного фосфата
анионы ГЛОССАРИЙ анионы Отрицательно заряженные ионы, особенно ионы, которые мигрируют к аноду при электролизе , связанный с положительно заряженным железом
катионы ГЛОССАРИЙ катионы Положительно заряженные ионы, то есть те, которые будут притягиваться к катоду при электролизе в структуре, способной хранить ионы лития в молекулах фосфата железа. Расположение связей в этой структуре означает, что атомы кислорода прочно связаны в структуру, что придает катоду его химическую стабильность.
Расположение связей в этой структуре означает, что атомы кислорода прочно связаны в структуру, что придает катоду его химическую стабильность.
Литий-оксид марганца (LiMn
2 O 4 )В этом типе литиевых батарей используется катод из литий-марганцевой шпинели (Li + Mn 3+ Mn 9010 6+ 9015 4+ ). Шпинель — это тип минерала с характерной структурой AB 2 O 4 . Структура шпинели обладает очень хорошей термической стабильностью, повышая безопасность батареи. Это также способствует ионному потоку внутри электролита и уменьшает внутреннее сопротивление, которое со временем способствует потере мощности батареи.
Несмотря на то, что литиевые батареи этого типа обеспечивают высокую скорость разрядки и перезарядки (в том числе благодаря шпинельной структуре катода), они имеют меньшую емкость и более короткий срок службы.
Окись лития, никеля, марганца и кобальта (LiNiMnCoO
2 или NMC) Добавление никеля и кобальта обратно в смесь снова немного меняет ситуацию.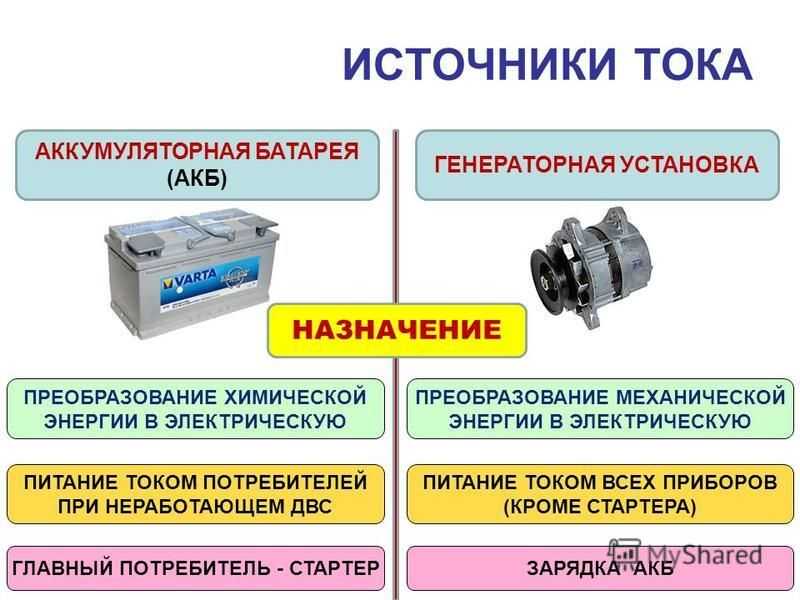 Никель обеспечивает высокую удельную энергию и при добавлении к стабильной структуре марганцевой шпинели также приводит к получению батареи с преимуществами структуры марганцевой шпинели (низкое внутреннее сопротивление, высокая скорость зарядки, хорошая стабильность и безопасность).
Никель обеспечивает высокую удельную энергию и при добавлении к стабильной структуре марганцевой шпинели также приводит к получению батареи с преимуществами структуры марганцевой шпинели (низкое внутреннее сопротивление, высокая скорость зарядки, хорошая стабильность и безопасность).
Катод этих батарей обычно состоит из одной трети никеля, одной трети марганца и одной трети кобальта, но соотношение может варьироваться в зависимости от секретных формул производителей. Эти аккумуляторы используются в электроинструментах, электромобилях и медицинских приборах.
Литий-марганцевые батареи часто сочетаются с литий-никель-марганцево-кобальтовыми батареями, образуя комбинацию, которая используется во многих электромобилях. Высокие всплески энергии (для быстрого ускорения) обеспечиваются литий-марганцевым компонентом, а большой запас хода обеспечивается компонентом литий-никель-марганец-кобальт.
Литий-полимерный
Замена жидкого электролита в литий-ионном аккумуляторе твердым электролитом повышает безопасность аккумулятора и делает его легче. Поскольку сам полимер очень тонкий, он также обеспечивает большую гибкость с точки зрения формы и дизайна — его не нужно помещать в жесткий корпус, и его можно сделать чрезвычайно компактным.
Поскольку сам полимер очень тонкий, он также обеспечивает большую гибкость с точки зрения формы и дизайна — его не нужно помещать в жесткий корпус, и его можно сделать чрезвычайно компактным.
Полимерный электролит представляет собой непроводящий материал, который, тем не менее, допускает ионный обмен. В ранних конструкциях полимер был настолько плохим проводником, что не мог способствовать ионному обмену, если только не был нагрет примерно до 60 градусов по Цельсию, поэтому теперь добавляют небольшое количество геля, чтобы избежать этой проблемы.
Литий-полимерный аккумулятор может использовать любую комбинацию электродов, используемую в литий-ионных аккумуляторах; отличается просто электролит.
Точно так же, как батареи в целом бывают разных форм, размеров и химических составов, литий-ионные батареи тоже бывают. Их различные химические вещества и структуры предлагают различные функции, часто с компромиссом между эффективностью, стоимостью и безопасностью.
Литий-ионные аккумуляторы необходимы нам в повседневной жизни.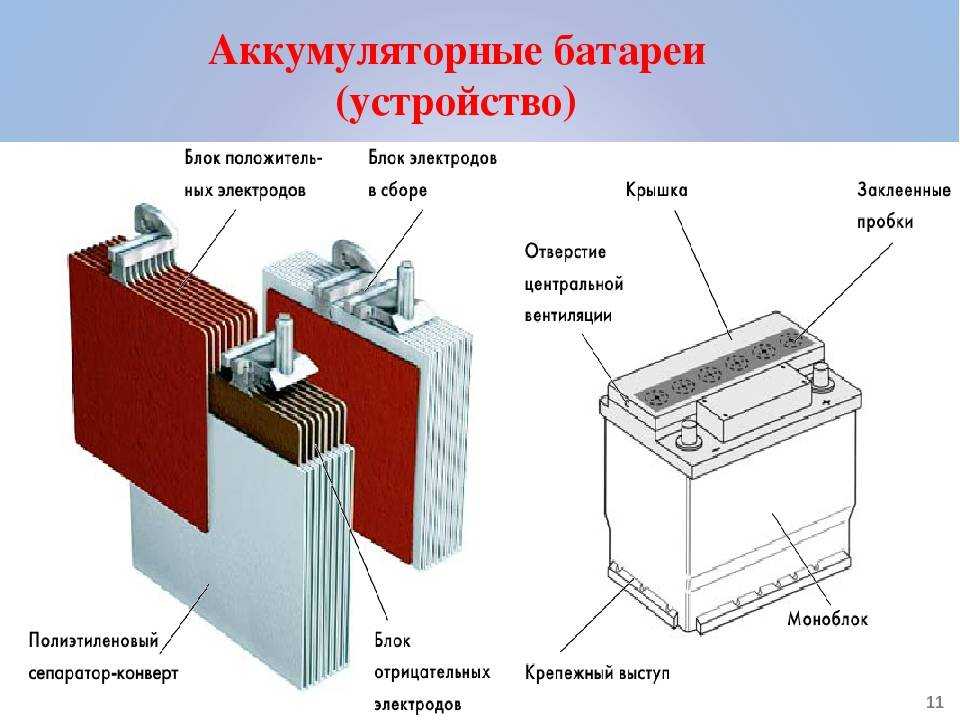

 9 — 4.5
9 — 4.5