Коррозия. Виды и способы защиты от коррозии
Коррозия материалов является одной из важных мировых проблем. Практика показывает, что только прямые безвозвратные потери металла от коррозии составляют 10…12% всей производимой стали, при этом суммарный ущерб в промышленных странах достигает 4-5% от национального дохода. Ведь корродирует не только черный металл ( сталь, чугун, железо и некоторые его сплавы ), но и бетон, дерево, камень, даже полимеры. Наиболее интенсивная коррозия наблюдается в зданиях и сооружениях химических производств, что объясняется действием различных газов, жидкостей и мелкодисперсных частиц непосредственно на строительные конструкции, оборудование и сооружения, а также проникновением этих агентов в грунты и действием их на фундаменты. Агрессивному воздействию подвержено до 75% строительного фонда. Коррозия металла приводит к ослаблению конструктива и, как следствие, снижению безопасности эксплуатации сооружений.

Коррозия – процесс разрушения материалов вследствие химических или электрохимических процессов. По характеру самого процесса коррозию разделяют на две основные группы : химическую и электрохимическую. Химическая коррозия протекает в не электролитах – жидкостях, не проводящих электрического тока и в сухих газах при высокой температуре. Электрохимическая коррозия происходит в электролитах и во влажных газах и характеризуется наличием двух параллельно идущих процессов: окислительного (растворение металлов) и восстановительного (выделение металла из раствора).
По внешнему виду коррозию различают: пятнами, язвами, точками, внутрикристаллитную, подповерхностную. По характеру коррозионной среды различают следующие основные виды коррозии: газовую, атмосферную, жидкостную и почвенную.
Газовая коррозия происходит при отсутствии конденсации влаги на поверхности. На практике такой вид коррозии встречается при эксплуатации металлов при повышенных температурах.
Атмосферная коррозия относится к наиболее распространенному виду электрохимической коррозии, так как большинство металлических конструкций эксплуатируются в атмосферных условиях. Коррозия, протекающая в условиях любого влажного газа, также может быть отнесена к атмосферной коррозии.
Жидкостная коррозия в зависимости от жидкой среды бывает кислотная, щелочная, солевая, морская и речная. По условиям воздействия жидкости на поверхность металла эти виды коррозии получают добавочные характеристики : с полным и переменным погружением, капельная, струйная. Кроме того, по характеру разрушения различают коррозию равномерную и неравномерную.
По степени воздействия на металлы коррозионные среды делятся на неагрессивные, слабоагрессивные, среднеагрессивные и сильноагрессивные.
Бетон и железобетон находят широкое применение в качестве конструкционного материала при строительстве зданий и сооружений химических производств. Но они не обладают достаточной химической стойкостью против действия кислых сред. Свойства бетона и его стойкость в первую очередь зависит от химического состава
Коррозия бетона происходит тем интенсивнее, чем выше концентрация водных растворов кислот. При повышенных температурах агрессивной среды коррозия бетонов ускоряется. Несколько более высокой кислотостойкостью обладает бетон, изготовленный на глиноземистом цементе, из-за пониженного содержания оксида кальция. Кислотостойкость бетонов на цементах с повышенным содержанием оксида кальция в некоторой степени зависит от плотности бетона. При большей плотности бетона кислоты оказывают на него несколько меньшее воздействие из-за трудности проникновения агрессивной среды внутрь материала.
Щелочестойкость бетонов определяется главным образом химическим составом вяжущих, на которых они изготовлены, а также щелочестойкостью мелких и крупных заполнителей.
Увеличение срока службы строительных конструкций и оборудования достигается путем правильного выбора материала с учетом его стойкости к агрессивным средам, действующим в производственных условиях. Кроме того, необходимо принимать меры профилактического характера. К таким мерам относятся герметизация производственной аппаратуры и трубопроводов, хорошая вентиляция помещения, улавливание газообразных и пылевидных продуктов, выделяющихся в процессе производства; правильная эксплуатация различных сливных устройств, исключающая возможность проникновения в почву агрессивных веществ; применение гидроизолирующих устройств и др.
Непосредственная защита металлов от коррозии осуществляется нанесением на их поверхность неметаллических и металлических покрытий либо изменением химического состава металлов в поверхностных слоях: оксидированием, азотированием, фосфатированием.
Для защиты поверхностей от коррозии существуют разнообразные покрытия: лакокрасочные (антистатичные и армированные, полиуретановые, акриловые, порошковые эпоксидно – полиэфирные, органосиликатные и кремнийорганические), металлизационные с цинком, алюминием, медью и комбинациями этих металлов. Это краски, лаки, эмали, тонкодисперсные порошки, пленки. Лакокрасочные покрытия вследствие экономичности, удобства и простоты нанесения, хорошей стойкости к действию промышленных агрессивных газов нашли широкое применение для защиты металлических и железобетонных конструкций от коррозии. Защитные свойства лакокрасочного покрытия в значительной степени обуславливаются механическими и химическими свойствами, сцеплением пленки с защищаемой поверхностью.
Лакокрасочные материалы в зависимости от назначения и условий эксплуатации делятся на десять групп:
- А – покрытия стойкие на открытом воздухе;
- АН – то же, под навесом;
- П – то же, в помещении;
- Х – химически стойкие;
- Т – термостойкие;
- М – маслостойкие;
- В – водостойкие;
- ХК – кислотостойкие;
- ХЩ – щелочестойкие;
- Б – бензостойкие.
Наиболее распространены в промышленности покрытия металлические, неметаллические (органического и неорганического происхождения), а также покрытия, образованные в результате химической и электрохимической обработки металла.
Выбор вида покрытия зависит от условий, в которых используется защищаемое изделие (перепад температур, повышенная влажность, морская или пресная вода, щелочь, кислота, соли металлов, радиация, электроток и огонь), и технологичность возможностей формирования покрытия.
Наиболее часто применяемые способы защиты металлов:
- легирование;
- электрохимическая защита;
- покрытие металлами;
- защитные пленки.
Легирование – это введение в металл на стадии его производства определенного количества специальных добавок, например – хрома или марганца. Это придает сталям особые свойства, необходимые для использования в сложных условиях. Для возведения современных зданий, особенно повышенной этажности, необходима высококачественная атмосферостойкая легированная сталь, например, погодоустойчивая марка COR-TEN. Такой материал позволяет решить проблемы эксплуатации сооружений даже в экстремальных климатических условиях.
Одними из самых популярных и относительно недорогих мер защиты от коррозии сегодня являются методы, изменяющие химический состав металла в поверхностных слоях. Как правило, это электрохимические способы нанесения покрытий на металл. Наиболее известный процесс называется оцинковкой, которая в зависимости от способа обработки металла делится на горячую и холодную. В первом случае обрабатываемый материал погружается в специальную ванну. Затем под воздействием переменного тока осуществляется его обработка в растворе фосфата цинка при плотности тока 4 А/дм², напряжении 20 В и температуре 600-700ºС. В результате электрохимической реакции образуется ферроцинковый сплав. При применении второго способа на подготовленную поверхность стального листа наносится защитный слой из цинка. Оцинковка толщиной 0,3 мм позволяет обеспечить защиту обработанной поверхности металла более чем на 30 лет.
Итальянская фирма «Metalnastri» разработала метод, сочетающий в себе качество горячего и технологичность холодного цинкования. Это простая идея наклейки цинковой фольги на стальную поверхность. Высокую антикоррозийность создает сплошной цинковый слой, а токопроводящие клеевые композиции обеспечивают и электрохимическую защиту поверхности.
ЦНИИПСК им. А.П. Мельникова предложил метод термодиффузионного цинкования (ТДЦ) метизных и малогабаритных изделий из стали и чугуна. Метод заключается в нагреве металлоизделий в среде, содержащей порошок цинка. В результате на поверхности изделия образуется цинковое покрытие с хорошими защитными и декоративными свойствами. Технологический процесс такого цинкования экологически чист и практически безотходен. В качестве сырья используются отечественные материалы, не требующие специальной обработки. ТДЦпокрытие обладает высокой адгезией и износостойкостью, обеспечиваемой в результате взаимной диффузии железа и цинка. Срок службы покрытия в 1,5-4 раза больше по сравнению с традиционными цинковыми покрытия.
Широкое распространение цинковых покрытий обусловлено их хорошими химическими свойствами. Для стали (катод) цинк является анодом, за счет этого образуется гальваническая пара, имеющая высокие защитные свойства, хорошо сохраняемые даже при малой толщине слоя. Скорость разрушения цинкового покрытия составляет примерно 1-10 мкм в год в зависимости от различных факторов. Оцинковка может осуществляться совместно с другими металлами – с добавлением алюминия (Al) или железа (Fe). В настоящее время в России широко используется сталь Galfan c цинкоалюминиевым покрытием и сталь Galvannealed с цинкожелезным покрытием.
При покрытии другими металлами в зависимости от вида коррозии покрывающий слой наносят различными способами. В качестве покрывающего материала часто используется хром или никель. Хромирование – электролитическое нанесение покрытия из хрома на поверхность металлического изделия. Никелирование, также нанесение на поверхность изделий никеля толщиной от 2 до 50 мкм.
На практике обычно применяются следующие методы:
- Погружение изделий в расплавленный металл (горячий способ). Заключается в том, что изделия погружают в ванну с расплавленным металлом или же нагретую поверхность деталей обволакивают расплавленным металлом.
- Метод термической диффузии. Основан на диффузии (проникновении) в поверхностные слои деталей присадок при высокой температуре. Диффузионные покрытия наносятся при нагреве деталей в твердой (порошкообразной), жидкой или газообразной фазе металла.
- Металлизация. Заключается в нанесении (распылении) на поверхность деталей слоя присадок расплавленного металла с помощью пульверизаторов.
- Контактный метод осаждения металла. Осуществляется без применения внешнего источника тока за счет вытеснения менее благородными металлами более благородных из растворов их солей. Толщина таких покрытий невелика и защитные свойства их невысоки.
Следует отметить, что металлические покрытия достаточно хорошо защищают металл от коррозии. Однако при нарушении защитного слоя она может протекать даже более интенсивно, чем без покрытия. Поэтому в промышленности для улучшения свойств металлических поверхностей, обработанных электротехническим методом, используется способ нанесения защитных покрытий из полимерных материалов. Такие продукты получили широкое распространение в строительной индустрии. Использование полимерных материалов для антикоррозионной защиты обусловлено их уникальными физико-химическими показателями. Полимеры имеют небольшой удельный вес, высокую стойкость к не механическим воздействиям (соприкосновение с водой, солями, щелочами или кислотами). Обладают пластичностью и светостойкостью. В настоящее время наибольшее распространение получили « трехслойные» продукты с двойным уровнем защиты. Первый уровень – непосредственно оцинковка, второй – полимер. Благодаря такой структуре сталь становится стойкой к воздействию агрессивных сред, механическим повреждениям и ультрафиолетовому изучению. Срок их службы составляет порядка 50 лет, в зависимости от качества и толщины покрытия. Необходимо также учесть, что высокие эксплуатационные характеристики таких материалов напрямую зависят от качества оцинковки исходного металла, а потребительские качества – от применяемого в составе полимера.
Альтернативой полимерным материалам являются конструкционные пластмассы и стеклопластики, получаемые на основе различных синтетических смол и стекловолокнистых наполнителей. В настоящее время выпускается значительный ассортимент материалов, особое место среди них занимает полиэтилен. Он инертен во многих кислотах, щелочах и растворителях, а также имеет высокую теплостойкость.
Другим направлением использования полиэтилена в качестве химически стойкого материала является порошковое напыление. Применение полиэтиленовых покрытий объясняется их дешевизной и хорошими защитными свойствами. Покрытия легко наносятся на поверхность различными способами, в том числе пневматическим и электростатическим распылением.
Защитные пленки. Способ заключается в нанесении на металл защитной оболочки из различных компонентов в следующей последовательности: шпатлевка, грунтовка, краска, лак или эмаль.
Для противокоррозионной защиты конструкций зданий и сооружений (ферм, ригелей, балок, колонн, стеновых панелей), а также наружных и внутренних поверхностей емкостного технологического оборудования, трубопроводов, газоводов, воздуховодов вентиляционных систем, которые в процессе эксплуатации не подвергаются механическим воздействиям абразивных частиц, применяют лакокрасочные покрытия. Такие покрытия наиболее эффективны для защиты от атмосферной коррозии. Однако срок службы лакокрасочных покрытий невелик и составляет 4-5 лет. Для повышения коррозионной стойкости лакокрасочных покрытий используют различные противокоррозионные пигменты.
Следует назвать антикоррозионные пигменты фирмы SNCZ (Франция): фосфаты цинка; модифицированные фосфаты цинка; фосфаты, не содержащие цинк; полифосфаты; феррит кальция, а также тетраоксихромат цинка; хроматы стронция, цинка, бария.
Наиболее часто используются фосфаты цинка PZ 20 и PZ W2 в большинстве лакокрасочных систем: органоразбавляемых, водоразбавляемых, воздушной и горячей сушки.
Там, где нельзя использовать противокоррозионные пигменты, содержащие цинк (контакт с пищевыми продуктами), используются пигменты на основе щелочеземельных фосфатов Новинокс РАТ 30, Новинокс РАТ 15 и Новинокс РС01.
Металлоконструкции, подвергающиеся воздействию соляного тумана, могут быть защищены лакокрасочными материалами, содержащими фосфат щелочеземельных металлов. Фосфат щелочеземельных металлов – нетоксичный пигмент, что повышает экологичность лакокрасочного покрытия и увеличивает сферу его применения.
Тетраоксихромат цинка ТС 20, хромат стронция L203E и хромат цинка CZ20 – применяются в лакокрасочных материалах, использующихся в авиационных, судовых покрытиях, а также в составе адгезивов для легких сплавов.
Для защитных покрытий, эксплуатирующихся в условиях высоких температур (до 600ºС), используются хромат бария М 20 и феррит кальция FC 71. Применение феррита кальция для защитных покрытий – новое направление в лакокрасочных материалах. В табл. 1 представлена стойкость различных лакокрасочных материалов (ЛКМ) к агрессивным средам.
Таблица 1. Стойкость лакокрасочных материалов
| ЛКМ, по типу связующего | Стойкость к агрессивным средам | |||||||
| Вода | Водяной пар | Растворители | Разбавленные растворители | Кислоты | Разбавленные кислоты | Щелочи | Разбавленные щелочи | |
| Винилхлоридные | + | ++ | ± | ± | ± | + | ± | + |
| Хлоркаучуковые | + | ++ | ± | ± | ± | + | ± | + |
| Акриловые | ± | ++ | ± | ± | ± | + | ± | + |
| Алкидные | ± | + | ± | + | ± | ± | ± | ± |
| Битумные | ++ | ++ | ± | ± | ± | ± | ± | + |
| ПУ ароматические | ± | ++ | + | ++ | + | + | ± | ± |
| ПУ алифатические | + | ++ | ± | + | ± | + | ± | ++ |
| Эпоксиднополиуретановые | ++ | ++ | ± | ± | ± | + | + | ++ |
| Эпоксидные | ++ | ++ | + | ++ | ± | + | ++ | ++ |
| Цинк-силикатные | + | ++ | ++ | ++ | + | + | + | + |
| Перхлорвиниловые | ++ | ++ | ± | ± | ± | ± | ± | + |
Примечания: ++ отлично, + хорошо, ± удовлетворитльно
Наиболее распространенным способом защиты от коррозии строительных конструкций, сооружений и оборудования является использование неметаллических химически стойких материалов: кислотоупорной керамики, жидких резиновых смесей, листовых и пленочных полимерных материалов (винипласта, поливинилхлорида, полиэтилена, резины), лакокрасочных материалов, синтетических смол и др. Для правильного использования неметаллических химически стойких материалов необходимо знать не только их химическую стойкость, но и физико-химические свойства, обеспечивающие условия совместной работы покрытия и защищаемой поверхности. При использовании комбинированных защитных покрытий, состоящих из органического подслоя и футеровочного покрытия, важным является обеспечение на подслое температуры, не превышающей максимальной для данного вида подслоя.
Для листовых и пленочных полимерных материалов необходимо знать величину их адгезии с защищаемой поверхностью. Ряд неметаллических химически стойких материалов, широко используемых в противокоррозионной технике, содержит в своем составе агрессивные соединения, которые при непосредственном контакте с поверхностью металла или бетона могут вызвать образование побочных продуктов коррозии, что, в свою очередь, снизит величину их адгезии с защищаемой поверхностью. Эти особенности необходимо учитывать при использовании того или иного материала для создания надежного противокоррозионного покрытия.
Просмотров: 823
extxe.com
Защита от коррозии металла: катодная, анодная, покрытия
Металлы используются человеком с доисторических времен, изделия из них широко распространены в нашей жизни. Самым распространенным металлом является железо и его сплавы. К сожалению, они подвержены коррозии, или ржавлению — разрушению в результате окисления. Своевременная защита от коррозии позволяет продлить срок службы металлических изделий и конструкций.

 Защита от коррозии
Защита от коррозииВиды коррозии
Ученые давно борются с коррозией и выделили несколько основных ее типов:
- Атмосферная. Происходит окисление вследствие контакта с кислородом воздуха и содержащимися в нем водяными парами. Присутствие в воздухе загрязнений в виде химически активных веществ ускоряет ржавление.
- Жидкостная. Проходит в водной среде, соли, содержащиеся в воде, особенно морской, многократно ускоряют окисление.
- Почвенная. Этому виду подвержены изделия и конструкции, находящиеся в грунте. Химический состав грунта, грунтовые воды и токи утечки создают особую среду для развития химических процессов.
Исходя из того, в какой среде будет эксплуатироваться изделие, подбираются подходящие методы защиты от коррозии.
Характерные типы поражения ржавчиной
Различают следующие характерные виды поражения коррозией:
- Поверхность покрыта сплошным ржавым слоем или отдельными кусками.
- На детали возникли небольшие участки ржавчины, проникающей в толщину детали.
- В виде глубоких трещин.
- В сплаве окисляется один из компонентов.
- Глубинное проникновение по всему объему.
- Комбинированные.


Виды коррозионных разрушений
По причине возникновения разделяют также:
- Химическую. Химические реакции с активными веществами.
- Электрохимическую. При контакте с электролитическими растворами возникает электрический ток, под действием которого замещаются электроны металлов, и происходит разрушение кристаллической структуры с образованием ржавчины.
Коррозия металла и способы защиты от нее
Ученые и инженеры разработали множество способов защиты металлических конструкций от коррозии.
Защита от коррозии индустриальных и строительных конструкций, различных видов транспорта осуществляется промышленными способами.
Зачастую они достаточно сложные и дорогостоящие. Для защиты металлических изделий в условиях домовладений применяют бытовые методы, более доступные по цене и не связанные со сложными технологиями.
Промышленные
Промышленные методы защиты металлических изделий подразделяются на ряд направлений:
- Пассивация. При выплавке стали в ее состав добавляют легирующие присадки, такие, как Cr, Mo, Nb, Ni. Они способствуют образованию на поверхности детали прочной и химически стойкой пленки окислов, препятствующей доступу агрессивных газов и жидкостей к железу.
- Защитное металлическое покрытие. На поверхность изделия наносят тонкий слой другого металлического элемента — Zn , Al, Co и др. Этот слой защищает железо о т ржавления.
- Электрозащита. Рядом с защищаемой деталью размещают пластины из другого металлического элемента или сплава, так называемые аноды. Токи в электролите текут через эти пластины, а не через деталь. Так защищают подводные детали морского транспорта и буровых платформ.
- Ингибиторы. Специальные вещества, замедляющие или вовсе останавливающие химические реакции.
- Защитное лакокрасочное покрытие.
- Термообработка.


Порошковая покраска для защиты от коррозии
Способы защиты от коррозии, используемые в индустрии, весьма разнообразны. Выбор конкретного метода борьбы с коррозией зависит от условий эксплуатации защищаемой конструкции.
Бытовые
Бытовые методы защиты металлов от коррозии сводятся, как правило, к нанесению защитных лакокрасочных покрытий. Состав их может быть самый разнообразный, включая:
- силиконовые смолы;
- полимерные материалы;
- ингибиторы;
- мелкие металлические опилки.
Отдельной группой стоят преобразователи ржавчины — составы, которые наносят на уже затронутые коррозией конструкции. Они восстанавливают железо из окислов и предотвращают повторную коррозию. Преобразователи делятся на следующие виды:
- Грунты. Наносятся на зачищенную поверхность, обладают высокой адгезией. Содержат в своем составе ингибирующие вещества, позволяют экономить финишную краску.
- Стабилизаторы. Преобразуют оксиды железа в другие вещества.
- Преобразователи оксидов железа в соли.
- Масла и смолы, обволакивающие частички ржавчины и нейтрализующие ее.


Грунт-преобразователь ржавчины
При выборе грунта и краски лучше брать их от одного производителя. Так вы избежите проблем совместимости лакокрасочных материалов.
Защитные краски по металлу
По температурному режиму эксплуатации краски делятся на две большие группы:
- обычные, используемые при температурах до 80 °С;
- термостойкие.
По типу связующей основы краски бывают:
- алкидные;
- акриловые;
- эпоксидные.
Лакокрасочные покрытия по металлу имеют следующие достоинства:
- качественная защита поверхности от коррозии;
- легкость нанесения;
- быстрота высыхания;
- много разных цветов;
- долгий срок службы.
Большой популярностью пользуются молотковые эмали, не только защищающие метал, но и создающие эстетичный внешний вид. Для обработки металла распространена также краска-серебрянка. В ее состав добавлена алюминиевая пудра. Защита металла происходит за счет образования тонкой пленки окиси алюминия.


Краска-серебрянка
Эпоксидные смеси из двух компонентов отличаются исключительной прочностью покрытия и применяются для узлов, подверженных высоким нагрузкам.
Защита металла в бытовых условиях
Чтобы надежно защитить металлические изделия от коррозии, следует выполнить следующую последовательность действий:
- очистить поверхность от ржавчины и старой краски с помощью проволочной щетки или абразивной бумаги;
- обезжирить поверхность;
- сразу же нанести слой грунта;
- после высыхания грунта нанести два слоя основной краски.
При работе следует использовать средства индивидуальной защиты:
- перчатки;
- респиратор;
- очки или прозрачный щиток.
Способы защиты металлов от коррозии постоянно совершенствуются учеными и инженерами.
Методы противостояния коррозионным процессам
Основные методы, применяемые для противодействия коррозии, приведены ниже:
- повышение способности материалов противостоять окислению за счет изменения его химического состава;
- изоляция защищаемой поверхности от контакта с активными средами;
- снижение активности окружающей изделие среды;
- электрохимические.
Первые две группы способов применяются во время изготовления конструкции, а вторые – во время эксплуатации.
Методы повышения сопротивляемости
В состав сплава добавляют элементы, повышающие его коррозионную устойчивость. Такие стали называют нержавеющими. Они не требуют дополнительных покрытий и отличаются эстетичным внешним видом. В качестве добавок применяют никель, хром, медь, марганец, кобальт в определенных пропорциях.


Нержавеющая сталь AISI 304
Стойкость материалов к ржавлению повышают также, удаляя их состава ускоряющие коррозию компоненты, как, например, кислород и серу — из стальных сплавов, а железо – из магниевых и алюминиевых.
Снижение агрессивности внешней среды и электрохимическая защита
С целью подавления процессов окисления во внешнюю среду добавляют особые составы — ингибиторы. Они замедляют химические реакции в десятки и сотни раз.
Электрохимические способы сводятся к изменению электрохимического потенциала материала путем пропускания электрического тока. В результате коррозионные процессы сильно замедляются или даже вовсе прекращаются.
Пленочная защита
Защитная пленка препятствует доступу молекул активных веществ к молекулам металла и таким образом предотвращают коррозионные явления.
Пленки образуются из лакокрасочных материалов, пластмассы и смолы. Лакокрасочные покрытия недороги и удобны в нанесении. Ими покрывают изделие в несколько слоев. Под краску наносят слой грунта, улучшающего сцепление с поверхностью и позволяющего экономить более дорогую краску. Служат такие покрытия от 5 до 10 лет. В качестве грунта иногда применяют смесь фосфатов марганца и железа.
Защитные покрытия создают также из тонких слоев других металлов: цинка, хрома, никеля. Их наносят гальваническим способом.
Покрытие металлом с более высоким электрохимическим потенциалом, чем у основного материала, называется анодным. Оно продолжает защищать основной материал, отвлекая активные окислители на себя, даже в случае частичного разрушения. Покрытия с более низким потенциалом называют катодными. В случае нарушения такого покрытия оно ускоряет коррозию за счет электрохимических процессов.
Металлическое покрытие также можно наносить также методом распыления в струе плазмы.
Применяется также и совместный прокат нагретых до температуры пластичности листов основного и защищающего металла. Под давлением происходит взаимная диффузия молекул элементов в кристаллические решетки друг друга и образование биметаллического материала. Этот метод называют плакированием.
Если вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter.
stankiexpert.ru
Лекция 11. Коррозия металлов и методы защиты от коррозии
Химическая и электрохимическая коррозия. Способы защиты металлов от коррозии
Коррозией называется процесс самопроизвольного разрушения металлов под воздействием внешней среды. Все случаи коррозии принято делать на два вида: химическую и электрохимическую.
Химическая коррозия — это окисление металлов, не сопровождающееся возникновением электрического тока. Примером химической коррозии является образование окалины на железе при высокой температуре без участия электролитов,
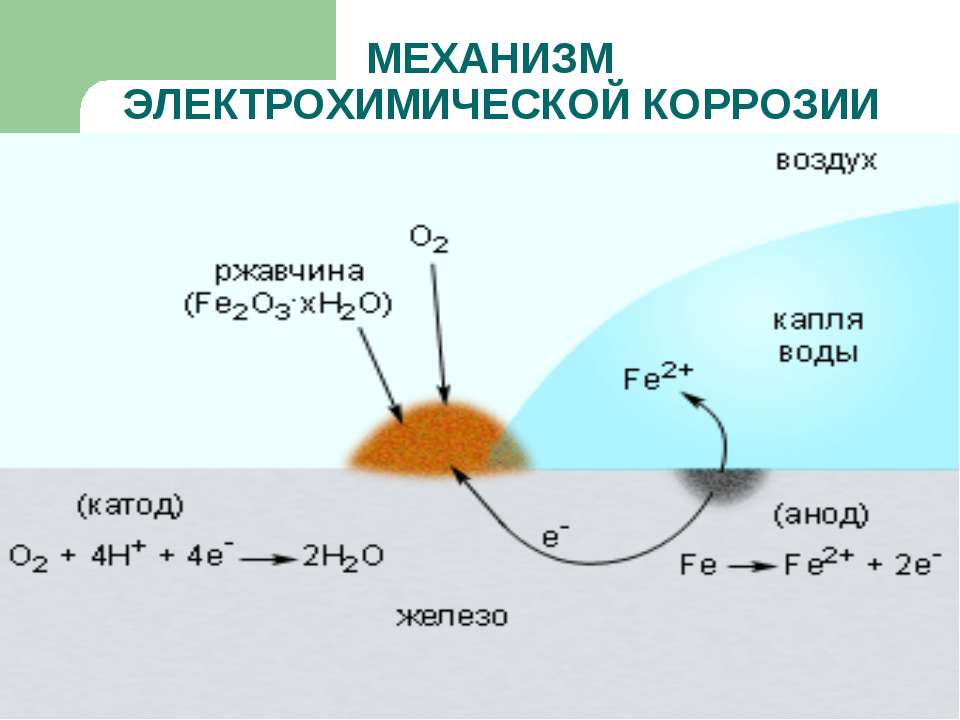
Электрохимическая коррозия — разрушение металла, обусловленное его окислением в среде электролита и сопровождающееся возникновением электрического тока в результате образования гальванического элемента, который в этом случае называют коррозионным гальваническим элементом. Работа коррозионного гальванического элемента обусловлена разностью потенциалов активного (анодного) участка и пассивного (катодного) участка. На анодных участках коррозионного гальванического элемента происходит окисление (растворение) основного металла
Анод: Me — Ze = Mez+ .
На катодных участках, в зависимости от состава-среды, может протекать восстановление кислорода, воды или ионов водорода, которые всегда содержатся в воде и растворах, соприкасающихся с воздухом.
Коррозия с участием кислорода называется коррозией с кислородной деполяризацией. Она описывается уравнениями:
Анодный процесс: Me — Ze = Mez+
Катодный процесс:
а) в кислой среде (рН < 7)
О2 + 4Н+ + 4ё=2Н2O;
б) в нейтральной и щелочной среде (рН > 7)
О2 + 2Н2О + 4e = 4OH.
Коррозия, сопровождающаяся выделением водорода на катоде, называется коррозией с водородной деполяризацией и описывается уравнениями:
Анодный процесс: Me — Z e = Mez+
Катодный процесс:
а) в кислой среде (рН < 7)
2Н+ + 2e = Н2↑;
б) в нейтральной и щелочной среде (рН ≥ 7)
2H2O + 2e = H2↑ + 2OH..
Таким образом, электрохимическая коррозия возможна при условии, когда электроны с анодных участков постоянно отводятся на катодные, а затем удаляются с них окислителем. Коррозионный гальванический элемент изображают следующим образом:
(A) MI| Н2О/Окислитель(О2 или Н+)| МII (примеси) (К).
Выделяемая иногда в отдельный вид грунтовая (почвенная) коррозия может быть сведена к одному из вышеперечисленных случаев.
Примеры решения задач
Пример 1. Хром находится в контакте с медью. Какой из металлов будет окисляться при коррозии, если эта пара металлов находится в кислой среде (НСl). Составьте схему образующегося при этом гальванического элемента. Какой процесс будет протекать на катоде?
Решение. Исходя из положения металлов в ряду напряжений, находим, что хром более активный металл: (φ0Cr2+/Cr = -0,74 В,φ0Cu2+/Cu = +0,34 В). В образующемся гальваническом элементе он будет выполнять роль анода, а медь — катода:
(А)Сr|Н2О/НС1|Сu(К).
Хромовый анод растворяется, а на медном катоде выделяется водород:
Анод:Сr-3е =Сr3+
Катод: 2Н2+ 2е =Н2↑
Пример 2. Какие процессы протекают при коррозии технического железа в атмосферных условиях?
Решение. Техническое железо содержит примеси углерода и некоторых металлов, которые, как правило, менее активны, чем железо, и выполняют роль катода в образующемся гальваническом элементе, основная масса железа является анодом. Адсорбированная на поверхности железа вода, с растворенными в ней кислородом и другими газами, образует пленку электролита.
Схема, образующегося гальванического элемента имеет вид
(A)Fe|H2O/O2|Me(K).
При работе гальванического элемента протекают процессы:
Анод:Fе-2е =Fe2+
Катод: 2Н2О + О2 + 4 e — 4ОH.
Вторичные процессы: Fe2+ +2ОH. = Fe(OH)2,
4Fe(OH)2 + О2 + Н2О = 4Fe(OH)3.
На скорость коррозии влияют как внутренние факторы (наличие дефектов кристаллической решетки металла, механические напряжения и др.), так и внешние: температура, природа и состав электролита. С повышением температуры скорость коррозии, как и большинства химических реакций, возрастает. Усиливают коррозию содержащаяся в атмосфере промышленных городов пыль, SO2, СO2 и другие газы. Поэтому в городах коррозия протекает в 5-10 раз быстрее, чем в сельской местности. Ионы Сl—, присутствующие в морской воде, являются катализаторами коррозии железа и его сплавов, так как адсорбируясь на поверхности металла, разрушают или препятствуют образованию на нем защитных слоев. Кроме того, скорость коррозии двух контактирующих металлов будет тем больше, чем больше разность потенциалов этих металлов. Полностью предотвратить процессы коррозии металлов практически не удается, однако существуют способы защиты металлов от коррозии.
1. Изменение коррозионной среды — этот метод пригоден для тех случаев, когда защищаемые изделия эксплуатируются в небольшом объеме. Суть метода состоит в удалении из электролита растворенного кислорода или добавлении к этому раствору веществ, замедляющих коррозию — ингибиторов.
2. Легирование металлов. Это введение в состав сплавов компонентов, повышающих химическую стойкость. Наибольшее применение находят нержавеющие стали, в состав которых входит хром (до 15 %) и никель (до 10 %). Кроме того, в качестве легирующих компонентов используют марганец, кремний, вольфрам, молибден, титан и другие металлы.
3. Неметаллические покрытия. Механически защищают металлы от коррозии, изолируя их от влияния внешней среды. Неметаллические покрытия делятся на неорганические и органические. Из неорганических покрытий наиболее распространены оксидные и фосфатные пленки. Так, при кипячении железа в растворе солей фосфорной кислоты (обычно солей Fe и Мn) получают фосфатные пленки, хорошо защищающие от коррозии в атмосфере. Среди органических, покрытий наиболее распространенными являются масляные краски, лаки, полимерные пленки. Лакокрасочные покрытия — самый дешевый метод защиты от коррозии.
4. Металлические покрытия. По характеру защитного действия различают анодные и катодные покрытия. Анодным является покрытие металлом, электродный потенциал которого меньше, чем у защищаемого металла. Покрытие из металла менее активного (с большим электродным потенциалом), чем защищаемый металл, называется катодным. Если покрытие не нарушено и полностью изолирует основной металл от воздействия окружающей среды, принципиального различия между анодными и катодными покрытиями нет. При нарушении слоя защищающего металла возникают коррозионные гальванические элементы, в которых защищаемый металл может играть роль или инертного катода, или активного анода. Так, при нарушении в атмосферных условиях алюминиевого покрытия на медном изделии (φ0Al3+/Al= -1,67 В, φ0 Cu2+/Cu = +0,34 В) возникает гальванический элемент (А)А1|Н2О/О2|Cu(К).
В этом элементе, покрывающий металл Аl является анодом, он разрушается (окисляется) и, растворяясь, защищает основной металл, несмотря на нарушение целостности покрывающего слоя:
Анод: Аl — 3 е = Аl3+
Катод: 2Н2О + О2 + 4 е = 4ОН.
Катодное же покрытие (например, свинцовое покрытие железа) в аналогичном случае перестает защищать основной металл и, создавая с ним гальванический элемент, усиливает своим присутствием его коррозию:
(А)Fе|Н2О/О2|Рb(К)
Анод: Fe — 2 e = Fe2+
Катод: Н2О + О2 + 4 е = 4ОН.
5. Электрохимическая защита:
а) катодная защита. Защищаемую конструкцию присоединяют к катоду внешнего источника тока, в результате она становится катодом, не окисляется, на ней идет восстановление компонентов среды. В качестве анода применяют любой металлический лом, ко-торый присоединяют к аноду внешнего источника тока. Таким способом защищают, например, подземные трубопроводы;
б) протекторная защита. Защищаемый металл соединяют с более активным металлом, имеющим меньший электродный потенциал. Последний служит анодом, растворяется и защищает основной металл. Так цинк является протектором для стального корпуса судна:
(А) Zn | Н2О/ О2| Fe (К)
Анод:Zn-2е =Zn2+
Катод: Н2О + О2 + 4e =4ОН.
Для более активной защиты металлических конструкций можно совмещать несколько способов защиты от коррозии, например, покрытие и катодную электрозащиту.
studfile.net
Коррозия металлов и способы защиты от неё
Коррозия – разрушение поверхности сталей и сплавов под воздействием различных физико-химических факторов – наносит огромный ущерб деталям и металлоконструкциям. Ежегодно этот невидимый враг «съедает» около 13 млн. т металла. Для сравнения – металлургическая промышленность стран Евросоюза в прошлом, 2014 году произвела всего на 0,5 млн. тонн больше. И это только – прямые потери. А длительная эксплуатация стальных изделий без их эффективной защиты от коррозии вообще невозможна.
Что такое коррозия и её разновидности
Основной причиной интенсивного окисления поверхности металлов (что и является основной причиной коррозии) являются:
- Повышенная влажность окружающей среды.
- Наличие блуждающих токов.
- Неблагоприятный состав атмосферы.
Соответственно этому различают химическую, трибохимическую и электрохимическую природу коррозии. Именно они в совокупности своего влияния и разрушают основную массу металла.
Химическая коррозия
Такой вид коррозии обусловлен активным окислением поверхности металла во влажной среде. Безусловным лидером тут является сталь (исключая нержавеющую). Железо, являясь основным компонентом стали, при взаимодействии с кислородом образует три вида окислов: FeO, Fe2O3 и Fe3O4. Основная неприятность заключается в том, что определённому диапазону внешних температур соответствует свой окисел, поэтому практическая защита стали от коррозии наблюдается только при температурах выше 10000С, когда толстая плёнка высокотемпературного оксида FeO сама начинает предохранять металл от последующего образования ржавчины. Это процесс называется воронением, и активно применяется в технике для защиты поверхности стальных изделий. Но это – частный случай, и таким способом активно защищать металл от коррозии в большинстве случаев невозможно.

Химическая коррозия активизируется при повышенных температурах. Склонность металлов к химическому окислению определяется значением их кислородного потенциала – способности к участию в окислительно-восстановительных реакциях. Сталь – ещё не самый худший вариант: интенсивнее её окисляются, в частности, свинец, кобальт, никель.
Электрохимическая коррозия
Эта разновидность коррозии более коварна: разрушение металла в данном случае происходит при совокупном влиянии воды и почвы на стальную поверхность (например, подземных трубопроводов). Влажный грунт, являясь слабощёлочной средой, способствует образованию и перемещению в почве блуждающих электрических токов. Они являются следствием ионизации частиц металла в кислородсодержащей среде, и инициирует перенос катионов металла с поверхности вовне. Борьба с такой коррозией усложняется труднодоступностью диагностирования состояния грунта в месте прокладки стальной коммуникации.
Электрохимическая коррозия возникает при окислении контактных устройств линий электропередач при увеличении зазоров между элементами электрической цепи. Помимо их разрушения, в данном случае резко увеличивается энергопотребление устройств.
Трибохимическая коррозия
Данному виду подвержены металлообрабатывающие инструменты, которые работают в режимах повышенных температур и давлений. Антикоррозионное покрытие резцов, пуансонов, фильер и пр. невозможно, поскольку от детали требуется высокая поверхностная твёрдость. Между тем, при скоростном резании, холодном прессовании и других энергоёмких процессах обработки металлов начинают происходить механохимические реакции, интенсивность которых возрастает с увеличением температуры на контактной поверхности «инструмент-заготовка». Образующаяся при этом окись железа Fe2O3 отличается повышенной твёрдостью, и поэтому начинает интенсивно разрушать поверхность инструмента.

Методы борьбы с коррозией
Выбор подходящего способа защиты поверхности от образования ржавчины определяется условиями, в которых работает данная деталь или конструкция. Наиболее эффективны следующие методы:
- Нанесение поверхностных атмосферостойких покрытий;
- Поверхностная металлизация;
- Легирование металла элементами, обладающими большей стойкостью к участию в окислительно-восстановительных реакциях;
- Изменение химического состава окружающей среды.
Механические поверхностные покрытия
Поверхностная защита металла может быть выполнена его окрашиванием либо нанесением поверхностных плёнок, по своему составу нейтральных к воздействию кислорода. В быту, а также при обработке сравнительно больших площадей (главным образом, подземных трубопроводов) применяется окраска. Среди наиболее стойких красок – эмали и краски, содержащие алюминий. В первом случае эффект достигается перекрытием доступа кислороду к стальной поверхности, а во втором – нанесением алюминия на поверхность, который, являясь химически инертным металлом, предохраняет сталь от коррозионного разрушения.
Положительными особенностями данного способа защиты являются лёгкость его реализации и сравнительно небольшие финансовые затраты, поскольку процесс достаточно просто механизируется. Вместе с тем долговечность такого способа защиты невелика, поскольку, не обладая большой степенью сродства с основным металлом, такие покрытия через некоторое время начинают механически разрушаться.

Химические поверхностные покрытия
Коррозионная защита в данном случае происходит вследствие образования на поверхности обрабатываемого металла химической плёнки, состоящей из компонентов, стойких к воздействию кислорода, давлений, температур и влажности. Например, углеродистые стали обрабатывают фосфатированием. Процесс может выполняться как в холодном, так и в горячем состоянии, и заключается в формировании на поверхности металла слоя из фосфатных солей марганца и цинка. Аналогом фосфатированию выступает оксалатирование – процесс обработки металла солями щавелевой кислоты. Применением именно таких технологий повышают стойкость металлов от трибохимической коррозии.
Недостатком данных методов является трудоёмкость и сложность их применения, требующая наличия специального оборудования. Кроме того, конечная поверхность изменяет свой цвет, что не всегда приемлемо по эстетическим соображениям.
Легирование и металлизация
В отличие от предыдущих способов, здесь конечным результатом является образование слоя металла, химически инертного к воздействию кислорода. К числу таких металлов относятся те, которые на линии кислородной активности находятся возможно дальше от водорода. По мере возрастания эффективности этот ряд выглядит так: хром→медь→цинк→серебро→алюминий→платина. Различие в технологиях получения таких антикоррозионных слоёв состоит в способе их нанесения. При металлизации на поверхность направляется ионизированный дуговой поток мелкодисперсного напыляемого металла, а легирование реализуется в процессе выплавки металла, как следствие протекания металлургических реакций между основным металлом и вводимыми легирующими добавками.

Изменение состава окружающей среды
В некоторых случаях существенного снижения коррозии удаётся добиться изменением состава атмосферы, в которой работает защищаемая металлоконструкция. Это может быть вакуумирование (для сравнительно небольших объектов), или работа в среде инертных газов (аргон, неон, ксенон). Данный метод весьма эффективен, однако требует дополнительного оборудования — защитных камер, костюмов для обслуживающего персонала и т.д. Используется он главным образом, в научно-исследовательских лабораториях и опытных производствах, где специально поддерживается необходимый микроклимат.
Кто нам мешает, тот нам поможет
В завершение укажем и на довольно необычный способ коррозионной защиты: с помощью самих окислов железа, точнее, одного из них — закиси-окиси Fe3O4. Данное вещество образуется при температурах 250…5000С и по своим механическим свойствам представляет собой высоковязкую технологическую смазку. Присутствуя на поверхности заготовки, Fe3O4 перекрывает доступ кислороду воздуха при полугорячей деформации металлов и сплавов, и тем самым блокирует процесс зарождения трибохимической коррозии. Это явление используется при скоростной высадке труднодеформируемых металлов и сплавов. Эффективность данного способа обусловлена тем, что при каждом технологическом цикле контактные поверхности обновляются, а потому стабильность процесса регулируется автоматически.
blastingservice.ru
основные методы и их особенности

 Одной из серьезных угроз для инструментов и конструкций, выполненных из металла, является коррозия. По этой причине большую актуальность приобретает проблема их защиты от столь неприятного процесса. При этом сегодня известно немало методов, которые позволяют достаточно эффективно решить эту проблему.
Одной из серьезных угроз для инструментов и конструкций, выполненных из металла, является коррозия. По этой причине большую актуальность приобретает проблема их защиты от столь неприятного процесса. При этом сегодня известно немало методов, которые позволяют достаточно эффективно решить эту проблему.Антикоррозионная защита — зачем она нужна
Коррозия представляет собой процесс, сопровождающийся разрушением поверхностных слоев конструкций из стали и чугуна, возникающий в результате электрохимического и химического воздействия. Негативным следствием этого становится серьезная порча металла, его разъедание, что не позволяет использовать его по назначению.
Экспертами было проведено достаточно доказательств тому, что ежегодно порядка 10% от общего объема добычи металла на планете уходит на устранение потерь, связанных с воздействием коррозии, из-за которой происходит расплавление металлов и полная потеря эксплуатационных свойств металлическими изделиями.
При первых признаках воздействия коррозии изделия из чугуна и стали становятся менее герметичными, прочными. В то же время ухудшаются такие качества, как теплопроводность, пластичность, отражательный потенциал и некоторые иные важные характеристики. В дальнейшем конструкции и вовсе нельзя применять по назначению.
Вдобавок к этому именно с коррозией связывают большинство производственных и бытовых аварий, а также и некоторые экологические катастрофы. Трубопроводы, используемые для транспортировки нефти и газа, имеющие значительные участки, покрытые ржавчиной, могут в любой момент лишиться своей герметичности, что может создать угрозу для здоровья людей и природы в результате прорыва подобных магистралей. Это дает понимание того, почему так важно предпринимать меры по защите конструкций из металла от коррозии, прибегая к помощи традиционных и новейших средств и методов.
К сожалению, пока не удалось создать такой технологии, которая бы смогла полностью защитить стальные сплавы и металлы от коррозии. При этом имеются возможности для задержания и уменьшения негативных последствий подобных процессов. Эта задача решается посредством использования большого количества антикоррозионных средств и технологий.
Предлагаемые сегодня методы борьбы с коррозией могут быть представлены в виде следующих групп:
- Использование электрохимических методов защиты конструкций;
- Создание защитных покрытий;
- Разработка и производство новейших конструкционных материалов, демонстрирующих высокую стойкость к коррозионным процессам;
- Добавление в коррозионную среду особых соединений, благодаря которым можно замедлить распространение ржавчины;
- Грамотный подход к выбору подходящих деталей и конструкций из металлов для сферы строительства.
Защита изделий из металла от коррозии
Обеспечить способность защитного покрытия выполнять поставленные перед ним задачи можно за счет целого ряда специальных свойств:
-

 Устойчивость к износу и высокий уровень твердости;
Устойчивость к износу и высокий уровень твердости; - Повышенные характеристики прочности сцепления с поверхностью обрабатываемого изделия;
- Наличие коэффициента теплового расширения, предусматривающего незначительное отклонение от расширения защищаемой конструкции;
- Высокий уровень защиты от негативного воздействия со стороны вредных факторов внешней среды.
Создавать подобные покрытия следует тем расчетом, чтобы они располагались на всей площади конструкции в виде максимально равномерного и сплошного слоя.
Доступные сегодня защитные покрытия для металла могут быть классифицированы на следующие типы:
- металлические и неметаллические;
- органические и неорганические.
Подобные покрытия получили широкое распространение во многих странах. Поэтому им будет уделено особое внимание.
Борьба с коррозией при помощи органических покрытий

 Чаще всего для защиты металлов от коррозии прибегают к такому эффективному методу, как использование лакокрасочных составов. Этот метод на протяжении многих лет демонстрирует высокую эффективность и несложность в плане реализации.
Чаще всего для защиты металлов от коррозии прибегают к такому эффективному методу, как использование лакокрасочных составов. Этот метод на протяжении многих лет демонстрирует высокую эффективность и несложность в плане реализации.Использование подобных соединений в борьбе против ржавчины предусматривает достаточно преимуществ, среди которых простота и доступная цена не являются единственными:
- Используемые покрытия могут придавать обрабатываемому изделию различный цвет, в результате это позволяет не только надежно защитить изделие от ржавчины, но и обеспечить конструкциям более эстетичный внешний вид;
- Отсутствие сложностей с реставрацией защитного слоя в случае его повреждения.
Увы, однако у лакокрасочных составов имеются и определенные недостатки, к числу которых нужно отнести следующие:
- низкий коэффициент термической стойкости;
- низкая устойчивость в водной среде;
- низкая стойкость к воздействию механического характера.
Это вынуждает, чему не противоречат требования действующих СНиП, прибегать к их помощи в ситуации, когда изделия подвергаются воздействию со стороны коррозии с максимальной скоростью 0,05 мм в год, при этом расчетный срок службы не должен превышать 10 лет.
Ассортимент предлагаемых сегодня на рынке лакокрасочных составов может быть представлен в виде следующих элементов:
-

 Краски. Под ними подразумеваются суспензии пигментов, характеризующихся минеральной структурой;
Краски. Под ними подразумеваются суспензии пигментов, характеризующихся минеральной структурой; - Лаки. Представлены в виде растворов и масел, присутствующих в растворителях органического происхождения. При их использовании эффект достигается лишь по завершении полимеризации смолы или масла или же в момент испарения, вызванного воздействием дополнительных катализаторов или же нагревом;
- Пленкообразователи. Речь идет о природных и искусственных соединениях. Среди них наибольшую известность получила олифа, которую используют в целях защиты конструкций из стали и чугуна;
- Эмали. Имеют вид лаковых растворов, содержащих группу подобранных пигментов в измельченном виде;
- смягчители и разнообразные пластификаторы. Сюда следует отнести адипиновую кислоту, представленную в виде эфира, дибутилфтолат, касторовое масло, трикрезилфосфат, каучук, а также иные элементы, благодаря которым можно повысить эластичность защитного слоя;
- этилацетат, толуол, бензин, спирт, ксилол, ацетон и другие. К помощи перечисленных компонентов прибегают для улучшения адгезии используемых лакокрасочных составов;
- Инертные наполнители. Представлены в виде мельчайших частиц асбеста, талька, мела и каолина. Благодаря их применению пленки приобретают повышенную устойчивость к коррозии, при этом удается добиться уменьшения расхода иных компонентов лакокрасочных покрытий;
- Пигменты и краски;
- Катализаторы, которые в среде специалистов именуются как сиккативы. Их польза заключается в сокращении времени, необходимого для высыхания защитных составов. Наибольшее распространение получили кобальтовые и магниевые соли жирных органических кислот.
При выборе того или иного лакокрасочного состава следует обращать внимание на условия эксплуатации обрабатываемых конструкций из металла. Применять материалы на основе эпоксидных элементов желательно для тех изделий, которые будут эксплуатироваться в атмосферах, содержащих испарения хлороформа, двухвалентного хлора, а также для обработки изделий, которые планируется использовать в разных типах кислот.
Высокую стойкость к кислотам демонстрируют и лакокрасочные материалы, содержащие полихлорвинил. Вдобавок к этому к ним прибегают в целях обеспечения защиты металла, который будет контактировать с маслами и щелочами. Если же возникает задача в обеспечении защиты конструкций, которые будут взаимодействовать с газами, то обычно выбор останавливают на материалах, содержащих полимеры.
Решая вопрос с предпочтительным вариантом защитного слоя, следует обращать внимания на требования отечественных СНиП, предусмотренных для конкретной отрасли промышленности. Подобные саннормы содержат перечень таких материалов и способов защиты от коррозии, к которым допускается прибегать, а также те, которые не следует применять. Скажем, если обратиться к СНиПу 3.04.03-85, то там представлены рекомендации по защите строительных сооружений различного назначения:
- систем трубопроводов, используемых для транспортировки газа и нефти;
- обсадных стальных труб;
- тепломагистралей;
- конструкций, выполненных из стали и железобетона.
Обработка неметаллическими неорганическими покрытиями

 Метод электрохимической или химической обработки позволяет создавать на изделиях из металла особые пленки, не допускающие негативное воздействие со стороны коррозии. Обычно для этой цели применяются фосфатные и оксидные пленки, при создании которых учитываются требования СНиП, поскольку подобные соединения отличаются по механизму защиты для различных конструкций.
Метод электрохимической или химической обработки позволяет создавать на изделиях из металла особые пленки, не допускающие негативное воздействие со стороны коррозии. Обычно для этой цели применяются фосфатные и оксидные пленки, при создании которых учитываются требования СНиП, поскольку подобные соединения отличаются по механизму защиты для различных конструкций.Фосфатные пленки
Останавливать выбор на фосфатных пленках рекомендуется, если необходимо обеспечить защиту от коррозии изделий из цветных и черных металлов. Если обратиться к технологии подобного процесса, то он сводится к помещению изделий в раствор цинка, железа или марганца в виде смеси с кислыми фосфорными солями, которые предварительно нагреты до отметки 97 градусов. Создаваемая пленка представляется отличной основой, чтобы в дальнейшем можно было покрыть ее лакокрасочным составом.
Важным моментом является то, что долговечность фосфатного слоя находится на довольно низком уровне. Также он обладает и другими недостатками — низкой эластичностью и прочностью. К фосфатированию прибегают в целях обеспечения защиты деталей, эксплуатация которых проходит в условиях высоких температур или соленой водной среды.
Оксидные пленки
Свою сферу применения имеют и оксидные защитные пленки. Они создаются при воздействии на металлы растворами щелочей посредством использования тока. Довольно часто для оксидирования применяют такой раствор, как едкий натр. Среди специалистов процесс создания оксидного слоя часто именуется воронением. Это обусловлено созданием на поверхности мало и высокоуглеродистых сталей пленки, имеющей привлекательный черный цвет.
Способ оксидирования является востребованным в тех случаях, когда возникает задача по сохранению изначальных геометрических размеров. Чаще всего защитное покрытие подобного типа создается на точных приборах и стрелковом вооружении. Обычно пленка имеет толщину не более 1,5 микрона.
Дополнительные способы
Существуют и другие способы защиты от коррозии, которые основываются на использовании неорганических покрытий:
-

 Пассивирование. Суть его сводится к помещению обрабатываемого изделия из металла в растворы нитратов или хроматов.
Пассивирование. Суть его сводится к помещению обрабатываемого изделия из металла в растворы нитратов или хроматов. - Анодирование. Для этого метода применяют специальные ванны, для приготовления которых используют щавелевую кислоту (5-10%), хромовый ангидрид (3%) и серную кислоту (190 грамм на литр раствора).
- Эмалирование. В основе этого метода лежит использование сочетания компонентов, представленных сплавленным полевым шпатом, цинком, мелом, песком, титаном и иными веществами.
Заключение
У каждого инструмента и конструкции, которая выполнена из стали, имеется ограниченный срок службы. При этом не всегда изделие может демонстрировать его в том виде, который заложен изначально производителем. Этому могут помешать различные негативные факторы, в том числе и коррозия. В целях защиты от неё приходится прибегать к различным методам и средствам.
Учитывая всю важность процедуры по защите от коррозии, необходимо правильно подобрать метод, а для этого важно учитывать не только условия эксплуатации изделий, но и их изначальные свойства. Подобный подход позволит обеспечить надежную защиту от ржавчины, в результате изделие сможет гораздо дольше использоваться по своему прямому назначению.
Оцените статью: Поделитесь с друзьями!stanok.guru
Коррозия металлов.Способы защиты от коррозии — Мегаобучалка
Коррозия – самопроизвольный процесс и соответственно протекающий с уменьшением энергии Гиббса системы. Химическая энергия реакции коррозионного разрушения металлов выделяется в виде теплоты и рассеивается в окружающем пространстве.
Коррозия приводит к большим потерям в результате разрушения трубопроводов, цистерн, металлических частей машин, корпусов судов, морских сооружений и т. п. Безвозвратные потери металлов от коррозии составляют 15 % от ежегодного их выпуска. Цель борьбы с коррозией – это сохранение ресурсов металлов, мировые запасы которых ограничены. Изучение коррозиии разработка методов защиты металлов от нее представляют теоретический интерес и имеют большое народнохозяйственное значение.
Ржавление железа на воздухе, образование окалины при высокой температуре, растворение металлов в кислотах – типичные примеры коррозии. В результате коррозии многие свойства металлов ухудшаются: уменьшается прочность и пластичность, возрастает трение между движущимися деталями машин, нарушаются размеры деталей. Различают химическую и электрохимическую коррозию.
Химическая, коррозия – разрушение металлов путем их окисления в сухих газах, в растворах неэлектролитов. Например, образование окалины на железе при высокой температуре. В этом случае образующиеся на металле оксидные плёнки часто препятствуют дальнейшему окислению, предотвращая дальнейшее проникновение к поверхности металла как газов, так и жидкостей.
Электрохимической коррозией называют разрушение металлов под действием возникающих гальванических пар в присутствии воды или другого электролита. В этом случае наряду с химическим процессом – отдача электронов металлами, протекает и электрический процесс – перенос электронов от одного участка к другому.
Этот вид коррозии подразделяют на отдельные виды: атмосферную, почвенную, коррозию под действием «блуждающего» тока и др.
Электрохимическую коррозию вызывают примеси, содержащиеся в металле, или неоднородность его поверхности. В этих случаях при соприкосновении металла с электролитом, которым может быть и влага, адсорбируемая на воздухе, на его поверхности возникает множество микрогальванических элементов. Анодами являются частицы металла, катодами – примеси и участки металла, имеющие более положительный электродный потенциал. Анод растворяется, а на катоде выделяется водород. В то же время на катоде возможен процесс восстановления кислорода, растворённого в электролите. Следовательно, характер катодного процесса будет зависеть от некоторых условий:
кислая среда: 2Н+ + 2ē = Н2 (водородная деполяризация),
О2 + 4Н+ + 4ē → 2Н2О
нейтральная среда: O2+2H2O+4e − =4OH− (кислородная деполяризация).
В качестве примера рассмотрим атмосферную коррозию железа в контакте с оловом. Взаимодействие металлов с каплей воды, содержащей кислород, приводит к возникновению микрогальванического элемента, схема которого имеет вид
(-)Fe|Fe2+|| O2, H2O| Sn (+).
Более активный металл (Fе) окисляется, отдавая электроны атомам меди и переходит в раствор в виде ионов (Fe2+). На катоде протекает кислородная деполяризация.
Способы защиты от коррозии. Все методы защиты от коррозии можно условно разделить на две большие группы: неэлектрохимические (легирование металлов, защитные покрытия, изменение свойств коррозионной среды, рациональное конструирование изделий) и электрохимические (метод проектов, катодная защита, анодная защита).
Легирование металлов – это эффективный, хотя и дорогой метод повышения коррозионной стойкости металлов, при котором в состав сплава вводят компоненты, вызывающие пассивацию металла. В качестве таких компонентов применяют хром, никель, титан, вольфрам и др.
Защитные покрытия – это слои, искусственно создаваемые на поверхности металлических изделий и сооружений. Выбор вида покрытия за- висит от условий, в которых используется металл.
Материалами для металлических защитных покрытий могут быть чистые металлы: цинк, кадмий, алюминий, никель, медь, олово, хром, серебро и их сплавы: бронза, латунь и т. д. По характеру поведения металлических покрытий при коррозии их можно разделить на катодные (например, на стали Cu, Ni, Ag) и анодные (цинк на стали). Катодные покрытия могут защищать металл от коррозии лишь при отсутствии пор и повреждений покрытия. В случае анодного покрытия защищаемый металл играет роль катода и поэтому не корродирует. Но потенциалы металлов зависят от состава растворов, поэтому при изменении состава раствора может меняться и характер покрытия. Так, покрытие стали оловом в растворе H2SO4 – катодное, а в растворе органических кислот – анодное.
Неметаллические защитные покрытия могут быть как неорганическими, так и органическими. Защитное действие таких покрытий сводится в основном к изоляции металла от окружающей среды.
Электрохимический метод защиты основан на торможении анодных или катодных реакций коррозионного процесса. Электрохимическая защита осуществляется присоединением к защищаемой конструкции (корпус судна, подземный трубопровод), находящейся в среде электролита (морская, почвенная вода), металла с более отрицательным значением электродного потенциала – протектора.
megaobuchalka.ru
Методы защиты металлов от коррозии
Потери железа вследствие ржавления достигают 20% от его ежегодного производства. Поэтому в технике широко используют различные меры защиты металлов, позволяющие свести коррозию к минимуму. Выбор метода защиты зависит от эффективности и экономической целесообразности.
Для защиты металлов от коррозии применяют следующие методы:
1. Легирование – введение добавок, повышающих коррозийную стойкость металлов. Например, при введении в состав стали до 12% хрома получают нержавеющую сталь, устойчивую к коррозии. Добавление цветных металлов – кобальта, никеля, меди усиливает антикоррозийные свойства стали, поскольку повышается склонность сплава к пассивации.
2. Обработка коррозийной среды – уменьшение содержания деполяризатора, нейтрализация кислых сред, удаление из воды кислорода (деаэрация), ее проводят на станциях водоочистки. Для этого воду пропускают через слой железной стружки, которая поглощает кислород из воды. В теплотехнике проводят обессоливание воды, так как соли – активаторы коррозии – значительно ускоряют коррозийный процесс. Для замедления коррозии металла в электролит вводят вещества, которые называются ингибиторами. К неорганическим ингибиторам относятся хроматы цинка и свинца, из органических ингибиторов используется уротропин, адипиновая кислота, бензонат натрия и др. Ингибиторы широко используются при химической очистке от накипи паровых котлов, а так же при хранении и перевозке кислот в стальной таре. Сравнительно недавно разработаны летучие (атмосферные) ингибиторы. Их применяют для пропитки бумаги, которой обертывают металлические изделия. Пары ингибитора адсорбируются на поверхности металла и образуют на ней защитную пленку.
3. Изоляция металлов от окружающей среды – различного рода покрытия. Покрытия бывают неметаллические, металлические, химические.
В качестве неметаллических покрытий используют самые разнообразные материалы: лаки, краски, эмали, битум, резину, синтетические смолы, полимерные материалы и т.п. Необходимым условием эффективности этого метода является чистота поверхности металла и отсутствие на ней влаги перед обработкой.
Химические покрытия получают путем химической или электрохимической обработки поверхности металла.
Например, оксидирование – обработка поверхности металла раствором кислот, щелочей, различных окислителей и восстановителей. Металл после такой обработки становится «пассивным», т.е. не подвергается коррозии и даже не растворяется в кислотах. Вещества, способствующие возникновению на поверхности металла защитной пленки обычно называют пассивирующими агентами (конц. HNO3, K2Cr2O7, NaNO2 и др.).
Фосфатирование – химическая обработка металлической поверхности, приводящая к образованию труднорастворимых фосфатов, которые характеризуются высокой степенью сцепления (адгезии) с основным металлом и хорошо защищает его от коррозии.
Из металлических покрытий широко распространены хромирование, никелирование, лужение, цинкование, серебрение, золочение. Металлические покрытия подразделяются на анодные и катодные.
Анодные покрытия изготавливают из металлов, имеющих меньшие значения электродных потенциалов, чем защищаемый металл.
Например, в случае оцинкованного железа (рисунок 3.1) поверхность железа (3) покрыта слоем цинка (2). До тех пор, пока целостность покрытия не нарушена, поверхность цинка изолирует основной металл (железо) от окружающей среды. Однако как только на цинковой поверхности образуется трещина, царапина или другое механическое повреждение, то кислота (1) входит в контакт с металлами, начинает работать микрогальванический элемент, в котором функцию анода выполняет цинк (Е° = — 0,763 В), а функцию катода – железо (Е° = — 0,440 В).
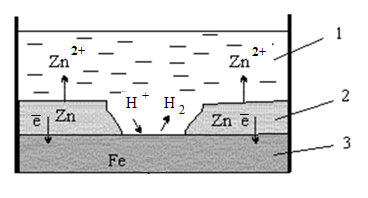
Рисунок 3.1. Схема разрушения оцинкованного железа в кислой среде
Составим схему и работу этого микрогальванического элемента в кислой
среде:
А (–) Zn | HСl | Fe (+) K A(–): Zn – 2ē = Zn2+ – окисление K(+): 2Н+ + 2ē = Н2 – восстановление Zn + 2Cl— = ZnCl2 |
В этом случае разрушается слой покрытия, а стальная деталь не корродирует.
Подбирая анодные покрытия, необходимо учитывать то обстоятельство, что наиболее эффективно «работают» в роли анодных покрытий те металлы, электродные потенциалы которых максимально отличаются от электродных потенциалов основного металла (другими словами, металл-покрытие и основной металл должны стоять в таблице стандартных электродных потенциалов (см. приложение В) как можно дальше друг от друга).
Разновидностью анодной защиты является протекторная защита (см. рисунок 3.2). В переводе с латинского protector – защитник, покровитель. В этом методе к защищаемой металлической детали (3) припаивают или присоединяют металлическим проводником (2) пластины из более активного металла (1). При этом создается гальванопара, анодом которой является более активный металл, т.е. протектор. В качестве протекторов используют магний, алюминий, магниево-алюминиевые сплавы, цинк (его активность не столь высока, но он имеет низкую стоимость).
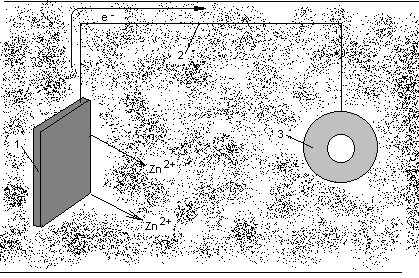
Рисунок 3.2 Схема протекторной защиты.
Металлы, применяемые для изготовления катодных покрытий, имеют больший электродный потенциал, чем защищаемый металл. Например: в случае луженого железа (белая жесть) железо (Е° = — 0,440 В), покрыто оловом (Е° = — 0,136 В).
Защитная роль катодного покрытия существенно отличается от действия анодных покрытий. На первой стадии (до нарушения целостности покрытия) особых различий нет, но как только возникают условия для работы гальванического элемента (оба металла вступают в контакт с агрессивной средой), функцию анода берет на себя основной металл, т.к. его потенциал имеет меньшее значение. В этих условиях коррозийному разрушению подвергается основной металл, а металл покрытия этому разрушению способствует, поляризуясь катодно.
Рассмотрим, как протекает процесс коррозии железа (3), находящегося в контакте с медью (2), во влажном воздухе (3) при нарушении покрытия (см. рисунок 3.3).
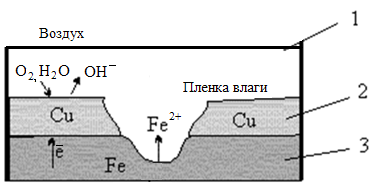
Рисунок 3.3 Схема атмосферной коррозии железа, находящегося в контакте с медью
А (–) Fe | H2O, O2 | Cu (+) K A(–): Fe0 – 2ē = Fe2+ K(+): 2Н2О + О20 + 4ē = 4ОН— 2Fe + O2 + 2H2O = 2Fe(OH)2 При дальнейшем окислении железа получим: 4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3 |
Катодное покрытие защищает основной металл от разрушения только при отсутствии повреждений на поверхности покрытия.
Для катодных покрытий целесообразно подбирать те металлы, электродные потенциалы которых в наименьшей степени отличаются от электродного потенциала основного металла (т.е. в таблице стандартных электродных потенциалов (см. приложение В) эти металлы должны находиться как можно ближе друг к другу).
4. Электрохимический метод защиты – катодная защита (метод внешнего потенциала). В этом методе (см. рисунок 3.4) защищаемое изделие (1) подключают к отрицательному полюсу внешнего источника постоянного тока (2), поэтому оно становится катодом, а анодом служит металлолом (3).
Например, защищаемая железная конструкция и вспомогательный (стальной) электрод образуют электрохимическую схему в воде:

Рисунок 3.4. Схема катодной электрозащиты.
А (–) Fe | H2O | Fe (+) K
A(–): Fe0 – 2ē = Fe2+
K(+): 2Н2О + 2ē = H20 + 2ОН—
Fe + 2H2O = H2 + Fe(OH)2
При дальнейшем окислении железа:
4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3
Вспомогательный электрод разрушается и его периодически заменяют новым, а на защищаемой конструкции (катоде) восстанавливается среда (в данном случае – вода), получая электроны не от металла, а от источника тока.
С явлением «коррозия» мы встречаемся постоянно, поскольку изделия из металлов встречаются повсюду: автомобили, самолеты, мосты, станки, водопроводные трубы, железобетонные конструкции, предметы домашнего обихода и др. Борьба с коррозией в настоящее время приобрела особое значение, т. к. в промышленности и в технике применяют высокие температуры и давление, различные агрессивные среды – растворы кислот, солей, щелочей.
Коррозия наносит не только прямой ущерб – разрушение металла, но и косвенный – это связано с выходом из строя различных приборов, машин, металлоконструкций, которые являются более ценными, чем сам металл. Например, при коррозийном разрушении поршней автомобильного двигателя или шасси приводит к тому, что автомобиль теряет свое предназначение. Иногда коррозия приводит к авариям, например, в котельных установках могут происходить взрывы котлов.
Эффективность борьбы с коррозией основана на понимании механизма коррозийных процессов и должна решаться комплексным подходом – применением комбинированных методов защиты с учетом эффективности действия каждого из них в данных конкретных условиях.
studfile.net
