Технические характеристики Лада Гранта 2023
Двигатель
90 л.с
Привод
Передний
Цвет:
Белый «Белое облако»
Черный «Пантера»
Красный «Сердолик», металлик
Ярко-синий «Голубая планета», металлик
Серебристый «Рислинг», металлик
Серебристо-серый «Техно», металлик
Серебристо-темно-серый «Борнео», металлик
Золотисто-коричневый «Кориандр», металлик
Специальная цена
на
от 385 470 ₽
* спецпредложение до
Телефон *
Основные размеры Лада Гранта
- Длина
- 4268 см
- Клиренс
- 160 см
- Ширина
- 1700 см
- Масса
- 1075 кг
- Высота
- 1500 см
- Объём багажника
- 520 л.
Комплектации и цены Lada Granta
Модификации Лада Гранта: Двигатель, КПП, привод
Выберите модификацию для сравнения характеристик:
1. 6 5MT (90 л.с.)
6 5MT (90 л.с.)
Характеристики
1.6 5MT (90 л.с.) | |
|---|---|
| Двигатель и трансмиссия | |
| Тип двигателя: | Бензиновый |
| Рабочий объём: | 1596 см³ |
| Рекомендуемое топливо: | АИ-95 |
| Количество цилиндров: | 4 |
| КПП: | Механическая |
| Топливный бак: | 50 л |
| Динамика | |
| Мощность двигателя | 90 л. при 5100 об/мин |
| Крутящий момент: | 140 Н∙м при 3800 об/мин |
| Разгон до 100 км/ч: | 11.6 сек |
| Максимальная скорость: | 172 км/ч |
| Расход топлива | |
| Расход в городском цикле: | 9.1 л на 100 км |
| Расход в загородном цикле: | 5.3 л на 100 км |
| Расход в смешанном цикле: | 6. 8 л на 100 км 8 л на 100 км |
| Подвеска и тормозная система | |
| Передняя подвеска: | Независимая, типа Макферсон, пружинная, с газонаполненными телескопическими амортизаторами, со стабилизатором поперечной устойчивости |
| Задняя подвеска: | Полузависимая, рычажная, пружинная, с газонаполненными телескопическими амортизаторами |
| Передние тормоза: | Дисковые |
| Задние тормоза: | Барабанные |
| Габариты и масса | |
| Длина: | 4268 мм |
| Ширина: | 1700 мм |
| Высота: | 1500 мм |
| Колесная база: | 2476 мм |
| Клиренс: | 160 мм |
| Объем багажника: | 520 л |
| Снаряженная масса: | 1075 кг |
| Грузоподъемность: | — |
Другие автомобили
Lada
Granta
от 385 470 ₽
Lada
Niva Legend 5dv
от 602 010 ₽
Lada
Niva Legend 3dv
от 553 010 ₽
Lada
Niva Travelот 674 010 ₽
Lada
Granta Drive Active
от 503 910 ₽
Lada
Granta Cross
от 443 070 ₽
Lada
Vesta Sport
от 1 213 110 ₽
Lada
Granta Универсал
от 409 770 ₽
Lada
Granta Хэтчбек
от 475 650 ₽
Lada
Vesta CNG
от 960 210 ₽
Lada
Largus Фургон
от 888 210 ₽
Lada
Largus Cross
от 1 074 510 ₽
Lada
Granta Лифтбек
от 403 470 ₽
Lada
Niva Bronto
от 0 ₽
Lada
Largus
от 945 810 ₽
Lada
Vesta
от 784 710 ₽
Lada
Vesta SW
от 867 510 ₽
Vesta Cross
от 917 910 ₽
Lada
Vesta SW Cross
от 971 010 ₽
LADA Granta 2022 — Размер шин и дисков, PCD, вылет, диаметр ЦО
Размер шин и дисков, вылет (ET), сверловка (PCD), диаметр ЦО, варианты замены колес на LADA Granta 2022
Модификации:
1. 6i (89 л.с.)
6i (89 л.с.)
1.6i 16V AT (97 л.с.)
1.6i 16V MT (105 л.с.)
LADA Granta 2190x Facelift 2022 1.6i
- Поколение: 2190x Facelift
- Регионы продажи: EUDM, RUS
- Мощность: 89 л.с.
- Диаметр Ц/О: 58.6 мм
- Тип крепежа: Болт
- Резьба: M12x1.25
| Размер шины | Размер диска | Сверловка |
| 175/65R14 | 5.5Jx14 ET35 | 4×98 |
| 185/60R14 | 5.5Jx14 ET35 | 4×98 |
| 185/60R14 | 6Jx14 ET35 | 4×98 |
| 185/55R15 | 6Jx15 ET35 | 4×98 |
| 195/50R15 | 6Jx15 ET35 | 4×98 |
LADA Granta 2190x Facelift 2022 1. 6i 16V AT
6i 16V AT
- Поколение: 2190x Facelift
- Регионы продажи: EUDM, RUS
- Мощность: 97 л.с.
- Диаметр Ц/О: 58.6 мм
- Тип крепежа: Болт
- Резьба: M12x1.25
| Размер шины | Размер диска | Сверловка |
| 175/65R14 | 5.5Jx14 ET35 | 4×98 |
| 185/60R14 | 5.5Jx14 ET35 | 4×98 |
| 185/55R15 | 6Jx15 ET35 | 4×98 |
| 185/60R14 | 6Jx14 ET35 | 4×98 |
| 195/50R15 | 6Jx15 ET35 | 4×98 |
LADA Granta 2190x Facelift 2022 1.6i 16V MT
- Поколение: 2190x Facelift
- Регионы продажи: EUDM, RUS
- Мощность: 105 л.
 с.
с. - Диаметр Ц/О: 58.6 мм
- Тип крепежа: Болт
- Резьба: M12x1.25
| Размер шины | Размер диска | Сверловка |
| 175/65R14 | 5.5Jx14 ET35 | 4×98 |
| 185/60R14 | 5.5Jx14 ET35 | 4×98 |
| 185/55R15 | 6Jx15 ET35 | 4×98 |
| 195/50R15 | 6Jx15 ET35 | 4×98 |
| 195/45R16 | 6.5Jx16 ET33 | 4×98 |
Конформационная гетерогенность и интерпретация данных FRET для размеров несвернутых белков
1. Харан Г. Как, когда и почему белки разрушаются: связь со складкой. Курс. мнение Структура биол. 2012; 22:14–20. [Бесплатная статья PMC] [PubMed] [Google Scholar]
2. Шулер Б., Хофманн Х. Спектроскопия одиночных молекул динамики сворачивания белка — расширение масштабов и временных масштабов. Курс. мнение Структура биол. 2013; 23:36–47. [PubMed] [Google Scholar]
Шулер Б., Хофманн Х. Спектроскопия одиночных молекул динамики сворачивания белка — расширение масштабов и временных масштабов. Курс. мнение Структура биол. 2013; 23:36–47. [PubMed] [Google Scholar]
3. Gelman H., Gruebele M. Кинетика сворачивания быстрых белков. Q. Преподобный Биофиз. 2014;47:95–142. [Бесплатная статья PMC] [PubMed] [Google Scholar]
4. Джуэтт М.Ф., Терри Д.С., Бланшар С.К. Светлое будущее флуоресцентной визуализации одиночных молекул. Курс. мнение хим. биол. 2014;20:103–111. [Статья бесплатно PMC] [PubMed] [Google Scholar]
5. Elbaum-Garfinkle S., Cobb G., Rhoades E. Мутанты тау связывают гетеродимеры тубулина с повышенной аффинностью. проц. Натл. акад. науч. США. 2014;111:6311–6316. [Бесплатная статья PMC] [PubMed] [Google Scholar]
6. Banerjee P.R., Deniz A.A. Проливая свет на ландшафты укладки белков с помощью флуоресценции одиночных молекул. хим. соц. 2014; 43:1172–1188. [Бесплатная статья PMC] [PubMed] [Google Scholar]
7. Кениг И. , Заррине-Афсар А., Шулер Б. Одномолекулярная спектроскопия конформационной динамики белков в живых эукариотических клетках. Нац. Методы. 2015; 12: 773–779. [PubMed] [Google Scholar]
, Заррине-Афсар А., Шулер Б. Одномолекулярная спектроскопия конформационной динамики белков в живых эукариотических клетках. Нац. Методы. 2015; 12: 773–779. [PubMed] [Google Scholar]
8. Мело А.М., Кораор Дж., Роудс Э. Функциональная роль внутренних нарушений в тау-тубулиновом комплексе. проц. Натл. акад. науч. США. 2016;113:14336–14341. [Статья бесплатно PMC] [PubMed] [Google Scholar]
9. Шулер Б., Соранно А., Неттелс Д. Спектроскопия FRET одиночных молекул и физика полимеров развернутых и внутренне неупорядоченных белков. Анну. Преподобный Биофиз. 2016;45:207–231. [PubMed] [Академия Google]
10. Уверский В.Н., Олдфилд С.Дж., Дункер А.К. Внутренне неупорядоченные белки при заболеваниях человека: введение концепции D 2 . Анну. Преподобный Биофиз. 2008; 37: 215–246. [PubMed] [Google Scholar]
11. Томпа П. Внутренне неупорядоченные белки: итоги 10-летнего периода. Тенденции биохим. науч. 2012; 37: 509–516. [PubMed] [Google Scholar]
12. Форман-Кей Дж. Д., Миттаг Т. От последовательности и сил к структуре, функции и эволюции внутренне неупорядоченных белков. Состав. 2013;21:1492–1499. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Д., Миттаг Т. От последовательности и сил к структуре, функции и эволюции внутренне неупорядоченных белков. Состав. 2013;21:1492–1499. [Бесплатная статья PMC] [PubMed] [Google Scholar]
13. Liu Z., Huang Y. Преимущества неупорядоченных белков. Белковая наука. 2014; 23: 539–550. [Бесплатная статья PMC] [PubMed] [Google Scholar]
14. Chen T., Song J., Chan H.S. Теоретические перспективы ненативных взаимодействий и внутреннего беспорядка в сворачивании и связывании белков. Курс. мнение Структура биол. 2015;30:32–42. [PubMed] [Google Scholar]
15. Дас Р.К., Руфф К.М., Паппу Р.В. Связывание информации, закодированной последовательностью, с формой и функцией внутренне неупорядоченных белков. Курс. мнение Структура биол. 2015; 32:102–112. [Бесплатная статья PMC] [PubMed] [Google Scholar]
16. Шерман Э., Харан Г. Переход клубок-глобула в денатурированном состоянии небольшого белка. проц. Натл. акад. науч. США. 2006; 103:11539–11543. [Бесплатная статья PMC] [PubMed] [Google Scholar]
17. Мерчант К. А., Бест Р. Б., Итон В. А. Характеристика развернутых состояний белков с использованием спектроскопии FRET одиночных молекул и молекулярного моделирования. проц. Натл. акад. науч. США. 2007; 104:1528–1533. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Мерчант К. А., Бест Р. Б., Итон В. А. Характеристика развернутых состояний белков с использованием спектроскопии FRET одиночных молекул и молекулярного моделирования. проц. Натл. акад. науч. США. 2007; 104:1528–1533. [Бесплатная статья PMC] [PubMed] [Google Scholar]
18. Mazouchi A., Zhang Z., Gradinaru C.C. Конформации метастабильного домена Sh4, характеризуемые smFRET и моделью полимера с исключенным объемом. Биофиз. Дж. 2016; 110:1510–1522. [Бесплатная статья PMC] [PubMed] [Google Scholar]
19. Мюллер-Спет С., Соранно А., Шулер Б. С обложки: взаимодействие зарядов может доминировать в размерах внутренне неупорядоченных белков. проц. Натл. акад. науч. США. 2010;107:14609–14614. [Бесплатная статья PMC] [PubMed] [Google Scholar]
20. Liu B., Chia D., Gradinaru C.C. Влияние внутрицепочечного электростатического отталкивания на конформационные нарушения и динамику белка Sic1. Дж. Физ. хим. Б. 2014; 118:4088–4097. [PubMed] [Google Scholar]
21. Сонг Дж., Гомес Г. -Н., Чан Х.С. Адекватный учет исключенного объема необходим, чтобы сделать вывод о компактности и асферичности неупорядоченных белков с помощью резонансного переноса энергии Фёрстера. Дж. Физ. хим. Б. 2015; 119: 15191–15202. [PubMed] [Google Scholar]
-Н., Чан Х.С. Адекватный учет исключенного объема необходим, чтобы сделать вывод о компактности и асферичности неупорядоченных белков с помощью резонансного переноса энергии Фёрстера. Дж. Физ. хим. Б. 2015; 119: 15191–15202. [PubMed] [Google Scholar]
22. Гомес Г.-Н., Градинару С.С. Взгляд на конформации и динамику внутренне неупорядоченных белков с использованием флуоресценции одиночных молекул. Биохим. Биофиз. Акта. 2017 С1570-9639(17)30129-2. [PubMed] [Google Scholar]
23. Хуан Ф., Ин Л., Фершт А.Р. Прямое наблюдение ограниченной барьером укладки BBL с помощью резонансной передачи энергии флуоресценции одной молекулы. проц. Натл. акад. науч. США. 2009;106:16239–16244. [Бесплатная статья PMC] [PubMed] [Google Scholar]
24. Лю Дж., Кампос Л.А., Муньос В. Изучение одностадийного свертывания белков в одиночных молекулах. проц. Натл. акад. науч. США. 2012; 109: 179–184. [Бесплатная статья PMC] [PubMed] [Google Scholar]
25. Чан Х.С., Чжан З., Лю З. Кооперативность, локально-нелокальная связь и неродные взаимодействия: принципы сворачивания белков на основе крупнозернистых моделей. Анну. Преподобный физ. хим. 2011;62:301–326. [PubMed] [Google Scholar]
Анну. Преподобный физ. хим. 2011;62:301–326. [PubMed] [Google Scholar]
26. Skinner J.J., Yu W., Sosnick T.R. Сравнительный анализ моделирования всех атомов с использованием водородного обмена. проц. Натл. акад. науч. США. 2014;111:15975–15980. [Бесплатная статья PMC] [PubMed] [Google Scholar]
27. Ли М., Лю З. Размеры, энергетика и денатурирующие эффекты неструктурированного состояния белка. Белковая наука. 2016; 25:734–747. [Бесплатная статья PMC] [PubMed] [Google Scholar]
28. Чанг Х.С., Итон В.А. Флуоресцентные зонды одиночной молекулы исследуют динамику пересечения барьера. Природа. 2013; 502: 685–688. [Бесплатная статья PMC] [PubMed] [Google Scholar]
29. Zhang Z., Chan H.S. Пути перехода, диффузионные процессы и предравновесия фолдинга белков. проц. Натл. акад. науч. США. 2012;109: 20919–20924. [Бесплатная статья PMC] [PubMed] [Google Scholar]
30. Борг М., Миттаг Т., Чан Х.С. Полиэлектростатические взаимодействия неупорядоченных лигандов предполагают физическую основу сверхчувствительности.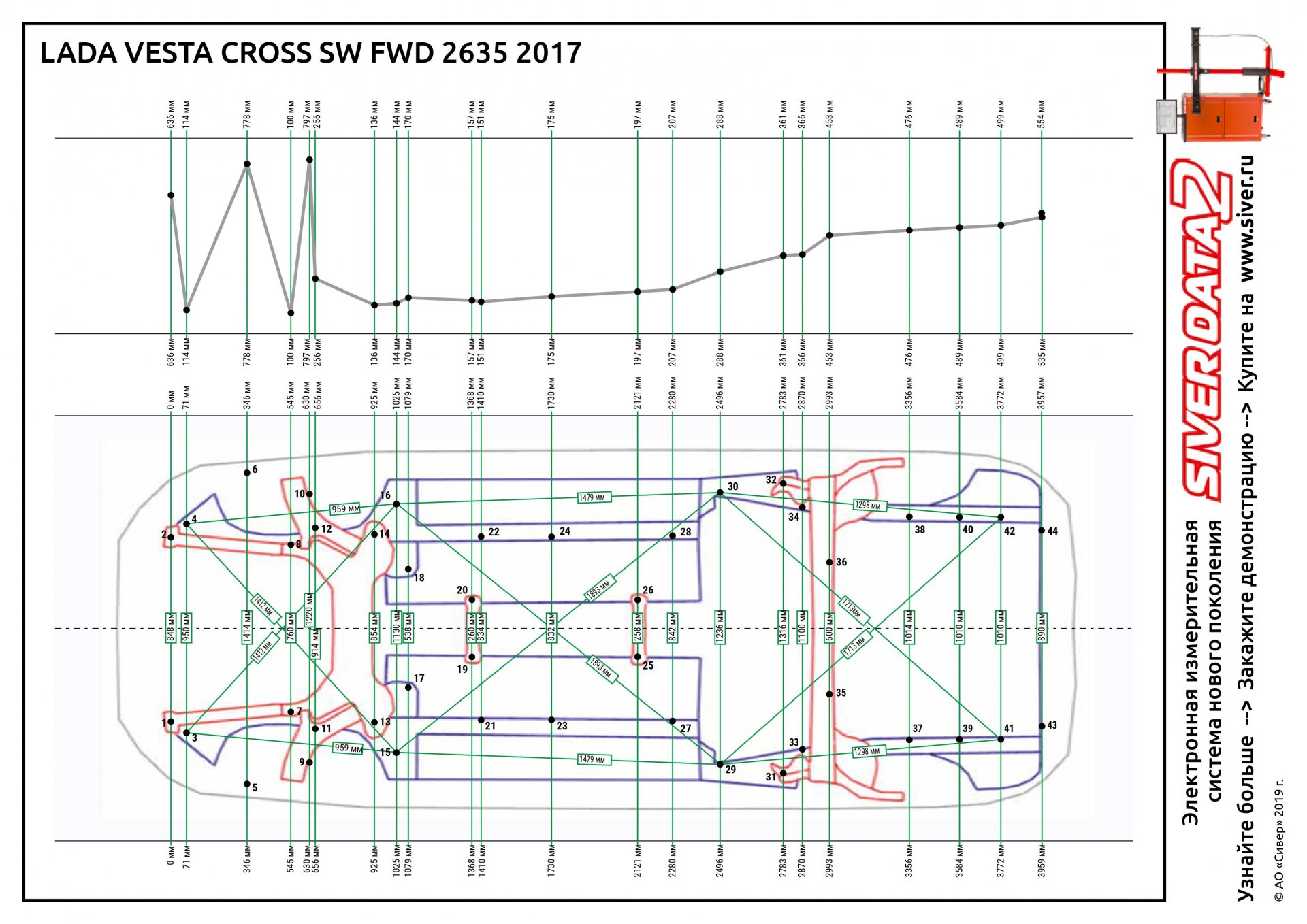 проц. Натл. акад. науч. США. 2007; 104:9650–9655. [Бесплатная статья PMC] [PubMed] [Google Scholar]
проц. Натл. акад. науч. США. 2007; 104:9650–9655. [Бесплатная статья PMC] [PubMed] [Google Scholar]
31. Mittag T., Marsh J., Forman-Kay J.D. Значение структуры/функции в динамическом комплексе внутренне неупорядоченного Sic1 с субъединицей Cdc4 убиквитинлигазы SCF . Состав. 2010;18:494–506. [Бесплатная статья PMC] [PubMed] [Google Scholar]
32. Фуксрайтер М., Томпа П. Нечеткие комплексы: более стохастический взгляд на функцию белка. Доп. Эксп. Мед. биол. 2012; 725:1–14. [PubMed] [Google Scholar]
33. Csizmok V., Orlicky S., Forman-Kay J.D. Аллостерический канал облегчает динамическое мультисайтовое распознавание субстрата с помощью убиквитинлигазы SCF ( Cdc4 ). Нац. коммун. 2017;8:13943. [Бесплатная статья PMC] [PubMed] [Google Scholar]
34. Чонг П.А., Форман-Кей Дж.Д. Разделение фаз жидкость-жидкость в сотовых сигнальных системах. Курс. мнение Структура биол. 2016;41:180–186. [PubMed] [Академия Google]
35. Шривастава Д., Мутукумар М. Зависимость конформаций полиамфолитов от последовательности. Макромолекулы. 1996; 29: 2324–2326. [Google Scholar]
Зависимость конформаций полиамфолитов от последовательности. Макромолекулы. 1996; 29: 2324–2326. [Google Scholar]
36. Дас Р.К., Паппу Р.В. На конформации внутренне неупорядоченных белков влияет линейное распределение последовательностей противоположно заряженных остатков. проц. Натл. акад. науч. США. 2013;110:13392–13397. [Статья бесплатно PMC] [PubMed] [Google Scholar]
37. Sawle L., Ghosh K. Теоретический метод вычисления конфигурационных свойств, зависящих от последовательности, в заряженных полимерах и белках. J. Chem. физ. 2015;143:085101. [PubMed] [Академия Google]
38. Лин Ю.-Х., Форман-Кей Дж.Д., Чан Х.С. Специфическое для последовательности разделение фаз полиамфолита в безмембранных органеллах. физ. Преподобный Летт. 2016;117:178101. [PubMed] [Google Scholar]
39. Лин Ю.-Х., Чан Х.С. Разделение фаз и одноцепочечная компактность заряженных неупорядоченных белков сильно коррелируют. Биофиз. Дж. 2017; 112:2043–2046. [Бесплатная статья PMC] [PubMed] [Google Scholar]
40. Зив Г., Харан Г. Сворачивание белков, коллапс белков и модель переноса Танфорда: уроки одномолекулярного FRET. Варенье. хим. соц. 2009 г.;131:2942–2947. [Статья бесплатно PMC] [PubMed] [Google Scholar]
Зив Г., Харан Г. Сворачивание белков, коллапс белков и модель переноса Танфорда: уроки одномолекулярного FRET. Варенье. хим. соц. 2009 г.;131:2942–2947. [Статья бесплатно PMC] [PubMed] [Google Scholar]
41. Hofmann H., Nettels D., Schuler B. Спектроскопия одиночных молекул неожиданного коллапса развернутого белка при низком pH. J. Chem. физ. 2013;139:121930. [PubMed] [Google Scholar]
42. Möglich A., Joder K., Kiefhaber T. Распределения расстояний от конца до конца и константы внутрицепочечной диффузии в развернутых полипептидных цепях указывают на образование внутримолекулярной водородной связи. проц. Натл. акад. науч. США. 2006;103:12394–12399. [Бесплатная статья PMC] [PubMed] [Google Scholar]
43. Yoo T.Y., Meisburger S.P., Plaxco K. Малоугловое рассеяние рентгеновских лучей и спектроскопия FRET одиночных молекул дают сильно расходящиеся представления о развернутом состоянии с низким уровнем денатурации. Дж. Мол. биол. 2012; 418: 226–236. [Бесплатная статья PMC] [PubMed] [Google Scholar]
44. Watkins H.M., Simon A.J., Plaxco K.W. Отрицательный контроль со случайной катушкой воспроизводит несоответствие между измерениями рассеяния и FRET размеров денатурированного белка. проц. Натл. акад. науч. США. 2015;112:6631–6636. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Watkins H.M., Simon A.J., Plaxco K.W. Отрицательный контроль со случайной катушкой воспроизводит несоответствие между измерениями рассеяния и FRET размеров денатурированного белка. проц. Натл. акад. науч. США. 2015;112:6631–6636. [Бесплатная статья PMC] [PubMed] [Google Scholar]
45. Холехаус А.С., Перана И., Паппу Р.В. Моделирование и эксперименты обеспечивают конвергентное представление о развернутых состояниях белка в условиях фолдинга. Биофиз. Дж. 2017;112:315а. [Google Scholar]
46. Plaxco K.W., Millett I.S., Baker D. Коллапс цепи может происходить одновременно с лимитирующей стадией фолдинга белка. Нац. Структура биол. 1999; 6: 554–556. [PubMed] [Google Scholar]
47. Джейкоб Дж., Кранц Б., Сосник Т.Р. Ранний коллапс не является обязательным этапом фолдинга белка. Дж. Мол. биол. 2004;338:369–382. [PubMed] [Google Scholar]
48. О’Брайен Э.П., Моррисон Г., Тирумалай Д. Насколько точны полимерные модели при анализе экспериментов по переносу энергии резонанса Фёрстера на белках? J. Chem. физ. 2009;130:124903. [Статья бесплатно PMC] [PubMed] [Google Scholar]
Chem. физ. 2009;130:124903. [Статья бесплатно PMC] [PubMed] [Google Scholar]
49. Kellner R., Hofmann H., Schuler B. Спектроскопия одиночных молекул показывает опосредованное шаперонами расширение белка-субстрата. проц. Натл. акад. науч. США. 2014;111:13355–13360. [Бесплатная статья PMC] [PubMed] [Google Scholar]
50. Maity H., Reddy G. Сворачивание белка L с последствиями коллапса в ансамбле денатурированного состояния. Варенье. хим. соц. 2016;138:2609–2616. [PubMed] [Google Scholar]
51. Li M., Sun T., Liu Z. Преобразование размеров и масштабирование неупорядоченных белковых цепей. Мол. Биосист. 2016;12:2932–2940. [PubMed] [Google Scholar]
52. Чжэн В., Борджиа А., Бест Р. Б. Исследование действия химического денатуранта на внутренне неупорядоченный белок с помощью моделирования и эксперимента. Варенье. хим. соц. 2016;138:11702–11713. [Бесплатная статья PMC] [PubMed] [Google Scholar]
53. Borgia A., Zheng W., Schuler B. Непротиворечивое представление о расширении полипептидных цепей в химических денатурантах, полученное с помощью нескольких экспериментальных методов. Варенье. хим. соц. 2016;138:11714–11726. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Варенье. хим. соц. 2016;138:11714–11726. [Бесплатная статья PMC] [PubMed] [Google Scholar]
54. Хаас Э., Качальский-Кацир Э., Стейнберг И.З. Броуновское движение концов олигопептидных цепей в растворе, оцененное по переносу энергии между концами цепей. Биополимеры. 1978; 17:11–31. [Google Scholar]
55. Джейкоб М.Х., Дсоуза Р.Н., Нау В.М. Диффузионно-усиленный резонансный перенос энергии Фёрстера, влияние внешних тушителей и квантовый выход донора. Дж. Физ. хим. Б. 2013; 117: 185–19.8. [PubMed] [Google Scholar]
56. Топтыгин Д., Чин А.Ф., Хильзер В.Я. Влияние диффузии на распределение скорости переноса резонансной энергии: последствия для измерений расстояний. Дж. Физ. хим. Б. 2015; 119:12603–12622. [Бесплатная статья PMC] [PubMed] [Google Scholar]
57. Piana S., Klepeis J.L., Shaw D.E. Оценка точности физических моделей, используемых при моделировании сворачивания белков: количественные данные длительного моделирования молекулярной динамики. Курс. мнение Структура биол. 2014;24:98–105. [PubMed] [Google Scholar]
2014;24:98–105. [PubMed] [Google Scholar]
58. Чен Т., Чан Х.С. Влияние барьеров десольватации и боковых цепей на локально-нелокальное сцепление и поведение шевронов в крупнозернистых моделях сворачивания белков. физ. хим. хим. физ. 2014;16:6460–6479. [PubMed] [Google Scholar]
59. Раушер С., Гапсис В., Грубмюллер Х. Структурные ансамбли внутренне неупорядоченных белков сильно зависят от силового поля: сравнение с экспериментом. J. Chem. Теория вычисл. 2015;11:5513–5524. [PubMed] [Академия Google]
60. Huang J., Rauscher S., MacKerell A.D., Jr. CHARMM36m: улучшенное силовое поле для свернутых и внутренне неупорядоченных белков. Нац. Методы. 2017;14:71–73. [Бесплатная статья PMC] [PubMed] [Google Scholar]
61. Лучший Р. Б. Вычислительные и теоретические достижения в исследованиях внутренне неупорядоченных белков. Курс. мнение Структура биол. 2017;42:147–154. [PubMed] [Google Scholar]
62. Левин З.А., Ши Дж.-Э. Моделирование неупорядоченных белков и систем с конформационной неоднородностью. Курс. мнение Структура биол. 2017;43:95–103. [PubMed] [Google Scholar]
Курс. мнение Структура биол. 2017;43:95–103. [PubMed] [Google Scholar]
63. Таваколи, М., Дж. Н. Тейлор, …, С. Прессе. 2016. Анализ данных отдельных молекул: введение. Препринт arXiv arXiv: 1606.00403.
64. Левитт М. Упрощенное представление конформаций белка для быстрого моделирования фолдинга белка. Дж. Мол. биол. 1976; 104: 59–107. [PubMed] [Google Scholar]
65. Метрополис Н., Розенблут А.В., Теллер Э. Уравнение расчета состояния с помощью быстрых вычислительных машин. J. Chem. физ. 1953; 21: 1087–109.2. [Google Scholar]
66. Сонг Дж., Нг С.К., Чан Х.С. Взаимодействия поликатион- π являются движущей силой молекулярного распознавания семейством внутренне неупорядоченных онкобелков. PLoS-компьютер. биол. 2013;9:e1003239. [Бесплатная статья PMC] [PubMed] [Google Scholar]
67. Verdier P.H., Stockmayer W.H. Расчеты методом Монте-Карло динамики полимеров в разбавленных растворах. J. Chem. физ. 1962; 36: 227–235. [Google Scholar]
68. Лал М. Компьютерное моделирование цепных молекул методом Монте-Карло. I. Мол. физ. 1969;17:57–64. [Google Scholar]
Лал М. Компьютерное моделирование цепных молекул методом Монте-Карло. I. Мол. физ. 1969;17:57–64. [Google Scholar]
69. Маккарни Э.Р., Вернер Дж.Х., Пласко К.В. Сайт-специфические размеры сильно денатурированного белка; исследование одной молекулы. Дж. Мол. биол. 2005; 352: 672–682. [PubMed] [Google Scholar]
70. Кихней А.Г., Свергун Д.И. Практическое руководство по малоугловому рассеянию рентгеновских лучей (SAXS) гибких и внутренне неупорядоченных белков. ФЭБС лат. 2015; 589 (19 часть А): 2570–2577. [PubMed] [Google Scholar]
71. Kohn J.E., Millett I.S., Plaxco K.W. Поведение случайной спирали и размеры химически развернутых белков. проц. Натл. акад. науч. США. 2004;101:12491–12496. [Бесплатная статья PMC] [PubMed] [Google Scholar]
72. Инман Х.Ф., Брэдли Э.Л., младший. Коэффициент перекрытия как мера согласия между вероятностными распределениями и точечной оценкой перекрытия двух нормальных плотностей. коммун. Стат. Методы теории. 1989; 18:3851–3874. [Google Scholar]
73. Hu J., Chen T., Zhang Z. Критическое сравнение подходов, основанных на крупнозернистой структуре, и атомарных моделей сворачивания белков. физ. хим. хим. физ. 2017;19:13629–13639. [PubMed] [Google Scholar]
Hu J., Chen T., Zhang Z. Критическое сравнение подходов, основанных на крупнозернистой структуре, и атомарных моделей сворачивания белков. физ. хим. хим. физ. 2017;19:13629–13639. [PubMed] [Google Scholar]
74. Borgia A., Wensley B.G., Schuler B. Локализация внутреннего трения по координате реакции сворачивания белка путем объединения ансамблевой и одиночной молекулярной флуоресцентной спектроскопии. Нац. коммун. 2012;3:1195. [Бесплатная статья PMC] [PubMed] [Google Scholar]
75. Choy W.-Y., Forman-Kay J.D. Расчет ансамблей структур, представляющих развернутое состояние домена Sh4. Дж. Мол. биол. 2001; 308:1011–1032. [PubMed] [Академия Google]
76. Марш Дж. А., Форман-Кей Дж. Д. Ансамбльное моделирование неупорядоченных состояний белков: вклад экспериментальных ограничений и проверка. Белки. 2012; 80: 556–572. [PubMed] [Google Scholar]
77. Антонов Л.Д., Олссон С., Хамельрик Т. Байесовский вывод белковых ансамблей по данным SAXS. физ. хим. хим. физ. 2016;18:5832–5838. [PubMed] [Google Scholar]
[PubMed] [Google Scholar]
78. Валлин С., Чан Х.С. Критическая оценка модели поиска топомера укладки белка с использованием континуальной модели с явной цепью и обширной конформационной выборкой. Белковая наука. 2005; 14:1643–1660. [Бесплатная статья PMC] [PubMed] [Google Scholar]
79. Болдуин Р.Л. Природа путей сворачивания белков: классический взгляд против нового. Дж. Биомол. ЯМР. 1995; 5: 103–109. [PubMed] [Google Scholar]
80. Шортл Д., Акерман М.С. Сохранение нативной топологии в денатурированном белке в 8 М мочевине. Наука. 2001; 293:487–489. [PubMed] [Google Scholar]
81. Meng W., Lyle N., Pappu R.V. Эксперименты и моделирование показывают, как дальнодействующие контакты могут образовываться в расширенных развернутых белках с незначительной вторичной структурой. проц. Натл. акад. науч. США. 2013;110:2123–2128. [Бесплатная статья PMC] [PubMed] [Google Scholar]
82. Садки М., Фушман Д., Муньос В. Поатомный анализ глобального нисходящего фолдинга белков. Природа. 2006; 442: 317–321. [PubMed] [Google Scholar]
Природа. 2006; 442: 317–321. [PubMed] [Google Scholar]
83. Чан Х.С., Симидзу С., Кая Х. Принципы кооперативности в фолдинге белков. Методы Энзимол. 2004; 380:350–379. [PubMed] [Google Scholar]
84. Bai Y., Sosnick T.R., Englander S.W. Промежуточные продукты сворачивания белков: водородный обмен в нативном состоянии. Наука. 1995; 269: 192–197. [Бесплатная статья PMC] [PubMed] [Google Scholar]
85. Симидзу С., Чан Х.С. Происхождение компактности денатурированного состояния белка и гидрофобной кластеризации в водном растворе мочевины: выводы из неполярных потенциалов средней силы. Белки. 2002; 49: 560–566. [PubMed] [Google Scholar]
86. Кая Х., Чан Х.С. Модель явной цепи водородного обмена в нативном состоянии: последствия для упорядочения событий и кооперативности при сворачивании белков. Белки. 2005; 58:31–44. [PubMed] [Google Scholar]
87. Нотт М., Чан Х.С. Критерии нисходящей укладки белков: калориметрия, шевронный график, кинетическая релаксация и радиус вращения одной молекулы в цепных моделях с пониженной степенью кооперативности. Белки. 2006; 65: 373–39.1. [PubMed] [Google Scholar]
Белки. 2006; 65: 373–39.1. [PubMed] [Google Scholar]
88. Martin E.W., Holehouse A.S., Mittag T. Последовательность детерминант конформационных свойств внутренне неупорядоченного белка до и после мультисайтового фосфорилирования. Варенье. хим. соц. 2016;138:15323–15335. [Бесплатная статья PMC] [PubMed] [Google Scholar]
89. Паппу Р.В., Шринивасан Р., Роуз Г.Д. Гипотеза Флори об изолированных парах недействительна для полипептидных цепей: значение для сворачивания белков. проц. Натл. акад. науч. США. 2000;97:12565–12570. [Бесплатная статья PMC] [PubMed] [Google Scholar]
90. Fitzkee NC, Rose G.D. Переоценка статистики случайных катушек в развернутых белках. проц. Натл. акад. науч. США. 2004; 101:12497–12502. [Бесплатная статья PMC] [PubMed] [Google Scholar]
91. Orevi T., Ben Ishay E., Haas E. Раннее закрытие длинной петли в рефолдинге аденилаткиназы: возможная ключевая роль нелокальных взаимодействий на начальных этапах складывания. Дж. Мол. биол. 2009; 385:1230–1242. [PubMed] [Академия Google]
[PubMed] [Академия Google]
92. Лернер Э., Ореви Т., Хаас Э. Кинетика быстро меняющихся внутримолекулярных распределений расстояний, полученная путем комбинированного анализа кинетики эффективности FRET и измерений равновесия FRET с временным разрешением. Биофиз. Дж. 2014; 106: 667–676. [Бесплатная статья PMC] [PubMed] [Google Scholar]
93. Orevi T., Rahamim G., Haas E. Последовательное закрытие петлевых структур образует сворачивающееся ядро во время рефолдингового перехода Escherichia coli молекулы аденилаткиназы. Биохимия. 2016;55:79–91. [PubMed] [Google Scholar]
94. Fuertes G., Banterle N., Lemke E.A. Разделение флуктуаций размера и формы в гетерополимерных последовательностях устраняет расхождения в измерениях SAXS и FRET. проц. Натл. акад. науч. США. 2017; 114:E6342–E6351. [Бесплатная статья PMC] [PubMed] [Google Scholar]
собачьих лет: интервью с гитаристом Грантом Горди
В последнее время все наши любимые музыканты, похоже, заняты дуэтными проектами: Крис Элдридж и Джулиан Лейдж; Эрик Скай с мандолинистом Тимом Коннеллом и Грант Горди с Джо К. Уолшем… мы даже слышали, что у Криса Тайла выходит альбом с Брэдом Мелдау. У этого списка нет конца.
Уолшем… мы даже слышали, что у Криса Тайла выходит альбом с Брэдом Мелдау. У этого списка нет конца.
Чтобы добавить к этому списку, Горди только что анонсировал еще один проект дуэта , альбом с гитаристом Россом Мартином под названием Year of the Dog
Fretboard Journal: Как появился этот дуэт?
Грант Горди: Такое ощущение, что он долго готовился. Когда я жил в Колорадо, когда мне было немного за двадцать, я постоянно слышал об этом парне, Россе Мартине. Он был первым звонком, казалось бы, на всех сессиях звукозаписи и концертах, и когда я услышал его игру, я понял, почему! Я знал, что мне нужно встретиться с ним. В конце концов мы встретились на вечеринке в Боулдере — это было, наверное, 12 или 13 лет назад. У нас была возможность немного поджемовать, а потом мы решили собраться вместе как можно больше. Самое смешное, что с гитаристами бывает сложно пересечься, ведь на одном концерте обычно не бывает двух гитаристов! Но мы встречались на фестивалях и встречались в наших местах в Денвере, пили много кофе и тусовались. Росс всегда казался мне кошкой, у которой я всегда мог многому научиться. К тому времени, когда мы начали играть, его звук был настолько развит, и он функционировал с нюансами динамики и гармонии, что меня просто поразило. Это наложило огромный отпечаток на мою игру и мышление. Он на 12 лет старше меня и примерно на фут выше, поэтому я всегда равнялся на него. Задолго до того, как мы задумались о том, чтобы заняться проектом, я думал о том, как он мог бы артикулировать линию или аккорд, или что-то в точности так, как я сделал бы с любым другим моим гитарным кумиром.
В конце концов мы встретились на вечеринке в Боулдере — это было, наверное, 12 или 13 лет назад. У нас была возможность немного поджемовать, а потом мы решили собраться вместе как можно больше. Самое смешное, что с гитаристами бывает сложно пересечься, ведь на одном концерте обычно не бывает двух гитаристов! Но мы встречались на фестивалях и встречались в наших местах в Денвере, пили много кофе и тусовались. Росс всегда казался мне кошкой, у которой я всегда мог многому научиться. К тому времени, когда мы начали играть, его звук был настолько развит, и он функционировал с нюансами динамики и гармонии, что меня просто поразило. Это наложило огромный отпечаток на мою игру и мышление. Он на 12 лет старше меня и примерно на фут выше, поэтому я всегда равнялся на него. Задолго до того, как мы задумались о том, чтобы заняться проектом, я думал о том, как он мог бы артикулировать линию или аккорд, или что-то в точности так, как я сделал бы с любым другим моим гитарным кумиром.
Росс переехал в Бруклин, кажется, около 10 лет назад, а я около четырех. Будучи путешествующими музыкантами, мы собрались удивительно много за то время, что жили в разных уголках страны. К тому времени, когда я приехал в Нью-Йорк, мы были готовы сделать из этого более реальный проект. Мы оба Собаки на китайском Зодиаке, разделенные одним 12-летним циклом, поэтому Год Собаки показался нам интересным названием. Помимо астрологической связи, мы также непреднамеренно следовали за своим носом по некоторым сходным траекториям в жизни. Мы оба провели 10 лет в Колорадо с этим перерывом в несколько лет, мы оба предприимчивые гитаристы, которые любят импровизировать и довольно широко забрасывают свои сети в музыкальный океан. И мы просто очень любим и получаем так много от совместной игры. Этот проект имел большой смысл, и время казалось подходящим.
Будучи путешествующими музыкантами, мы собрались удивительно много за то время, что жили в разных уголках страны. К тому времени, когда я приехал в Нью-Йорк, мы были готовы сделать из этого более реальный проект. Мы оба Собаки на китайском Зодиаке, разделенные одним 12-летним циклом, поэтому Год Собаки показался нам интересным названием. Помимо астрологической связи, мы также непреднамеренно следовали за своим носом по некоторым сходным траекториям в жизни. Мы оба провели 10 лет в Колорадо с этим перерывом в несколько лет, мы оба предприимчивые гитаристы, которые любят импровизировать и довольно широко забрасывают свои сети в музыкальный океан. И мы просто очень любим и получаем так много от совместной игры. Этот проект имел большой смысл, и время казалось подходящим.
FJ: Диапазон песен, которые вы каверите на этом альбоме, довольно широк. Как ты выбрал эти треки? Изменилась ли концепция этой записи, когда вы попали в студию?
GG: По мере того, как мы записывали, события развивались.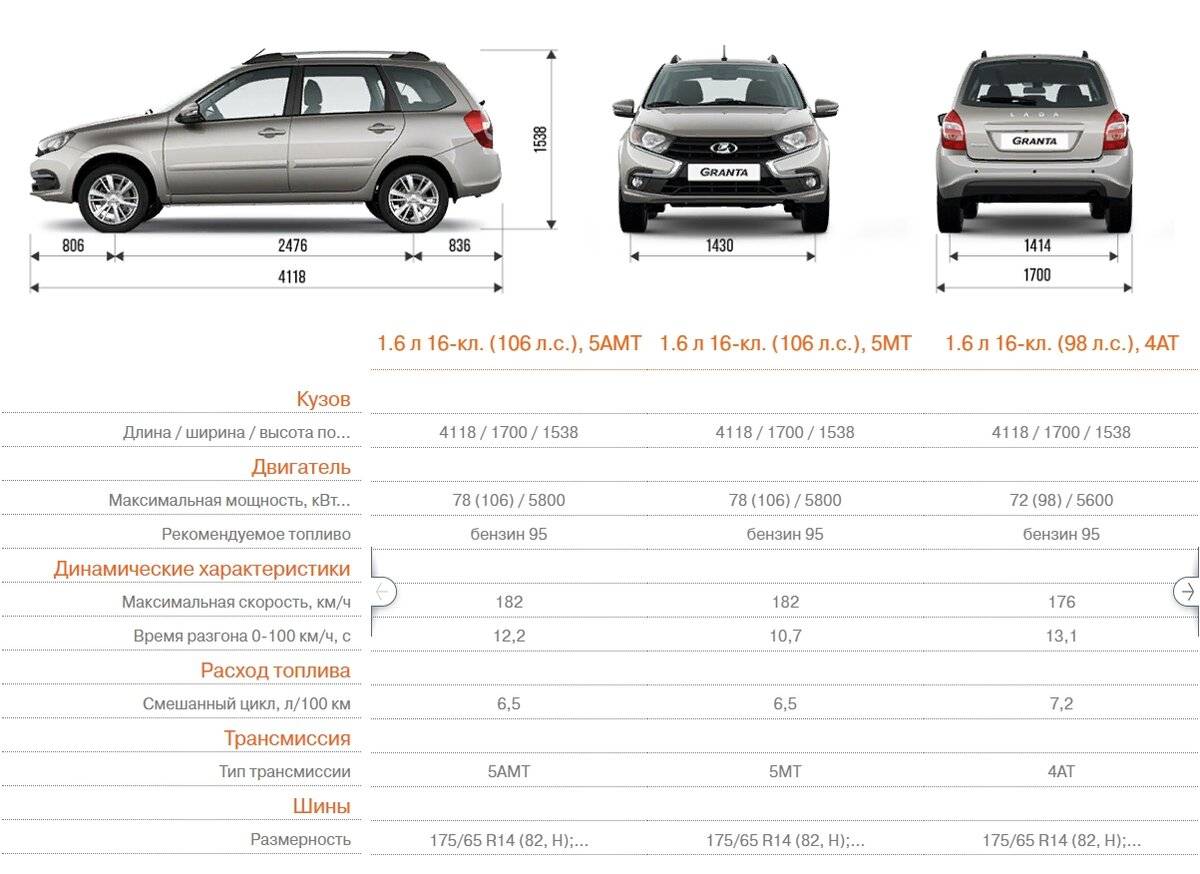 Несколько оригинальных пьес были совершенно новыми, когда мы их записали — например, мелодия Росса «Sweep» несколько раз исполнялась на концертах, но, насколько я помню, аранжировка затвердела, пока мы ее записывали, что не совсем так. по моему опыту, не редкость в студии. Моя мелодия «As the Crow Flies» все еще была написана до тех пор, пока мы не сели ее нарезать. На самом деле ничего не было вырезано, хотя некоторые мелодии оказались немного не такими, как мы могли ожидать, но ведь такова природа импровизации.
Несколько оригинальных пьес были совершенно новыми, когда мы их записали — например, мелодия Росса «Sweep» несколько раз исполнялась на концертах, но, насколько я помню, аранжировка затвердела, пока мы ее записывали, что не совсем так. по моему опыту, не редкость в студии. Моя мелодия «As the Crow Flies» все еще была написана до тех пор, пока мы не сели ее нарезать. На самом деле ничего не было вырезано, хотя некоторые мелодии оказались немного не такими, как мы могли ожидать, но ведь такова природа импровизации.
Мы не ставили перед собой цель сделать запись, отличающуюся стилистическим разнообразием. На самом деле, я не помню, чтобы когда-либо даже думал об этом! Все сводилось к тому, что нам нравится играть, что мы хотим услышать. Мы действительно хотели найти то, что казалось балансом настроений и текстур, и я думаю, что нам это удалось. Мы также пытались сбалансировать, кто на какую мелодию произносит мелодию. Крутая вещь в двух гитарах заключается в том, что существует так много возможностей для текстуры — это не должно быть просто: «Ты соло, я буду играть… Хорошо, теперь я буду соло, пока ты играешь!» Мы всегда изучаем этот аспект.
FJ: Вы записали это в Колорадо… можете ли вы описать настройку студии?
Мы записывались в студии Swingfingers недалеко от Форт-Коллинза, штат Колорадо. Им управляет наш хороший друг Аарон Янгберг, который является неотъемлемой частью музыкальной сцены Колорадо, а также отличным инженером и игроком на банджо. Это разбивка Аарона о настройке записи…
Для меня: установка «разнесенная пара», но мы использовали более двух микрофонов, поэтому называть разнесенную пару не совсем правильно. Нековые микрофоны на 12-м ладу представляли собой Royer 122 в предусилителе Forssell SMP2 и винтажный Neumann KM84 в предусилителе Mercury V72. В качестве мостового микрофона мы использовали Flea C12 с предусилителем Forssell SMP2. Для микрофона на правом плече — винтажный Neumann U87 в предусилитель Forssell SMP2.
У Росса также была установка «разнесенная пара». Его микрофон на 12-м ладу был винтажным Neumann KM54 в предусилителе Chandler Limited TG2; на бридже у него был винтажный Neumann M49 в предусилитель Chandler Limited TG2. Его микрофон на правом плече был Flea U47 с предусилителем Grace V3.
Его микрофон на 12-м ладу был винтажным Neumann KM54 в предусилителе Chandler Limited TG2; на бридже у него был винтажный Neumann M49 в предусилитель Chandler Limited TG2. Его микрофон на правом плече был Flea U47 с предусилителем Grace V3.
Комнатный микрофон представлял собой AKG 414 B-ULS (всенаправленный) с предусилителем Forssell SMP2.
ФД: Много микрофонов! Я вижу, вы также играли на нескольких разных гитарах, включая Martin 000-18 40-х годов, Martin D-28 1975 года и 1998 Коллингс Д-1. Проведите нас через мыслительный процесс здесь: Почему вы выбрали Martin, а не Collings на данном треке, или наоборот?
ГГ: Это был интересный процесс. В последнее время я в основном предпочитаю ’44 ooo-18 просто потому, что очень люблю эту гитару. Он может справиться с чем угодно (на самом деле, вся пластинка Mr. Sun, The People Need Light , я играл на ооо), но особенно он нужен для мелодий, где мне нужен более теплый среднечастотный звук; Мне нравится, как это звучит в балладах и во всем, где есть пространство, где можно дать нотам немного подышать. Я играл на своем Martin D-28 (который наиболее близок к Ross’ Collings D2-H) в «Snowflake Reel/Bright Size Life», потому что есть гармоничная мелодия, которую мы играем вместе в «Snowflake», и мы хотели, чтобы гитары из розового дерева действительно сочетались друг с другом. за этот разрез.
Я играл на своем Martin D-28 (который наиболее близок к Ross’ Collings D2-H) в «Snowflake Reel/Bright Size Life», потому что есть гармоничная мелодия, которую мы играем вместе в «Snowflake», и мы хотели, чтобы гитары из розового дерева действительно сочетались друг с другом. за этот разрез.
То же самое и с «Dear Old Dixie» — в этом треке так много ансамблевой мелодии, и мы от всего сердца использовали два звука дредноута для этого трека, на котором я играл на своем Collings D1. D1 также настроен на более низкое действие, которое мне очень нужно для такого быстрого темпа! Некоторые из этих строк довольно сложны. Я полагаю, что он вернулся к ooo-18 со мной до конца записи.
Ф.Дж.: Между вашей работой с Джо К. Уолшем и этим вы были в дуэте… чем Росс отличается от Джо как партнер?
GG: Игра в паре всегда была для меня большой. Мой папа и я много играли вместе, когда я был моложе — он отличный гитарист — так что я много тренировался в таком диалоге. Это совершенно другой вид ансамблевой игры, с совсем другим набором обязанностей и переменных, чем у целой группы. Джо К. Уолш, один из лучших игроков на мандолине, которого я когда-либо слышал, уже много лет является моим музыкальным братом, и мы вместе играли во многих сценариях групп, но, разобравшись, только вдвоем. это уникальная вещь. У Джо такой разговорный стиль игры, и его чувство ритма такое драйвовое, но при этом чувствительное. Это сложный баланс, но он его находит. В более общем плане игра на дуэте мандолина/гитара даст вам определенные неотъемлемые правила. Из-за диапазонов и тембров двух инструментов мы стараемся думать о том, как наилучшим образом поддерживать друг друга и наилучшим образом поддерживать все, что происходит в данный музыкальный момент. Но роли несколько более определены, и есть немного больше шаблона, связанного с мятликом.
Мой папа и я много играли вместе, когда я был моложе — он отличный гитарист — так что я много тренировался в таком диалоге. Это совершенно другой вид ансамблевой игры, с совсем другим набором обязанностей и переменных, чем у целой группы. Джо К. Уолш, один из лучших игроков на мандолине, которого я когда-либо слышал, уже много лет является моим музыкальным братом, и мы вместе играли во многих сценариях групп, но, разобравшись, только вдвоем. это уникальная вещь. У Джо такой разговорный стиль игры, и его чувство ритма такое драйвовое, но при этом чувствительное. Это сложный баланс, но он его находит. В более общем плане игра на дуэте мандолина/гитара даст вам определенные неотъемлемые правила. Из-за диапазонов и тембров двух инструментов мы стараемся думать о том, как наилучшим образом поддерживать друг друга и наилучшим образом поддерживать все, что происходит в данный музыкальный момент. Но роли несколько более определены, и есть немного больше шаблона, связанного с мятликом.
С двумя гитарами регистр, с которым вам приходится работать, больше, поэтому доступна эта оркестровая опция, и мы можем переключаться между различными видами ролей — один из нас может быть басистом, или пианистом, или мы можем просто сделайте один большой аккорд, чтобы вы даже не могли сказать, кто что делает.
Мощная штука!
И хотя мы оба играем плоско, мы не собирались делать «плоский рекорд». Есть прецеденты гитарного дуэта во многих музыкальных жанрах, поэтому кажется, что мы связаны только нашими собственными творческими ограничениями. Опыт Росса в области джаза и импровизационной музыки, а также моя любовь ко множеству различных видов гармонии в сочетании с нашим обоюдным любопытством к текстурным возможностям, доступным для двух гитар, дает нам естественный толчок к тому, чтобы максимально расширить наши вкусы.
Ф.Дж.: Есть планы на запись дуэта с Джо К. Уолшем?
GG: Мы говорили об этом! Пока ничего официально не оформлено, но вполне вероятно, что это произойдет в следующем году.
FJ: Последний вопрос: Какие ваши любимые записи дуэта, по вашему мнению, должен заценить каждый гитарист (или не гитарист)?
GG: Вот несколько любимых на все времена…
- Билл Эванс/Джим Холл, Undercurrent
- Рон Майлз/Билл Фризелл, Heaven
- Чарли Хейден/Кит Джарретт, Жасмин
- Дэвид Грисман/Тони Райс, Тональные стихи (я носил это на кассете, когда был подростком)
- Чарли Хейден/Хэнк Джонс, Украсть
- Sergio & Odair Assad, Латиноамериканская музыка для двух гитар
Закажите Year of the Dog в Bandcamp по этой ссылке.

 с
с