Принцип работы аккумулятора
Аккумулятор: устройство, разновидности, назначение, принцип работы
Аккумулятор представляет собой устройство, которое накапливает энергию в химической форме при подключении к источнику постоянного тока, а затем отдает ее, преобразуя в электричество. Его используют многократно за счет способности к восстановлению и обратимости химических реакций. Разряжается – снова заряжают.
Применяются аккумуляторы в качестве автономных и резервных источников питания для электротехнического оборудования и различных устройств.
Устройство аккумулятора
В автомобилях обычно применяют свинцово-кислотные аккумуляторы.
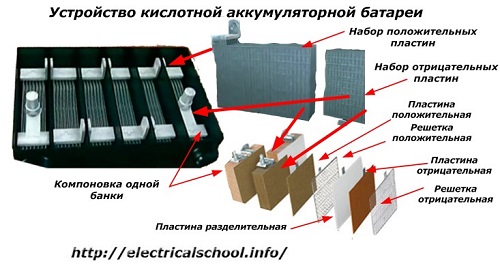
Все элементы располагаются в корпусе, который изготавливают из полипропилена. Корпус состоит из емкости, разделенной на шесть ячеек, и крышки, оснащенной дренажной системой для стравливания давления и отвода газа. На крышку выводится два полюса (клеммы) – положительный и отрицательный.
Содержимое каждой ячейки представляет собой пакет из 16 свинцовых пластин, полярность которых чередуется.
Пакеты пластин в ячейках погружены в электролит – раствор серной кислоты и воды плотностью 1,28 г/см3.
Между пластинами электродов, для предотвращения замыкания, вставлены сепараторы – пористые пластины, которые не препятствуют циркуляции электролита и не взаимодействуют с ним.
Отдельная пластина электрода – это решетка из металлического свинца, в которую впрессован (намазан) реагент. Активная масса катода – диоксид свинца (PbO2), анода – губчатый свинец.
Принцип действия аккумуляторов
Принцип действия аккумулятора основан на образовании разности потенциалов между двумя электродами, погруженными электролит. При подключении нагрузки (электротехнических устройств) к клеммам аккумулятора в реакцию вступают электролит и активные элементы электродов.
При разряде аккумулятора (подключении нагрузки) губчатый свинец анода выделяет положительные двухвалентные ионы свинца в электролит. Избыточные электроны перемещаются по внешней замкнутой электрической цепи к катоду, где происходит восстановление четырехвалентных ионов свинца до двухвалентных.
При их соединении с отрицательными ионами серного остатка электролита, образуется сульфат свинца на обоих электродах.
Ионы кислорода от диоксида свинца катода и ионы водорода из электролита соединяются, образуя молекулы воды. Поэтому плотность электролита понижается.
При заряде происходят обратные реакции. Под воздействием внешнего напряжения ионы двухвалентного свинца положительного электрода отдают по два электрона и окисляются в четырехвалентные. Эти электроны движутся к аноду и нейтрализуют ионы двухвалентного свинца, восстанавливая губчатый свинец.
Химические реакции в одной ячейке вырабатывают напряжение 2 В, поэтому на клеммах аккумулятора из 6 ячеек и получается 12 В.
Из видео Вы сможете более подробно узнать, как работает аккумулятор.
Что нужно знать про АКБ
Аккумулятор – это контейнер который состоит из шести отдельных секций. Каждая отдельная секция представляет собой отдельный источник питания (вырабатывает каждая секция около 2,1 В), внутри секции находятся две пластины (сделаны из свинца), положительная и отрицательная, отделенные друг от друга.
Масса аккумулятора состоит из: веса электролита, свинцовых пластин и соединений, и составляет примерно 16-17 кг.
В свинцовые пластины добавляют сурьму (для увеличения прочности пластин), но к сожалению наличие сурьмы ведет к выкипанию воды из электролита, из-за чего почти во все типы аккумуляторов надо доливать воду. Благодаря прогрессу количество сурьмы в пластинах удалось уменьшить, что привело к появлению малообслуживаемых и гибридных аккумуляторов.
Сама работа аккумулятора очень проста. На положительном электроде нанесена двуокись свинца (цвет темно-коричневый), на отрицательном – губчатый свинец (серого цвета), внутрь залит электролит – водный раствор серной кислоты. При начале работы (разрядка) активная масса отрицательного электрода превращается в сульфат цинка и отдает в электрическую цепь два электрона, активная масса положительного электрода также преобразуется в сульфат цинка, и принимает из электрической цепи два электрона.
Для преобразования в сульфат цинка, как положительного, так и отрицательного электрода, тратится серная кислота — уменьшается массовая доля электролита. При зарядке, все наоборот, а также идет образование серной кислоты и увеличивается массовая доля электролита.
Аккумуляторные батареи делятся на четыре типа: обслуживаемые, малообслуживаемые, гибридные и необслуживаемые (как выбрать аккумулятор для авто). Обсудим каждую по отдельности:
✔ Обслуживаемые – найти такие трудно, но возможно. По сравнению с другими у них очень много недостатков и мало плюсов, а именно: довольно-таки дорогая стоимость, эбонитовый корпус (очень хрупкий), сверху они заливаются мастикой, которая из-за перепадов температуры и загрязнения теряет свои изоляционные свойства (аккумулятор самопроизвольно разряжается, и очень быстро). Из плюсов можно отметить возможность замены блока пластин. Из минусов — с мастики надо регулярно сдувать (убирать) грязь и часто надо доливать воду, примерно каждые 5-7 тыс.км.
По сравнению с другими у них очень много недостатков и мало плюсов, а именно: довольно-таки дорогая стоимость, эбонитовый корпус (очень хрупкий), сверху они заливаются мастикой, которая из-за перепадов температуры и загрязнения теряет свои изоляционные свойства (аккумулятор самопроизвольно разряжается, и очень быстро). Из плюсов можно отметить возможность замены блока пластин. Из минусов — с мастики надо регулярно сдувать (убирать) грязь и часто надо доливать воду, примерно каждые 5-7 тыс.км.
✔ Малообслуживаемые – представлены очень широко, цены на них варьируются, от очень дешевых до дорогих, корпус пластиковый и очень надежный, воду надо заливать примерно каждые 20-30 тыс.км.
✔ Гибридные – относятся к малообслуживаемым, за некоторыми но: решетки положительных и отрицательных электродов состоят из разных сплавов, таким образом «гибридные» аккумуляторы сочетают в себе положительные свойства двух технологий, а именно: высокие пусковые токи, низкий расход воды и «выносливость». Найти такие трудно, да и стоимость высоковата.
Найти такие трудно, да и стоимость высоковата.
✔ Необслуживаемые – расход воды у таких аккумуляторов так мал, что крышек для залива воды уже нет, обслуживания не требуется никакого. Но есть несколько недостатков: надо проверять натяжение ремня генератора, исправность самого генератора, регулятора напряжения и отсутствие утечек тока в системе электрооборудования. Цена на них, как на качественные малообслуживаемые, и если Вы уверены в своем автомобиле – это идеальный вариант.
Заряжать батарею начинают летом – если разрядка составляет 50%, зимой – 25%. Если зимой плотность электролита упала до 1,20 г/см3, то электролит будет замерзать примерно при -20С.
Как происходит зарядка аккумуляторной батарей?
Не забывайте перед уходом из автомобиля выключать все электроприборы, иначе можете прийти к авто, а аккумулятор сел. Например, включенные габариты полностью разрядят аккумулятор примерно за 30 часов.
Зарядка автомобильного аккумулятора осуществляется двумя разными способами:
1. Аккумулятор стоит непосредственно в автомобиле, двигатель работает и генератор в рабочем состоянии, зарядка идет автоматически (чем больше держите обороты, а электроприборы по возможности не включаете, тем быстрее идет зарядка).
Аккумулятор стоит непосредственно в автомобиле, двигатель работает и генератор в рабочем состоянии, зарядка идет автоматически (чем больше держите обороты, а электроприборы по возможности не включаете, тем быстрее идет зарядка).
2. Вынимается аккумулятор и берется зарядное устройство, подключаются контакты минус к минусу, плюс к плюсу. Чем меньше зарядный ток, тем больше заряда получит батарея. Только не перегибайте, а то аккумулятор не «закипит» и через «месяц». Далее читаем инструкцию зарядного устройства, т.к. сейчас зарядное устройство – это настоящий миникомпьютер с кучей кнопок и свойств. Зарядных устройств великое множество, и тяжело выделить кого либо из производителей, отличаются они друг от друга, как ценой так и свойствами (сглаживание поступающего напряжения, гашение «скачков»).
Аккумулятор считается полностью заряженным, когда электролит «закипел». В среднем зарядка идет около 8-10 часов, но время может сильно варьироваться, все зависит от изначального заряда батареи. После закипания нужно подождать минут 10-15 и отключить зарядное устройство, после чего аккумулятор считается полностью заряженным.
После закипания нужно подождать минут 10-15 и отключить зарядное устройство, после чего аккумулятор считается полностью заряженным.
После зарядки аккумулятора желательно его тщательно промыть и просушить, т.к. на корпус батареи может попасть кислота или грязь. Это может привести к своевременному разряду АКБ, т.к. его корпус пропускает напряжение. Это можно легко проверить — нужно измерить напряжение крышки аккумулятора. Если оно отлично от нуля, то батарея пропускает напряжение и ее нужно промыть раствором соды. Только следите, чтобы данный раствор не попал в банки аккумулятора.
Особенности зарядки и разрядки
Энергия, используемая для восстановления ёмкости АКБ, поступает из зарядных устройств, подключённых к электрической сети. Чтобы заставить ток протекать внутри элементов, напряжение источника должно быть выше, чем у батареи. Значительное превышение расчётного зарядного напряжения может привести к выходу АКБ из строя.
Алгоритмы зарядки напрямую зависят от того, как устроен аккумулятор и к какому типу он относится.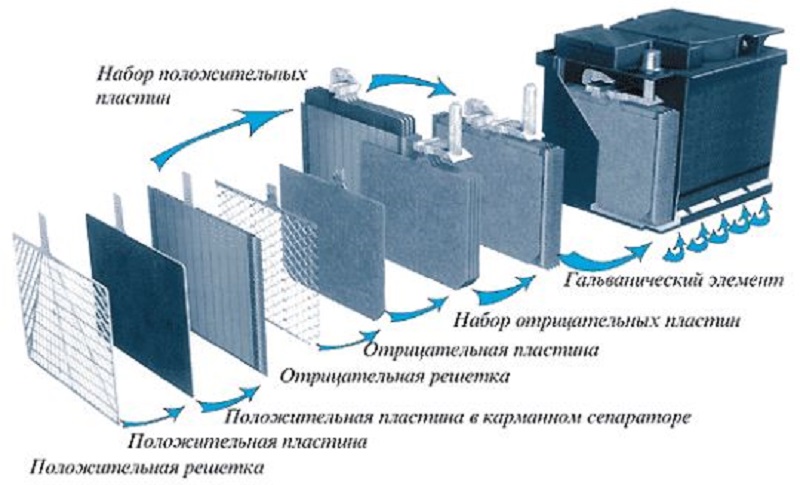 Например, некоторые батареи могут безопасно пополнять свою ёмкость от источников постоянного напряжения. Другие работают только с регулируемым источником тока, способными менять параметры в зависимости от уровня заряда.
Например, некоторые батареи могут безопасно пополнять свою ёмкость от источников постоянного напряжения. Другие работают только с регулируемым источником тока, способными менять параметры в зависимости от уровня заряда.
Типы АКБ
В зависимости от состава электролита, материалов электродов и особенностей конструкции можно выделить три распространённых типа аккумуляторов.
Свинцово-кислотные
Эти АКБ имеют самую долгую историю популярности в качестве автономных источников питания. Большинство таких батарей изготовлены из свинцовых пластин или сеток, где одна из решёток (положительный электрод) покрыта диоксидом свинца в кристаллической форме. Электролит, состоящий из серной кислоты, участвует в реакциях свинца и диоксида свинца с образованием сульфата свинца. Перемещение ионов последнего образует ток разряда. Заряд происходит при помощи восстановления током заряда диоксида свинца на катоде.
Этот тип батарей был востребован на протяжении более чем сотни лет благодаря следующим особенностям:
- широкому диапазону возможностей как при производстве сильных, так и слабых токов;
- надёжностью в течение сотен циклов в присутствии контроля заряда;
- относительно низкой стоимости (свинец дешевле в пересчёте на ёмкость чем никель, кадмий, литий или сере
Принцип работы батарейки
Принцип работы батарейки. Как работает батарейка
Как работает батарейка
Весь принцип работы батарейки сводится к химической реакции.
Батарейки в зависимости от “начинки” разделяются на несколько видов.
Солевые конструкции намного дешевле щелочных. Их выпуском занимаются такие фирмы, как «Дюрасел», «Сони», «Тошиба». Они являются потомками марганцево-цинковых конструкций. Их рекомендуют использовать в устройствах с низким уровнем потребления напряжения, таких как часы, электронные весы, пульты управления. Существенным недостатком этих элементов является короткое время работы заряда.При длительном использовании элементы подобного типа начинают течь. При отрицательных температурах солевые конструкции не работают.
Щелочные устройства появились относительно недавно, в 60-х гг. прошлого века. Первыми их начала выпускать фирма «Дюрасел». Данный тип батарей более надежен и имеет большую мощность. При длительном хранении они не теряют свой заряд. На таких элементах всегда присутствует надпись “alkaline”. Их устанавливают в детских игрушках, радио, ночниках, иными словами, в приборах, потребляющих большое количество энергии.
Их устанавливают в детских игрушках, радио, ночниках, иными словами, в приборах, потребляющих большое количество энергии.
Ртутные не получили широкого распространения. в силу ряда причин. От их применения пришлось отказаться из-за вещества, за счет которого осуществляется их работа. Ртуть может нанести вред здоровью человека.
Наименее популярны серебряные элементы. В состав их электродов входит серебро. За счет этого увеличивается срок службы, повышается энергетическая плотность и постоянное номинальное напряжение.
Большим минусом является их высокая стоимость. Существенным плюсом – высокая емкость. Они одинаково хорошо работают и при высоких, и при низких температурах. Срок функционирования – достаточно велик по сравнению с другими типами элементов.
Литиевые конструкции объединили в себе все лучшие свойства остальных типов батарей. Их можно эксплуатировать практически в любых условиях, имеется возможность их дальнейшей подзарядки. Они являются самыми надежными элементами. Их рекомендуется использовать в приборах с большим энергопотреблением.
Они являются самыми надежными элементами. Их рекомендуется использовать в приборах с большим энергопотреблением.
Формы батареек
1. Дисковые.
2. Цилиндрические.
3. Квадратные.
Дисковые батарейки
Они являются наиболее востребованными. Существует 2 способа их маркировки: американская (менее распространена) и европейская (более привычна). Маркировка помогает точно подобрать необходимый для прибора элемент питания. Дисковые конструкции производят для совсем маленьких по размеру устройств. Показатель напряжения у этого типа – до 3V.
Цилиндрические батарейки
Самые маленькие изделия имеют маркировку – А23. Их называют мини-мизинчиковыми. Следующие, по списку – пальчиковые, их маркировка – АА. Потом следуют мизинчиковые – ААА. Редко для устройства могут понадобиться маленькие мизинчиковые – АААА. Следующие 2 вида практически не используются: средняя – С и большая – D. У цилиндрических устройств показатель напряжения доходит до 6V.
Квадратные батарейки
Самое большое напряжение выдают батарейки, имеющие квадратную форму, – до 9V. Но и этот тип почти не востребован.
На любом элементе питания обязательно указывается вид применяемого электролита.
Размер каждого типа элемента питания может отличаться на 1-2 мм в зависимости от производителя. Причина таких отличий кроется в толщине оболочки, которая используется для защиты от падения и неблагоприятных воздействий окружающей среды. Чаще всего на ней указывается название фирмы-производителя и маркировка.
Брендовые конструкции отличаются высоким качеством и имеют гарантию. На некоторых видах элементов питания есть особая маркировка – «rechargeable». Данная надпись означает, что элемент питания можно зарядить с помощью специального устройства. Дисковые батарейки Дисковые батарейки Среди многообразия батареек, выбрать нужную достаточно сложно. В первую очередь необходимо ориентироваться на прибор, для которого приобретаются элементы питания. Для мощных устройств нет смысла брать щелочные батареи, т.к. их заряд быстро закончится. В этом случае лучшее решение – литиевые. Их срок службы оправдывает высокую стоимость. Кроме того, часто производители приборов в инструкции указывают, какой тип батареек подходит для их техники.
Для мощных устройств нет смысла брать щелочные батареи, т.к. их заряд быстро закончится. В этом случае лучшее решение – литиевые. Их срок службы оправдывает высокую стоимость. Кроме того, часто производители приборов в инструкции указывают, какой тип батареек подходит для их техники.
Что происходит с точки зрения химии?
К примеру, в стеклянную емкость нальем раствор серной кислоты и поместим туда стержень, выполненный из цинка. На поверхности данного стержня имеются положительно заряженные ионы. А вокруг этого цинкового объекта, в растворе, скапливаются отрицательные ионы вещества. У раствора имеются силы притяжения, которые с легкостью отрывают ионы цинка. В результате жидкость получает положительный заряд, а цинковая пластина или стержень отрицательный.
Из физики известно, что разность потенциалов равна напряжению. Отсюда и возникает электрический ток. Когда происходит контакт кислотного раствора и металла, на границе образуется электрическое поле. В момент его появления химическая энергия превращается в электрическую. Таков принцип работы батареи.
Таков принцип работы батареи.
Через некоторое время ресурс батареи будет истощен. Все зависит от того, где и как используется источник питания. Например, если от него работает фонарик, то при умеренном использовании 2-х батарей на 1,5 вольта каждая, хватит на 1 месяц. Но если вставить эти же самые батарейки в электрическую машинку, она будет работать несколько часов. В результате всего этого можно сделать вывод что чем больше нагрузка, тем быстрее разрядиться батарейка.
Как работает аккумуляторная батарейка, её отличие от обычной
Реакция, протекающая в АКБ, относится к разряду обратимых. Именно возможность протекания обратимой реакции в аккумуляторе позволяет заряжать его.
В АКБ, подключенной к сети, реакция протекает в обратном направлении, и ток идёт от «плюса» к «минусу», а не наоборот. Как результат – продукт реакции образует исходные вещества, а хозяин АКБ получает доступную «восстановленную» энергию в портативном формате.
История обыкновенной батарейки
Слово «батарея», происходящее от французского слова «batterie», давно вошло в русский язык.
Название происходит от артиллерийской батареи, как исторически первого типа батарей. Впоследствии название стало употребляться для обозначения соединения однотипных предметов вообще.
Официальное рождение батареи относят к 1800 г., когда итальянский физик Алессандро Вольта, основываясь на опытах итальянского врача и анатома Луиджи Гальвани, сделал устройство, получившее впоследствии название «вольтов столб». Сложив стопку высотой полметра из пластинок цинка, меди и войлока, смоченного раствором серной кислоты, Вольта, приложив руки к концам стопки, получил весьма чувствительный удар током. Так началась электрическая эра.
Изобретение Алессандро Вольта произвело фурор в обществе, Вольта осыпали почестями и наградами, его именем назвали единицу электрического напряжения. Свою долю славы получил и Луиджи Гальвани. В его честь электрохимический элемент, изобретенный Вольта, называется гальваническим.
Гальванические элементы делятся на два типа – первичные и вторичные.
Все батарейки являются первичными гальваническими элементами.
Вторичные гальванические элементы – элементы, в которых электрическая энергия от внешнего источника тока превращается в химическую энергию и накапливается, а затем, при необходимости, химическая энергия снова превращается в электрическую. Эти вторичные элементы называются аккумуляторами.
Одним из первых гальванических элементов, которым можно было пользоваться вне лабораторий, был изобретен Жоржем Лекланше в 1866 году.
Конструкция имени Лекланше проста — цинковый анод, катод из диоксида марганца с углем, размещенные в электролите из хлорида аммония, т.е. соли аммония.
В течении некоторого времени элемент Лекланше претерпел изменения: цинковый анод стал делаться в виде цинкового стаканчика, в стаканчике размещен катод из смеси диоксида марганца и графита, в центре катода находится угольный стержень, являющийся токосъемником, катод окружен электролитом из хлорида аммония с добавкой хлорида цинка, только не в жидком виде, как у Лекланше, а в загущенном, в виде геля, из-за добавления крахмала и муки. Это необходимо для того, чтобы электролит не мог вытечь или высохнуть при хранении и эксплуатации элемента.
Это необходимо для того, чтобы электролит не мог вытечь или высохнуть при хранении и эксплуатации элемента.
Элементы с загущенным электролитом получили название «сухие батареи».
Одним из всплесков было появление щелочных батарей. Впервые щелочные батарейки выпустила компания Eveready (ныне Energizer) в 1959г. Принцип ее работы практически идентичен принципу работы солевой батареи – анод из цинка, катод из диоксида марганца, единственное отличие в составе электролита – он не из соли аммония, как в солевой, а из раствора щёлочи, обычно гидроксида калия. У щелочной батареи анод в виде пасты из цинкового порошка в смеси с электролитом находится внутри катода из смеси диоксида марганца с графитом.
Анод и катод разделены тонким сепаратором, пропитанным электролитом, и все это располагается в стальном корпусе. Получается, что если у солевого элемента корпус (-), а центральный токоотвод (+), то у щелочного элемента все наоборот, корпус (+), а центральный токоотвод (-).
Такая конструкция, разумеется, сделана не просто так. В солевых элементах при химической реакции расходуются все реагенты, составляющие этот элемент — анод, катод, электролит. А в щелочном элементе при химической реакции расходуется только анод и катод, электролит не расходуется. Поэтому электролита там совсем мало, и освободившееся место электролита заполнено увеличенным количеством анода и катода, что значительно увеличивает электроемкость щелочного элемента.
Форм-фактор распространенных гальванических элементов
Преимущества и недостатки солевых и щелочных элементов
У солевых сейчас осталось только одно преимущество — цена. Технология производства проста, стоимость реагентов и материалов низка, поэтому себестоимость очень маленькая. Но на этом преимущества заканчиваются.
Недостатки:
1. маленькая ёмкость
В среднем ёмкость солевого элемента в 3-5 меньше, чем у щелочного. К тому же это при малой и средней нагрузке, при высокой нагрузке (мощные фонари, фотоаппараты и видеокамеры) разница в ёмкости еще больше увеличивается и достигает 10. Например, солевая батарейка питает маломощный прибор 10 дней, а щелочная 10*3=30 дней.
Например, солевая батарейка питает маломощный прибор 10 дней, а щелочная 10*3=30 дней.
2. маленький срок хранения
У солевого элемента – 2 года, у щелочного – 7-10 лет. Срок хранения солевой батареи можно увеличить, если держать ее в холодильнике. При низкой температуре химические реакции замедляются. Для щелочных элементов температура хранения некритична
3. узкий температурный диапазон эксплуатации
Солевые батареи вообще не могут работать при отрицательных температурах, а щелочная при -20 °С отдает такую же емкость, как солевая в режиме беспрерывного разряда при комнатной температуре.
В последние несколько лет в продаже появились новый тип элементов — литиевый. Принцип действия похож на принцип солевого и щелочного элемента, но анод изготовлен из лития или его соединения. Из химии известно, что литий имеет наивысший отрицательный потенциал по отношению к остальным металлам. А значит, он имеет наибольшее номинальное напряжение при минимальных размерах.
Другие параметры тоже превосходные – очень большое время хранения (до 15 лет), исключительно малые токи саморазряда и высокая степень герметичности, хранение и работа в широком диапазоне отрицательных и положительных температур.
Советы от опытных пользователей
Не надо стремиться покупать элементы известных фирм, которые на слуху благодаря навязчивой рекламе. Да, высокотехнологичная батарейка может оказаться самой долгоиграющей, но ее цена взлетает в небеса.
На одном сайте был проведен большой тест батареек различных фирм, там посчитали комплексный параметр цена/емкость, и в результате тестов лидером отказалась безымянная батарейка, продающаяся в гипермаркете Ашан, ее ватт мощности оказался самым дешевым, оставив далеко позади именитые фирмы.
Понравилась статья? Расскажите друзьям: Оцените статью, для нас это очень важно:Проголосовавших: 1 чел.
Средний рейтинг: 5 из 5.
Принцип работы аккумулятора автомобиля и не только
АКБ окружают людей в их повседневной жизни буквально повсюду – в мелкой и крупной домашней технике, средствах связи, любимом автомобиле. Несмотря на это, многие не знают, каков принцип работы аккумулятора, и посему не умеют с ним обращаться. На самом деле есть один генеральный принцип, которому подчинена работа батарей всех видов. Это обратимые химические реакции, происходящие циклично. Во время разряда аккумуляторной батареи происходит превращение энергии химической в электрическую, что обеспечивает работу технического устройства, к которому подключен АКБ. Когда запас этой энергии будет исчерпан на определенный процент, производят зарядку аккумулятора. Во время нее также идут химические превращения, но уже с обратным эффектом. То есть поступление электрического тока вызывает накопление запасов химической энергии.
Несмотря на это, многие не знают, каков принцип работы аккумулятора, и посему не умеют с ним обращаться. На самом деле есть один генеральный принцип, которому подчинена работа батарей всех видов. Это обратимые химические реакции, происходящие циклично. Во время разряда аккумуляторной батареи происходит превращение энергии химической в электрическую, что обеспечивает работу технического устройства, к которому подключен АКБ. Когда запас этой энергии будет исчерпан на определенный процент, производят зарядку аккумулятора. Во время нее также идут химические превращения, но уже с обратным эффектом. То есть поступление электрического тока вызывает накопление запасов химической энергии.
Отличают разные аккумуляторы между собой два аспекта – тип электролита и материал, из которого выполнены электроды. Основой для электролита выступают кислоты или щелочи, которые после разбавления водой или другими добавками приобретают вид готовой гомогенной смеси различной консистенции (жидкой либо гелевой). Вещество, выступающее электродом, способно изменять свойства готового изделия. Самыми распространенными являются литиевые, свинцовые и никель-кадмиевые батареи.
Вещество, выступающее электродом, способно изменять свойства готового изделия. Самыми распространенными являются литиевые, свинцовые и никель-кадмиевые батареи.
Об автомобильных аккумуляторах
Принцип работы стандартного автомобильного аккумулятора опирается на его конструкцию и не зависит от того, залит в него кислотный или щелочной электролит.
Внутри диэлектрического и нерастворимого серной кислотой корпуса из специального пластика помещаются шесть банок-батареек, последовательно прикрепленных друг к другу. В каждой из этих банок есть по несколько электродов с зарядами «плюс» и «минус», которые выглядят как отводящая ток решетка, смазанная специальной химически активной массой.
Чтобы решетки с разными знаками случайно не соприкоснулись и не закоротили, каждая из них погружена в разделитель из полиэтилена. Сами электроды сделаны обычно из свинца с разнообразными примесями.
Если быть точным, то таких свинцовых решеток бывает три вида:
- Малосурьмянистые.
 И аноды, и катоды сделаны из сплава свинец+сурьма и требуют мало обслуживающих процедур.
И аноды, и катоды сделаны из сплава свинец+сурьма и требуют мало обслуживающих процедур. - Кальциевые. Здесь примесь, соответственно, кальций. Такие электроды вообще не нужно обслуживать.
- Гибридные. Один электрод, с минусом, делается из кальциевого сплава, а положительный содержит сурьму.
Можно с уверенностью утверждать, что свинцово-кислотный — самый востребованный и распространенный вид аккумулятора для авто. Принцип работы свинцового аккумулятора основывается на активном взаимодействии серной кислоты с диоксидом свинца.
Когда батарея эксплуатируется, то есть нужна электрическая энергия, на катоде свинец окисляется, а его диоксид на аноде, напротив, участвует в восстановительной реакции. При зарядке, как нетрудно догадаться, взаимодействия идут в обратную сторону.
Это все происходит за счет кислоты в электролите, часть ее распадается, соответственно, концентрация падает. Именно этим обусловлена необходимость периодически обновлять жидкость в батарее.
С гелевыми аккумуляторами такого не случается. Состояние электролита в них не позволяет ему испаряться, если, конечно, не перегреть АКБ во время подзарядки. Как правильно заряжать гелевые аккумуляторы, читайте здесь →
Именно благодаря отсутствию необходимости периодически восполнять запасы активного вещества батареи с желеобразным электролитом относят к категории необслуживаемых. Еще одно их преимущество в том, что гель не отсоединяется от электрических контактов, а значит, невозможны внезапные сбои и замыкания.
Как устроен литий-ионный аккумулятор?
Его конструкция не отличается сложностью: анод из пористого углерода, литиевый катод, пластина-сепаратор между ними и проводник тока – вещество-электролит. Во время разрядки ионы отделяются от анода и движутся на литий по электролиту, минуя сепаратор. Во время питания батареи все происходит с точностью до наоборот – литий отдает ионы, углерод принимает. Так и происходит процесс ионного круговорота между разнозарядными электродами литий-ионной батареи.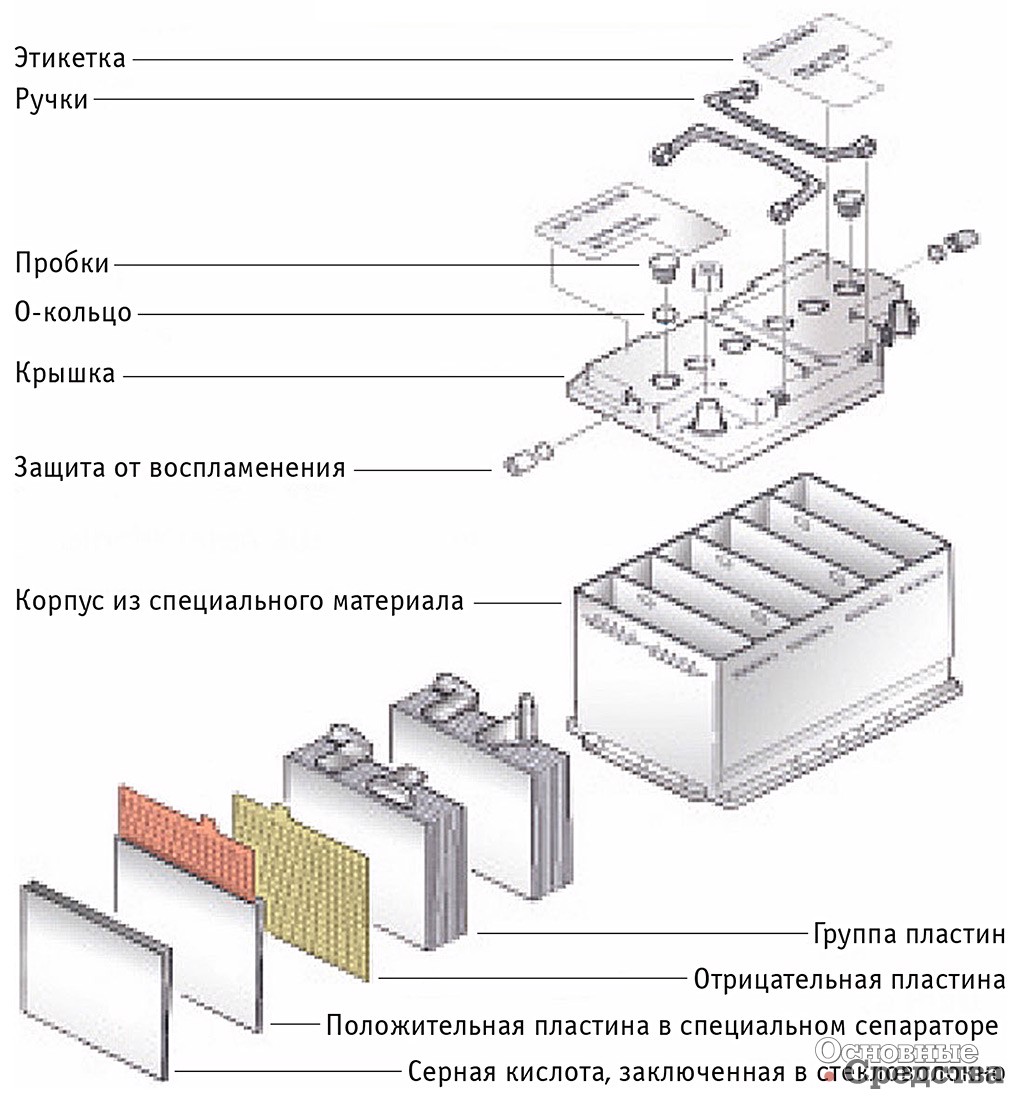
Точный состав катода может отличаться в конкретной модели или у определенного производителя АКБ. Дело в том, что многие фирмы тестируют разнообразные типы литиевых соединений для того чтобы изменять показатели устройств по своему усмотрению.
Впрочем, очевидно – улучшая одни характеристики, неизбежно приходится жертвовать другими. Чаще всего литий-ионные АКБ с повышенной емкостью, заботой об эксплуатирующих его людях и природной среде оказываются чрезмерно дорогостоящими или требуют слишком много внимания.
Но чего не отнять у батарей с литием, что составляет их принципиальную разницу с другими типами аккумуляторов, так это низкий уровень саморазряда.
Li-Pol аккумуляторные батареи
Литий-полимерные — это следующий этап развития литий-ионных АКБ. Принципиальная разница понятна из названия — в качестве электролита начинает использоваться полимерное соединение. Из-за прочности существующих в нем химических связей такой аккумулятор становится максимально безопасным, неправильная эксплуатация может сломать его самого, но не нанести вред владельцу, как это бывало с литиевыми АКБ с жидким наполнителем. Полимерный неопасно перегревать или протыкать острым предметом, в то время как жидкостной элемент уже давно бы взорвался.
Полимерный неопасно перегревать или протыкать острым предметом, в то время как жидкостной элемент уже давно бы взорвался.
Еще один огромный плюс Li-Pol батарей — их огромная проводимость. Из-за того, что в процессе реакций на анодах и катодах батарея приобретает свойства хорошего полупроводника, она способна передавать ток, в разы превышающий ее собственную электроемкость.
Щелочные батареи
Методика функционирования щелочного аккумулятора основывается на химических превращениях в щелочной среде. Именно поэтому для электродов таких АКБ применяют соединения металлов, которые активно взаимодействуют именно со щелочами.
Гидроокись никеля на электроде с положительным зарядом превращается в гидрат его закиси из-за череды реакций со свободными ионами в электролите. На катоде в это же время идут похожие взаимодействия, но только с образованием гидрата окиси железа. Между только что создавшимися веществами образуется разница в потенциалах, за счет которой и выделяется электроэнергия. В процессе подзарядки реакции те же самые, только в обратном порядке, вещества восстанавливаются до исходных.
В процессе подзарядки реакции те же самые, только в обратном порядке, вещества восстанавливаются до исходных.
Ni-Cd аккумулятор
Батареи никель-кадмиевого типа обычно применяют для некрупной техники, например, для шуруповерта. Принцип их устройства и работы схож с автомобильным АКБ, только в гораздо меньших масштабах – те же последовательно соединенные несколько маленьких батареек, совместно вырабатывающих нужные электрические показатели, а внутри них – уже знакомые аноды, катоды, пластины сепараторов и жидкий электролит.
Специфические характеристики, присущие только этому типу аккумуляторов, обеспечивают именно химические свойства никеля и кадмия. Они же накладывают и обязательство быть осторожным, особенно при утилизации. Это вызвано тем, что кадмий – довольно токсичный элемент.
При аккуратной же эксплуатации шуруповертов с такими АКБ приборы гарантированно будут работать долгое время на высокой мощности, в любых погодных и температурных условиях. К тому же их можно очень быстро заряжать.
К тому же их можно очень быстро заряжать.
Ni-MH аккумулятор
По своему устройству и механизму работы никель-металл-гидридные батареи очень похожи на кадмиевые и были изобретены практически сразу после них. Основное отличие состоит в материале, из которого изготовлен отрицательный электрод.
В аккумуляторах типа Ni-MH он состоит из особого справа металлов, которые абсорбируют водород. Часть из них реагируют с ионами электролита с выделением тепловой энергии, другая часть – с ее поглощением, в результате чего возможно безопасное и экологически безвредное использование такого устройства.
Как работает зарядное устройство для АКБ?
ЗУ для аккумулятора обычно состоит из выпрямителя и трансформатора и создает ток с постоянным напряжением около 14 вольт. Также хорошие приборы содержат элементы, которые следят за напряжением на питаемом аккумуляторе и в нужный момент выключают зарядку.
По ходу процесса работы зарядного устройства для автомобильного аккумулятора или для любого другого подаваемый им ток сам собой падает. Вызвано это тем, что в заряжающемся АКБ увеличивается сопротивление, и он больше не пропускает ток с большим напряжением. Если в зарядке есть измеритель, то он фиксирует тот момент, когда в батарее достигнуто напряжение в 12В, после чего ее можно отключать от сети.
Вызвано это тем, что в заряжающемся АКБ увеличивается сопротивление, и он больше не пропускает ток с большим напряжением. Если в зарядке есть измеритель, то он фиксирует тот момент, когда в батарее достигнуто напряжение в 12В, после чего ее можно отключать от сети.
АКБ – вещь не такая сложная, как может показаться. Ее устройство легко понять, к тому же, принцип работы одинаков для разных видов. Знать его владельцу аккумулятора хоть в машине, хоть в настенных часах, очень полезно – это поможет поступать правильно на всех этапах – выбора, обслуживания и утилизации батарейки.
Как устроен аккумулятор Тесла
Американская компания Tesla Motors некоторое время назад произвела настоящую революцию в сфере производства электромобилей. Им удалось наладить серийное производство экологически чистых транспортных средств. Причём топовые модели Tesla имели динамические характеристики, сравнимые с бензиновыми суперкарами. Электромобили объединили в себе передовые разработки инженеров компании, в числе которых была и технология создания тяговых аккумуляторных батарей. Именно об аккумуляторах для Тесла и пойдёт речь в этой статье. Мы рассмотрим, какие АКБ устанавливались и устанавливаются на американские электромобили, а также их устройство.
Содержание статьи
Разновидности аккумуляторных батарей на электромобилях Тесла
С момента запуска серийной сборки Model S, а затем и Model X, на эти электромобили устанавливались батареи, ёмкость которых лежала в диапазоне 40─100 кВтч. Они состояли 8, 12, 16 секций. Секция, в свою очередь, состоит из большого количества соединённых между собой литиевых элементов. Сначала использовались аккумуляторные элементы форм-фактора 18650 производства Panasonic. Позднее стали использовать аккумуляторные батареи форм-фактора 21700.
Их габариты зашифрованы в названии: диаметр 18 мм и высота (длина) 65 мм.
Требования к этим аккумуляторам в Tesla предъявляют довольно жёсткие, и компания Panasonic в качестве поставщика была выбрана не случайно. Японский производитель смог обеспечить выпуск качественных элементов, выдерживающих серьёзные нагрузки.
На изображениях ниже можно посмотреть схематическое устройство силовой части электромобиля Tesla.
Как уже было сказано, аккумуляторная батарея состоит из нескольких блоков, которые в свою очередь делятся на много отдельных аккумуляторных элементов. Это схематично показано на рисунке ниже.
Вернуться к содержанию
Какие виды аккумуляторов для Tesla выпускались?
- 40 кВтч. Эти тяговые АКБ были двух типов: из 8 и 12 модулей. Первые были сделаны на базе батареи для модели Тойота RAV4 EV. Аккумулятор из 12 блоков имел номинал 60 кВтч, но программно был ограничен на отметке 40 кВтч. Выпуск этих моделей был довольно быстро прекращён из-за низкого спроса на Tesla Model S 40 кВтч.
- 60 кВтч. Выпускались модификации с 12 или 16 секциями. Первые использовались на Model S40. Модификация с 16 модулями представляла собой модифицированный вариант, который выпускался с обозначением «New».
- 70/75 кВтч. Эти модели использовались на Model S60 (S60D), S70 (S70D), S75 (S75D). Для S60 использовались модификации с номиналом 60 кВтч, имеющие на 77 аккумуляторных элементов меньше, чем в моделях S70. В последних все модели были загружены целиком.
- 85/90 кВтч. Модификации номиналом 85 и 90 кВтч (и 100 также) состоят из 16 модулей. Каждый из них имеет в своём составе 444 литиевых элемента и плату управления, управляющую их зарядом, разрядом и балансировкой. Наиболее популярным аккумулятором для Tesla стал 85 кВтч, имеющий в своём составе 7104 элементом форм-фактора 18650.
Специалисты Panasonic в 2015 году усовершенствовали конструкцию анода литиевых аккумуляторных элементов, в результате чего ёмкость аккумулятора увеличилась на 6 процентов. Так появились АКБ с номиналом 90 кВтч.
Ёмкость батарей Panasonic 18650 в батарее 85 кВтч весит 46 грамм. В модели 90 кВтч масса такого элемента 48,5 грамма. Кроме того, усовершенствованный элемент увеличил токоотдачу с 10C (80) до 25C (90). Этим объясняется наличие режима Ludicrous только на электромобилях Tesla c АКБ 90 и 100 кВтч. Только с ними стало возможным наращивание динамических характеристик.
100 кВтч. Это наиболее мощная версия. Инженеры Tesla изменили внутреннюю конфигурацию аккумуляторной батареи и в каждом модуле разместили 516 элементов 18650. В результате всего в АКБ разместились 8256 штук. Запасённая энергия составила более 100 кВтч. Электромобиль на таком аккумуляторе пробегает около 500 км. Токоотдача составила 25C.
Это стало наилучшим результатом. Но специалисты на этом не остановились и исследования продолжаются. Для повышения эффективности АКБ и уменьшения издержек Tesla возвели в населённом пункте Спаркс (штат Невада) крупный аккумуляторный завод, получивший название Gigafactory 1.
По данным некоторых зарубежных изданий на фабрике Gigafactory 1 запустили сборку АКБ для электромобилей Tesla с использованием элементов форм-фактора 21700. Диаметр этих цилиндрических аккумуляторов 21 мм, а длина 70 мм.
Их сначала применяли в батареях Tesla Powerpack и Powerwall, а затем в новом Model 3. Этот седан уступает по размерам Model S. Сообщается, что энергоэффективность 21700 выше 18650 на 10─15 процентов. При этом объём запасаемой энергии выше на 46 процентов.
Предприятие Gigafactory выпускает литий-ионные аккумуляторные батареи на основе сотрудничества Tesla Motors и Panasonic. Японская компания уже длительное время работает с американским производителем электромобилей и вложили в их предприятие Solar Roof миллиард долларов. Около двух лет назад появлялись сообщения о том, что фабрика Gigafactory вышла на ежегодный объём производства аккумуляторных батарей 30─35 ГВтч в год.
На вышеупомянутом предприятии работает больше 6 тысяч человек и планируется значительное расширение штата. Строительство завода обошлось в сумму около 5 млрд долларов США.
Вернуться к содержанию
Что внутри?
Поскольку электромобиль Tesla является весьма дорогим транспортным средством, не каждый владелец может позволить себе распотрошить на камеру его аккумуляторную батарею. Кстати, стоимость аккумулятора составляет 40─50 тысяч $. Но такие энтузиасты нашлись. Несколько лет назад на просторах англоязычного интернета появились фотографии разбора модели 85 кВтч.
Аккумуляторная батарея находится в дне кузова и крепится к нему за кронштейны. Благодаря большой массе АКБ обеспечивается низкий центр тяжести и хорошая управляемость моделей Tesla.
Внутри можно обнаружить 16 модулей, соединённых параллельно. От попадания влаги и просто внешнего воздействия сделана защита в виде пластин из металла и пластиковых вставок. На фото можно видеть, как измеряют напряжение.
Сами аккумуляторы находятся близко друг к другу в специальных ячейках. Укладка осуществляется в автоматическом режиме промышленным роботом.
В модулях аккумуляторные элементы также подразделяются на группы по 74 элемента. Их работой управляют электронные платы, которые с натяжкой можно назвать аналогом BMS плат для аккумуляторов ноутбуков. Всего в АКБ 85 кВтч 7104 литий-ионных аккумуляторных элементов. Предусмотрена жидкостная система охлаждения.
Номинальное напряжение одного элемента составляет 3,6 вольта. При производстве отрицательного электрода используется никель, кобальт, оксид алюминия (LiNiCoAlO₂ в процентном отношении никеля ─ 80, кобальта ─ 15, алюминия ─ 5 процентов), а для изготовления положительного электрода применяется графит. Производство самих Panasonic 18650 выполняется в различных странах, среди которых Китай, Индия и др. Однако финальная проверка и сборка выполняется на предприятии Tesla в США.
Общий вес аккумуляторной батареи 85 кВтч составляет 540 кг. Габариты представлены ниже.
- Длина 2,1 м.
- Ширина 1,5 м.
- Толщина 0,15 м.
Компания осуществляет гарантийное обслуживание батарей своего производства в течение восьми лет.
Позднее в общем доступе появились изображения разобранной АКБ, сделанные Джейсоном Хьюзом, одним из владельцев Tesla. На этот раз аккумуляторная батарея заявленная мощность была 100 кВтч.
Как удалось выяснить Хьюзу, реальная ёмкость батареи составила 102,4 кВтч. Чтобы выяснить реальные характеристики этой модели, он получил доступ в систему управлении питанием электромобиля. Он хотел проверить утверждения представителей Tesla о том, что батарея претерпела серьёзную модернизацию. В частности, сообщалось об обновлении архитектуры, системы охлаждения и электронной начинке.
Хьюзу удалось выяснить, что теперь в одном модуле АКБ находится 516 элементов, а суммарное количество составляет 8256 штук. По сравнению с предшествующими моделями 85/90 кВтч увеличение составило около 16 процентов. В модуль, по его словам, добавили несколько рядов для элементов. Контуры охлаждения стали более тонкими и короткими (в модуле два). В результате хладагент забирает тепло от меньшего количества элементов.
Новые аккумуляторы сохранили совместимость с различными модификациями Tesla Model X и Model S. Кроме того, по словам представителей компании, новые решения, реализованные в батарее, позволили им выпустить Model 3. Хьюз показал, что конструкция подключения охлаждающей системы, а также разъёма кабелей высокого и низкого напряжения осталась прежней. Как видно на фотографиях, коннекторы можно без проблем заменить.
Вернуться к содержанию
Направление развития
Новые электромобили Tesla Model 3 имеют запас хода более 300 км. Информация о развитии будущих аккумуляторных батарей для Тесла в основном непроверенная. Были сообщения, что при сборке будут использовать литиевые элементы стандарта 21700 (диаметр 21 мм, длина 70 мм). Стоимость этих батарей будет немногим более 110$ за 1 кВт. По сравнению с альтернативными решениями это довольно дёшево. В модуль будут входить 4 базовых элемента с охлаждающим контуром, а вокруг них будут располагаться литиевые элементы 21700.
Химический состав: LiNiCoAlO2 (литий-никель-кобальт-оксид алюминия c 80% никеля, 15% кобальта, 5% алюминия). Представители Tesla называют такой состав главным преимуществом их АКБ по сравнению с другими решениями. В частности, по их утверждению, на Model 3 устанавливаются батареи с наивысшей плотностью энергии из всех возможных.
Это было достигнуто благодаря существенному снижению содержания кобальта в катодной химии и увеличении объёма никеля. Им удалось сохранить отличные показатели температурной стабильности. По непроверенной информации, содержание никеля, марганца и кобальта в катоде будет в соотношении 8:1:1.
Специалисты фирмы Benchmark Mineral Intelligence вообще считают, что усовершенствованная технология производства аккумуляторных батарей для электромобилей Tesla может серьёзно ударить по кобальтовой промышленности. Это уже привело к серьёзному сокращению использования кобальта для производства аккумуляторов. В среднем со времени выхода на рынок Model S первого поколения компания Тесла сумела сократить потребление кобальта на один электромобиль в среднем на 59%. Если Model S требовала для производства 11 кг кобальта, то современный экземпляр Model 3 требует лишь 4,5 кг.
Сведения об этом содержались в отчёте компания Тесла за I квартал 2018 года. Илон Маск и технический директор Tesla Дж. Б. Страубель не раз заявляли, что направляют большие усилия для сокращения потребления кобальта. Это необходимо, чтобы сократить суммарные затраты на 1 кВт-ч при производстве батарей. Ведь кобальт является одним из наиболее дорогостоящих компонентов, используемых в производстве аккумуляторов для электромобилей Тесла. Как показывают данные OilPrice, его стоимость превышает 90 тысяч долларов за тонну.
В то же время, конкурирующие с Tesla компании из Японии, Германии, США, Южной Кореи пока отстают по технологии производства аккумуляторных батарей. За счёт них ещё некоторое время поставщики кобальта будут сохранять объёмы сбыта и компенсируют потери закупок со стороны Тесла.
Вернуться к содержанию
Зарядка и деградация аккумуляторов
Что касается деградации аккумуляторных батарей, то последние модели Тесла демонстрируют потерю ёмкости на 10% после пробега 160 тысяч миль (чуть менее 260 тыс. км). Как показывают исследования, большинство аккумуляторов теряют 5% своей ёмкости за первые 80 тыс. км. После этого ёмкость выравнивается и деградация существенно замедляется.
Одно из ключевых требований к АКБ электромобилей заключается в том, чтобы они могли заряжаться быстро. Особенно это чувствительно, если вы находитесь в пути. Бытовая электросеть переменного тока 240 вольт способна заржать аккумуляторы с помощью ЗУ мощностью 10 кВт. В электромобиле имеется схема, выпрямляющая переменный ток. Благодаря схеме он превращается в постоянный ток. Подобный вариант для полного заряда требует несколько часов и подходит, если электромобиль стоит у вас дома или в гараже ночью.
Чтобы решить проблему зарядки в пути, Tesla установили зарядные станции постоянного тока Supercharger по всему миру. Они обеспечивают мощность до 135 кВт. DC заряжает аккумулятор в обход схемы зарядки. В результате на заряд батареи уходит 20─40 минут.
Когда речь идёт о зарядке аккумуляторов электромобилей, в целом, и Тесла, в частности, то следует сказать об ограничениях литий-ионных элементов. К примеру, максимальное зарядное напряжение для Panasonic 18650 равно 4,5 вольта. Производитель установил допустимый ток на один элемент величиной в 2 ампера. Инженеры Тесла увеличили его до 4 А. С таким током зарядки могут эксплуатироваться новые элементы 21700. Они будут основой аккумуляторов для Tesla Model 3.
Из-за этих ограничений возникает верхний предел мощности зарядного устройства, которое можно использовать для зарядки аккумуляторов. Максимальная мощность вычисляется по формуле 4,2 * N * I. Здесь N означает число элементов в блоке, а I — это максимально разрешённый ток на один элемент. Для используемых в Tesla аккумуляторах значения получаются следующие.
- 85/90 кВтч. Мощность = 7104 х 16,8 (4,2*4) = 119,3 кВт.
- 100 кВтч. Мощность 8256 Х 16,8 = 138,7 кВт.
Дальнейшее увеличение мощности зарядки возможно лишь при наращивании зарядного тока. Но это ускорит деградацию литиевых элементов. Гарантию компания Tesla обеспечивает от отказа и поломок, но не от деградации. Но работа элементов обеспечивается таким образом, что деградация идёт всего лишь на 1─2% в год.
Вернуться к содержанию
Опрос
Примите участие в опросе!
Загрузка …Если статья оказалась для вас полезной, распространите ссылку на неё в социальных сетях. Это поможет развитию сайта. Исправления и дополнения к статье, а также ваши отзывы об аккумуляторах Tesla, оставляйте в комментариях ниже. Голосуйте в опросе и оценивайте статью.
Вернуться к содержанию
Особенности графеновых аккумуляторов для электромобилей
Для работы различной техники, функционирование которой связано с электричеством, широко применяются источники энергии. Они не зависят от розеток и прочих факторов, то есть являются независимыми. Самый наглядный пример — это аккумулятор в машине.
АКБ в среднем служат 3-4 года, после чего их выводят из эксплуатации и утилизируют. Также аккумуляторы отличаются сравнительно небольшой ёмкостью, а в некоторых случаях низкой степенью надёжности.
Минусы в виде небольшого срока службы и малой ёмкости хотят устранить, используя графеновые батареи. Но говорить об их массовом внедрении в автомобили сейчас слишком рано. Нужно взглянуть на их перспективы.
Что это такое
Специалисты давно ведут работу над поиском материалов, которые можно эффективно использовать для создания АКБ. Но пока свинцовые пластины так и остаются основой. Они совершенно не удовлетворяют запросы современных электромобилей и экологического транспорта.
Огромный шаг вперёд в этом направлении удалось сделать в 2004 году. Именно тогда двоё учёных из Великобритании сумели создать в лабораторных условиях новое вещество. Оно изготовлено на основе углерода и носит название графен. Через 6 лет за свою разработку они удостоились Нобелевской премии.
Графен — это одна из разновидностей графита. В состав вещества входят атомы углерода. Кристаллы материала напоминают листы бумаги, которые сложены в большое количество слоёв.
Кристаллическая структура графена
Тут стоит учесть свойства графита. Его атомное взаимодействие между слоями является слабее, нежели в середине. Из-за этого графит широко применяют при производстве карандашей. В итоге учёные расщепили графит на слои, и создали новое вещество. Свойства получились такими же, только усиленными в несколько раз.
Подобные разработки дали новый серьёзный толчок в развитии электроники, а также новых видов батарей и аккумуляторов. Графит по своей природе обладает высокой электропроводностью и отлично проводит тепло. В итоге графен стал заменителем для целого ряда дорогостоящих материалов. Поскольку графит доступен в природе в больших количествах, то с производством графена на его основе проблем не возникает.
Как устроены аккумуляторы
Многих интересует вопрос устройства графеновых аккумуляторов для электромобилей, которые активно развиваются и производятся в настоящее время.
Если говорить о том, как устроен изучаемый графеновый аккумулятор, и на основе каких принципов он работает, то тут существенного отличия от АКБ для машин с двигателем внутреннего сгорания нет. Разница только в протекающих внутри электрохимических процессах.
В большей степени они напоминают реакцию, которая наблюдается в батареях литий-полимерного типа.
Важно отметить, что сейчас акцент делается на 2 технологиях в сфере создания аккумуляторов с графеном. Одна из них разрабатывается в США, а над второй работают российские специалисты.
- Американская модель предусматривает использования кобальтата лития и катода, основанного на графеновых и кремниевых пластиках.
- Российская версия — это магний-графеновый источник питания. Здесь применяют не литиевую соль в качестве анода, а оксид магния. Последний отличается ценовой доступностью и более низкими показателями токсичности.
В двух моделях АКБ ионы на увеличенной скорости проходят между анодами и электродами батареи, что обусловлено высокой электропроницаемостью материала, а также его свойствами накапливать заряды электричества.
Специалисты из США и России расходятся во мнении относительно возможных показателей ёмкости. Американские разработчики уверены, что им удастся поднять ёмкость до показателей, в 10 раз превышающих возможности литий-ионных АКБ. Российские учёные делают более приземлённые прогнозы. По их мнению, ёмкость увеличится в 2-3 раза.
Какие характеристики в итоге приобретут графеновые аккумуляторы, и смогут ли их использовать для оснащения электромобилей так же, как и литий-ионные АКБ, говорить сложно. Но у учёных оптимистичные прогнозы.
Как это работает
Ранее уже говорилось, что графеновый перспективный аккумулятор работает на основе тех же электрохимических реакций, которые актуальны для свинцовых батарей с щелочным или кислотным типом электролита внутри. А по устройству они напоминают больше литий-ионные источники питания.
Нюанс в том, что в качестве катода применяют угольный кокс. Это обусловлено его химической близостью к чистому углероду. Вместо графитового слоя используется графен.
Ёмкость источника питания зависит от количества ионов, находящихся на кристаллической решётке используемого анода. То, с какой скоростью перемещаются ионы, влияет на скорость зарядки АКБ.
Чтобы увеличить ёмкость, между слоями графена начали устанавливать специальные кластеры. Они выполнены из кремния. С целью увеличения скорости зарядки в пластины на основе графена добавили отверстия. Их размер составляет буквально 15-20 нм.
То есть принцип работы рассматриваемого графенового аккумулятора основан на электрохимических реакциях. Только скорость их течения выше, и накапливаемый заряд больше. Это даёт возможность увеличить эксплуатационные характеристики устройства.
Несмотря на отличия в технологиях разработки, принцип работы для любого графенового аккумулятора остаётся пока идентичным. Возможно, специалисты внесут свои точечные изменения. Но база или основа работы таких источников питания одинаковая. Вопрос лишь в том, кому удастся максимально эффективно реализовать на практике все имеющиеся знания.
Преимущества и недостатки
Чтобы сделать определённые выводы про графеновые аккумуляторы, стоит взглянуть на их плюсы и минусы.
Да, это перспективная технология. Да и имеющиеся достоинства об этом наглядно говорят. Хотя и без недостатков здесь не обошлось. Даже в условиях, когда массово батареи ещё даже не начали выпускать.
Если говорить про плюсы и минусы, которыми характеризуются графеновые аккумуляторы, то на эти АКБ стоит взглянуть со всех сторон.
Для начала о сильных качествах перспективной технологии:
- Батареи имеют небольшой вес. Они значительно легче в сравнении со свинцово-кислотными аналогами или другими источниками питания, используемыми в автомобилях. На 1 квадратный метр графена приходится всего 0,77 грамма веса.
- Высокие показатели проводимости. В плане этой характеристики графен в разы лучше, чем ряд других полупроводниковых материалов.
- Прочность и водонепроницаемость. Также важные характеристики, учитывая условия эксплуатации автомобилей и прочего транспорта, где такие АКБ могут использоваться.
- Экологичность. В отличие от свинца и жидкого электролита, АКБ на основе графеновой технологии не будут загрязнять окружающую среду. Это решение ещё одной важной современной проблемы.
- Удельная ёмкость. Отличные показатели. Потенциально графеновые батареи способны демонстрировать около 1000 Вт/ч на 1 кг.
- Возможность регулировки свойств. Это достигается за счёт сочетания и комбинирования с графена с другими используемыми материалами.
- Доступность сырья. В качестве сырья для получения графена используется графит. А это распространённый, доступный и недорогой материал.
Но не всё так радужно. Технология имеет ряд недостатков.
Исследователи говорят, что из-за плотности сделать АКБ компактными невозможно. Поэтому перспективы использования технологии в мобильных устройствах сомнительные. Батареи получаются массивными. Специалисты пытаются решить этот вопрос. Но пока ни одного серийного образца не выпустили.
С позиции автомобильной сферы всё намного интереснее. Потенциальный переход на графеновую технологию способен увеличить пробег актуальной Tesla Model S с 400 до 1000 км. без подзарядки.
Электромобиль Tesla Model S
На саму подзарядку батареи потенциально достаточно потратить 10-15 минут. Но при условии наличия мощной зарядной станции. Специалисты уверены, что такой вопрос решается довольно легко.
Проблема в литии, который также применяется при создании графеновых источников питания. Этого вещества в природе не так много. Полностью удовлетворить потребности автомобильной отрасли не получится. Поэтому ведутся работы над тем, чтобы вместо лития использовать магний.
Актуальные разработки
Уже сейчас на рынке представлены зарядные блоки (powerbank) от компании Real Graphene. Они основаны на графеновой технологии и позволяют за считанные минуты зарядить смартфон или планшет.
Их аккумулятор способен выдержать порядка 1500 циклов зарядки, не теряя свои изначальные технические характеристики. При этом девайс не генерирует большое количество тепла, остаётся холодным и безопасным во время работы.
Если говорить про машины, то буквально недавно китайская компания GAC заявила о том, что собирается тестировать графеновые источники питания. Их установят на автомобиль и проверят в реальных условиях эксплуатации.
Китайцы считают, что электромобиль с таким источником питания сможет получить 85% заряда всего за 8 минут.
Первые тесты ожидаются в конце 2020 года, либо в начале 2021 года. Пандемия внесла свои коррективы. В итоге результаты покажут, будет ли компания запускать массовое производство.
Ожидаемая стоимость нового электрического китайского автомобиля составит 30,5 тысяч долларов. При этом порядка 40% от стоимости это цена батареи.
Схема разработки 3DG
Графеновую технологию специалисты GAC начали осваивать ещё с 2014 году. За 4 лет активной работы удалось создать 3DG. Это трёхмерный графеновый материал. В ноябре 2019 года была официально проведена презентация сверхбыстрой аккумуляторной батареи для зарядки.
Перспективы технологии
Уже сейчас графеновые источники питания постепенно внедряются в разные отрасли. Это электроника, мобильные гаджеты, электрические машины и пр. Это только начало.
Графеновый аккумулятор при производстве электромобиля
Многие эксперты уверены, что в ближайшее время состоится настоящий прорыв в сфере создания новых источников питания. И всё это благодаря графену.
В науке, промышленности и других сферах открываются огромные перспективы. Более того, графеновые батареи ожидает внедрение в обычные хозяйственные цели.
Специалисты считают, что в случае начала массового производства батарей и источников питания на базе графена появятся:
- новые электромобили с огромным запасом хода;
- современные производственные линии;
- электростанции с высокой эффективностью работы;
- специальные заправочные станции;
- компактные батареи для мобильных устройств.
Также это огромный шаг в решении экологической проблемы загрязнения выхлопными газами.
Перспективы по состоянию на конец 2020 года у графеновых АКБ намного радужнее и оптимистичнее, нежели ещё 2-3 года назад.
Что вы знаете о графеновых аккумуляторах? Где-то с ними сталкивались? Насколько перспективной считаете эту технологию и почему? Действительно ли все электрокары перейдут на такие батареи?
Ждём ваших ответов в комментариях.
Подписывайтесь, оставляйте отзывы, задавайте вопросы и рассказывайте о нашем проекте своим друзьям!
Как устроена батарейка? Принципы работы батарейки
Кто изобрел батарейку?
Если верить археологам, то первые батарейки появились еще 2000 лет назад. Во время раскопок в Ираке нашли глиняную вазу, залитую битумом, в который были вделаны медный и железный стержень. Действительно ли это использовалось в качестве источника электричества, трудно сказать — это всего лишь предположения.
Первой современной батарейкой по праву можно назвать «Вольтов столб» — устройство, созданное итальянским физиком Алессандро Вольта в 1800 году.
Алессандро Вольта
«Вольтов столб» представлял собой стопку из пластин разных металлов — цинковых и медных. Между ними клалась ткань, смоченная в кислоте. Химическая реакция между элементами «Вольтова столба» создавала электричество.
Вольтов столб
Его работа основывалась на предположениях Луиджи Гальвани, который проводил опыты с лягушкой, подводя к ее лапке металлические полоски.
Луиджи Гальвани
Однако, Л. Гальвани сделал неправильные выводы, решив, что само животное обладает электричеством, назвав это «животным электричеством». А. Вольта правильно понял, что разряд возникал из-за того, что лапка, находившаяся между двумя полосками металла, была влажной и служила в качестве проводника.
По имени Л. Гальвани «Вольтов столб» и другие источники электричества подобного типа получили название «Элемента Гальвани» или «Гальванического элемента». Это, на самом деле, более правильное название для таких устройств, так как батарейка — это батарея, т.е. серия гальванических элементов, соединенных между собой. А единицу напряжения, которую давал гальванический элемент, назвали «вольтом» в честь Алессандро Вольта.
Принцип работы батарейки
Во многом принцип работы батарейки тот же, что и в изобретении Вольта, несмотря на технологический прогресс в их изготовлении. Любая батарейка устроена схожим образом, в ней обязательны три элемента, между которыми происходит химическая реакция, в результате которой возникает электричество: электроды — анод, катод, и электролит.
Устройство батарейки
Все эти элементы присутствовали изначально и в «Вольтовом столбе». В качестве анода, который является источником электронов, выступает чаще всего цинк. Электролит — как правило, специальное вещество (соль, щелочь), через которое осуществляется взаимодействие электродов между собой. Анод обозначается как «-» (минус), а катод — как «+» (плюс).
Какие бывают батарейки?
Батарейки бывают, в основном, солевыми и щелочными. Жидкие электролиты в них не используются, их определенным образом сгущают, например, при помощи крахмала.
Солевые батарейки, изобретенные в 1865 году — наиболее дешевые в изготовлении, для их производства используют уголь, цинк и хлорид аммония (в качестве электролита). Помимо простоты изготовления и дешевизны, имеют такие недостатки, как окисление, засоливание цинковой оболочки, что приводит солевую батарейку в негодность.
Щелочные батарейки имеют маркировку Alkaline, хранятся они дольше и дают более стабильное напряжение.
Щелочные батарейки
В принципе, это те же солевые батарейки, однако, разница между солевыми и щелочными батарейками заключается в том, что элементы в них расположены в обратном порядке, а цинк находится в порошкообразном состоянии, что увеличивает контакт элементов батареи между собой, делает их более надежными. Щелочные батарейки имеют гораздо больший объем заряда, что позволяет их использовать в энергоемких приборах (цифровых фотоаппаратах, фонариках, электронные игрушки с электродвигателями и т.п.). Они долговечны, лучше справляются с работой при низких температурах.
Наиболее современны литиевые батарейки (литий входит в состав анода), которые долговечны и безопасны в работе однако, дороже в производстве.
Литиевые батарейки
К их преимуществам по сравнению с щелочными можно отнести возможность создавать максимально плоские батареи, изготавливать батареи с большим количеством вариантов напряжения, долговечность — в некоторых приборах они могут работать до 15 лет! Их используют в наручных часах, калькуляторах, памяти системной платы компьютера и других приборах.
Проблема всех батареек — необратимость химических реакций. При использовании или с течением времени анод разрушается, либо покрывается продуктами окисления и перестает работать. В таких случаях мы говорим, что батарейка села. Но прогресс не стоит на месте — оказалось, что соединив определенным образом вещества, входящие в состав батареи, можно, пропустив ток через нее, вернуть в прежнее состояние. Такие батареи назвали аккумуляторами — работа батареи в них восстанавливается посредством пропускания электричества в обратном направлении, от катода к аноду. А сам процесс мы все знаем, как «зарядку», т.е. батарея «заряжается». Обычные батареи, рассмотренные выше, заряжать, конечно, нельзя, они для этого не приспособлены — это может привести к их течи или взрыву.
Как работают батареи | dummies.com
- Программирование
- Электроника
- Как работают батареи
Часть электроники для детей Для чайников Шпаргалка
Вы когда-нибудь смешивали уксус с пищевой содой, чтобы создать вулкан для проекта научной выставки? Пузырьки, которые вы видите, — это результат химической реакции. Эта реакция очень похожа на , как работают батарейки. Однако реакция происходит внутри батареи, скрытой от глаз отсеком для батареи.Эта реакция создает электрическую энергию, которую батарея подает в цепи.
Обычная батарея, такая как батарейка AA или C, имеет корпус или контейнер. Внутри корпуса залита смесь катода и , состоящая из заземленного диоксида марганца и проводников, несущих естественный электрический заряд. Далее идет сепаратор . Эта бумага предохраняет катод от контакта с анодом, несущим отрицательный заряд. Анод и электролит (гидроксид калия) находятся внутри каждой батареи.Штырь, обычно сделанный из латуни, образует коллектор отрицательного тока и находится в центре корпуса батареи.
Каждая батарея имеет элемент, содержащий три компонента: два электрода и электролит между ними. Электролит представляет собой раствор гидроксида калия в воде. Электролит — это среда для движения ионов внутри элемента и переносит символический ток внутри батареи.
Положительная и отрицательная клеммы аккумулятора подключены к двум различным типам металлических пластин, известных как электроды , , которые погружены в химикаты внутри аккумулятора.Химические вещества вступают в реакцию с металлами, в результате чего избыточные электроны накапливаются на отрицательном электроде (металлическая пластина, подключенная к отрицательной клемме батареи) и вызывая нехватку электронов на положительном электроде (металлическая пластина, подключенная к положительной клемме батареи).
Батарейки для фонарей или меньшие по размеру, обычно маркированные A, AA, C или D, имеют выводы, встроенные в концы батарей. Вот почему батарейный отсек вашего фонарика имеет знаки + и -, что упрощает установку батарей в правильном направлении.У более крупных аккумуляторов, таких как автомобильные, есть клеммы, выходящие из аккумулятора. (Обычно они выглядят как большие винтовые крышки.)
Разница в количестве электронов между положительной и отрицательной клеммами создает силу, известную как напряжение . Эта сила хочет выровнять команды, так сказать, выталкивая лишние электроны от отрицательного электрода к положительному. Но химические вещества внутри батареи действуют как преграда и не позволяют электронам перемещаться между электродами.Если существует альтернативный путь, который позволяет электронам свободно перемещаться от отрицательного электрода к положительному электроду, сила (напряжение) будет успешно толкать электроны по этому пути.
Когда вы подключаете батарею к цепи, вы обеспечиваете альтернативный путь для электронов. Таким образом, избыточные электроны уходят из батареи через отрицательный вывод через цепь и обратно в батарею через положительный вывод. Этот поток электронов — это электрический ток, который передает энергию в вашу цепь.
Когда электроды соединяются через цепь, например, клеммы внутри фонарика или в вашем автомобиле, химические вещества в электролите начинают реагировать.
По мере того, как электроны проходят через цепь, химические вещества внутри батареи продолжают реагировать с металлами, избыточные электроны продолжают накапливаться на отрицательном электроде, а электроны продолжают течь, чтобы попытаться уравнять ситуацию — до тех пор, пока есть полный путь для текущий. Если вы держите батарею подключенной к цепи в течение длительного времени, в конечном итоге все химические вещества внутри батареи израсходуются, и батарея умирает (она больше не поставляет электрическую энергию).
Электролит окисляет цинк, приводимый в действие анодом. Катодная смесь диоксида марганца и углерода реагирует с окисленным цинком с образованием электричества. Взаимодействие между цинком и электролитом постепенно замедляет действие элемента и снижает его напряжение.
Коллектор представляет собой латунный штифт в середине ячейки, который проводит электричество во внешнюю цепь.
Обратите внимание, что два электрода в каждой батарее сделаны из двух разных материалов, оба из которых должны быть электрическими проводниками.Один из материалов отдает электроны, а другой их принимает, в результате чего ток течет.
Об авторе книги
Кэтлин Шейми — инженер-электрик и писатель в области высоких технологий с обширным инженерным и консультационным опытом в области медицинской электроники, обработки речи и телекоммуникаций.
Как работают батареи — Адам Якобсон
Вскоре вслед за вольтовской грудой последовало несколько достижений.Британский химик Джон Фредерик Даниэлл заменил соленую воду раствором сульфата меди, который на поверхности меди превращался бы в чистую медь. Медь больше не была плоской тарелкой, а медным горшком с раствором, цинковым стержнем и пористым глиняным горшком, разделяющим их. Ячейка Даниэля могла генерировать до 1,1 Вольт без проблем с газообразным водородом, что является значительным улучшением по сравнению с короткоживущей батареей Вольта, которая измеряла всего 0,8 вольт. Французский ученый Жорж Лекланше улучшил это в 1866 году — он заменил медь и сульфат меди на углеродный стержень, находящийся в растворе, содержащем оксид марганца IV, который восстанавливается до оксида марганца (III).Это повысило напряжение до 1,4 В и нашло широкое применение в телеграфах и ранних телефонах. Однако эта «батарея» все еще была стеклянной банкой, наполненной отвратительными химическими растворами.Патент 1892 года, выданный немцу Карлу Гасснеру, признал «сухой элемент» с использованием пасты оксида марганца IV, которая удаляла как можно больше воды. Эти сухие элементы можно использовать в любой ориентации без проливания, и их базовая конструкция до сих пор можно увидеть в дешевых, подверженных утечкам угольно-цинковых батареях стандартных размеров (1.5-вольтовые AAA, AA, C, D и 9-вольтовые элементы, которые представляют собой всего лишь 6 небольших 1,5-вольтовых элементов, соединенных вместе — проверьте, как взломать батарею на 9 вольт! Вы будете удивлены! Щелочные батареи — более современная альтернатива, в которой используются различные химические основания, которые не разъедают металлическую банку. Они появляются в нашей жизни во всех мыслимых формах и размерах.
Выбор вещества для использования в батарее зависит от того, какой электрохимический потенциал или напряжение может быть создано в результате реакций окисления и восстановления. Реактивные металлы, такие как литий или кальций, с большей вероятностью окисляются, теряя электроны и превращаясь в водные ионы.Другие металлы менее склонны к окислению, поэтому они чаще встречаются в чистом металлическом состоянии (например, медь, серебро или золото). Стандартный восстановительный потенциал показывает, какое напряжение может быть создано в процессе окисления или восстановления. Металлы с высоким положительным потенциалом восстановления генерируют напряжение, когда их ионы восстанавливаются до металла (золото = +1,68 В, серебро = +0,80 В). Металлы с низким отрицательным потенциалом восстановления генерируют напряжение за счет окисления, превращаясь в ионы (литий = -3.05 В, кальций = -2,87 В). Вот почему большинство людей знакомы с твердым золотом, но очень немногие могут идентифицировать твердый кальций. Кальций встречается в природе в ионной форме, обычно связанной с чем-то другим. Ионы кальция и карбонат-ионы составляют известняк и мрамор. Серебро и золото стабильны как твердые металлы, поэтому мы используем их для украшений и монет. Дополнительная информация по этой теме есть в Chemistry of Batteries.
Батареи — это устройства хранения энергии, поэтому они на самом деле не столько генерируют энергии, сколько просто содержат ее в химическом состоянии своего содержимого.Это похоже на толкание мяча в гору — энергия, используемая для его подъема, сохраняется на высоте мяча в виде потенциальной энергии гравитации. Ее можно превратить в кинетическую энергию, позволив мячу скатиться с холма. Перезарядка аккумулятора похожа на толкание мяча в гору, а использование аккумулятора похоже на скатывание вниз. Однако эти процессы передачи энергии никогда не бывают эффективными на 100%. Подобно тому, как мяч, толкаемый в гору, испытывает трение, перезаряжаемая батарея теряет энергию в виде тепла.Большинство людей могут сказать вам, что работающее зарядное устройство обычно теплое на ощупь. Батареи также не держат заряд бесконечно — их реакции могут происходить медленно, даже когда они не подключены к цепи. Отсоединение аккумуляторов от устройств, когда они не используются, и их использование вскоре после зарядки — лучший способ повысить эффективность аккумуляторов! Попробуйте и посмотрите, что произойдет!
Аккумуляторная вода (ПОЧЕМУ ДИСТИЛЛИРОВАННАЯ ВОДА ДЛЯ АККУМУЛЯТОРА?)
Мы все были там: STUCK
… посреди трассы, ничего кроме разбитых надежд и разряженной батареи.
Слышали ли вы про старый трюк с водой из аккумулятора от механиков и техников о возвращении к жизни разряженного автомобильного аккумулятора (и даже больших свинцовых аккумуляторов) … с ЧТО? Дистиллированная вода?
Вы даже представить себе не могли, насколько хорошо эти две вещи работают вместе. Хотя это не полностью восстанавливает аккумулятор, вы, безусловно, можете рассчитывать на то, что это даст вашему автомобилю второе дыхание, которое может выполнить свою работу.
С другой стороны, если вы хотите узнать больше о том, как дистиллированная вода может повлиять на аккумулятор вашего автомобиля, вы определенно попали в нужное место. Читайте ниже.
Сделка с аккумуляторами и аккумуляторной водой
Использование дистиллированной воды для аккумуляторных блоков продлевает срок службы аккумуляторов и повышает производительность и эффективность. Следует отметить одну интересную вещь: обычная водопроводная вода мало помогает батарее. В лучшем случае, это даже способствует повреждению аккумулятора и сокращению срока его службы.
Причина этой уловки кроется в способе работы батарей. Чтобы понять механику уловки с дистиллированной водой, важно понять, как работает батарея, и это даст нам ключ к пониманию того, как вода в вашей батарее играет важную роль.
Аккумулятор при поломке образует три основных участка, из которых он потребляет электрические токи. Это:
- сепаратор
- электроды
- электролит
Эти три компонента работают вместе, создавая химическую реакцию, которая высвобождает электрический ток из аккумулятора.
Различные автомобильные аккумуляторы могут использовать различные химические комбинации для генерации этого электрического тока. Одна из наиболее распространенных комбинаций — это диоксид свинца и свинец.
Зачем нам аккумуляторная вода? Вот что происходит внутри батареи:
- Когда аккумулятор подключен к автомобилю и вы пытаетесь завести его, диоксид свинца и губка свинца в аккумуляторе вступают в реакцию с образованием нового соединения, известного как сульфат свинца.
- В процессе создания нового химического вещества электроны высвобождаются из двух исходных веществ.Когда автомобиль заводится, электроны проходят через электроды батареи и попадают в электрическую систему автомобиля, обеспечивая необходимое напряжение для работы.
- Вода играет важную роль в этом химическом процессе. Когда в батарее происходит начальная химическая реакция, вновь созданным электронам потребуется среда, в которой они смогут перемещаться изнутри батареи к электродам, которые будут переносить ток в автомобиль.
- Вот где в аккумуляторную воду входит. Вода в аккумуляторе будет служить средой для электронов и гарантирует, что все электроны, накопленные в аккумуляторе, используются должным образом. Слава богу за аккумуляторную воду!
Однако важно отметить, что, поскольку вода в батарее помогает проводить электрический ток от внутренней части батареи, вода также подвергается химическому процессу, который создает в первую очередь электроны.
Это приводит к тому, что вода тоже претерпевает изменения.Обычно это изменение вызывает испарение воды, уменьшая количество воды в батарее. С меньшим количеством воды в батарее, пропускающей электрический ток, батарея не работает так, как должна.
Это причина, по которой автовладельцы обычно пополняют запас воды в своих батареях, используя водопроводную воду.
Проблема с водопроводной водой для использования воды в батарее
Хотя водопроводная вода пополняет аккумулятор и поддерживает его работоспособность, она также способствует ее износу.Некоторые вещества в воде влияют на химические процессы, которые уже происходят внутри батареи.
Вода из кранов и других домашних источников богата минералами. Это могут быть минералы, поступающие из домашней водопроводной системы, а также из местных водоочистных сооружений. Вода такого типа со временем может снизить производительность автомобильного аккумулятора.
Это потому, что минералы в воде остаются после того, как она испаряется изнутри батареи.
Использование обычной воды в качестве воды в батарее может повредить батарею
Когда вода испаряется, минеральные следы, такие как железо и кальций, не испаряются вместе с водой. Они остаются внутри автомобильного аккумулятора.
Когда это происходит, эти минералы притягивают свободно текущие электроны, которые должны были использоваться автомобилем. Что происходит, так это то, что эти электроны присоединяются к минералам и создают другое соединение, которому нет места внутри батареи.
Это, в свою очередь, приведет к снижению эффективности батареи из-за недостатка электронов. Он также сокращает срок службы аккумулятора из-за накопления минералов внутри автомобиля.
Дистиллированная вода для воды из аккумуляторной батареи
С другой стороны, дистиллированная вода не несет той же проблемы, что и водопроводная вода. Это связано с тем, что дистиллированная вода не содержит достаточно веществ, чтобы повлиять на аккумулятор. Он достаточно чистый и не влияет на химические процессы, которые должны происходить внутри автомобиля.
Когда вы используете дистиллированную воду для воды в аккумуляторе, она ничего не оставляет после испарения. Все остальные загрязнители в воде также испаряются, не оставляя ничего, кроме водяного пара. Это означает, что в батарее не будет никаких минералов, влияющих на химические процессы.
То, что вы получаете, — это эффективный аккумулятор с водяным аккумулятором, который безошибочно заведет ваш автомобиль. У вас также остается здоровый аккумулятор, который не разряжается так сильно, как аккумулятор, долитый водопроводной водой.
Дистиллированная вода в качестве воды для аккумулятора также хороша для аккумуляторов и другими способами
- Еще одна причина того, что дистиллированная вода лучше для воды для аккумуляторных батарей и автомобильных аккумуляторов, заключается в ее кислотности. Вам может быть интересно, почему такое безвредное средство, как вода, может быть классифицировано как кислое. Это из-за процесса дистилляции.
Когда вода перегоняется, она превращается в водяной пар, а затем снова конденсируется в жидкое состояние. Во время этого процесса углекислый газ из непосредственной близости растворяется в воде.Это создает очень слабый раствор угольной кислоты.
Используется ли дистиллированная вода для воды в батарее кислой и опасной?
Это связано с очень низким уровнем кислотности дистиллированной воды. Чтобы ответить на вопрос «Является ли дистиллированная вода кислой или щелочной?», Вам необходимо измерить ее кислотность с помощью шкалы pH.
Дистиллированная вода имеет уровень 6, что очень близко к нейтральному уровню 7 по шкале pH. Эта шкала идет от 1 до 14, где любое значение ниже 7 является кислотным, а любое значение выше 7 считается щелочным.
Когда мы пьем дистиллированную воду, наши тела противодействуют кислотности воды, заставляя желудок вырабатывать больше желудочной кислоты, чтобы справиться с водой. Если у вас здоровый желудок, вы сможете регулярно пить дистиллированную воду.
«Кислая» аккумуляторная вода — лучший вид воды для аккумуляторов
- Поскольку наши автомобильные аккумуляторы работают за счет химического процесса, дистиллированная вода в качестве аккумуляторной воды помогает этому процессу благодаря своим слабокислотным свойствам.
Он помогает лучше разрушать свинцовые компоненты, что делает зону более благоприятной для этих химических процессов. Это делает дистиллированную воду отличной альтернативой водопроводной воде для автомобильного аккумулятора.
Где купить дистиллированную воду для использования в батареях?
Хотя дистиллированная вода немного дороже, чем водопроводная вода, ее можно купить в супермаркетах и продуктовых магазинах. Обычно они продаются в бутылках и бывают разных марок. Наличие нескольких бутылок под рукой в бардачке — хорошая идея на тот случай, если у вашего автомобиля возникнут проблемы с запуском.
Вода бутилированная дистиллированная продается в магазинах.
Мало кто знает, что автомобилю нужно около 12 вольт, чтобы тронуться с места после поворота ключа. После этой начальной зарядки необходимо поддерживать постоянный ток, чтобы электрические системы автомобиля работали бесперебойно.
Это означает, что для правильной работы аккумуляторной батареи требуется постоянный запас воды. Интересно, что по этой же причине разряженный аккумулятор также называют «сухой». Это не потому, что в батарее закончились электроны.Это потому, что в аккумуляторе закончилась вода.
ПРОЧИТАЙТЕ ЭТИКЕТКУ:
Не используйте неправильный тип воды для воды вашей батареи!
- Просто внимательно прочитайте этикетки на бутылках, прежде чем покупать их для использования с аккумулятором. Есть большая вероятность, что ваш продуктовый магазин продает дистиллированную воду рядом с выбранной вами минеральной водой, и она не будет работать так же хорошо, как вода из аккумулятора.
Как вы уже знаете, наличие посторонних минералов внутри автомобильного аккумулятора — не лучшая идея.Убедитесь, что вы не покупаете минеральную воду.
Как сделать дистиллированную воду: вода из аккумулятора своими руками?
С другой стороны, вы также можете создать свою собственную дистиллированную воду с помощью процесса дистилляции. Короче говоря, дистилляция просто влечет за собой использование системы нагрева для испарения воды при разных температурах.
Когда вода испаряется, она превращается в водяной пар. Поскольку тяжелые металлы и другие минералы не могут испаряться с водой, они остаются в водяном паре.В этот момент вы получаете дистиллированный водяной пар.
После нагрева воды и превращения ее в пар остается просто конденсация или охлаждение. Пропуск водяного пара через пониженную температуру вернет пар в жидкую форму, оставив позади все тяжелые загрязнения.
Вы можете самостоятельно создать систему дистилляции воды своими руками (для создания воды из аккумулятора) из специальных материалов, а также систему отопления, например, печь. В Интернете есть множество руководств, которые покажут вам, как настроить рабочую систему для личного использования.
Имейте в виду, что любитель может столкнуться с трудностями при настройке системы дистилляции. Фактически, это может стать довольно опасным. Обязательно попросите кого-нибудь о помощи и соблюдайте все меры предосторожности. Вы беретесь за этот проект на свой страх и риск.
Интересно, что у многих производителей также можно купить систему дистилляции воды. Их можно установить в систему водоснабжения дома, чтобы вода, которую вы используете для дома, не содержала тяжелых минералов и других загрязняющих веществ.
Кому-нибудь нужен эксперт по аккумуляторной воде?
Более практичным читателям может показаться, что это слишком большая проблема.Но когда электричество отключено и у вас возникла чрезвычайная ситуация, эта система с дистиллированной водой может быть именно тем, что вам нужно. Ни в коем случае не сбрасывайте со счетов науку.
Возможно, вы никогда не узнаете, но если зомби-апокалипсис сбудется, это одна из самых важных сведений, которые вы могли бы получить, верно?
Дополнительные исследования:
https://van.
