Способ определения плотности электролита свинцового аккумулятора
Использование: способ предназначен для определения плотности электролита свинцового аккумулятора. Сущность изобретения: при определении плотности учитывается отданная текущая емкость свинцового аккумулятора, коэффициент пропорциональности между приращением разрядной электрической емкости аккумулятора и приращением плотности электролита. Кроме того, учитывается уровень электролита, при ращение плотности электролита за счет самозаряда при 20 С. Текущую плотность электролита при разряде аккумулятора получают суммированием плотности электролига перед началом разряда и приращением плотности электролита за счет разряда и саморазряда аккумулятора. 1 табл. (Л С в верхней части бака СА, откуда берут некоторое количество электролита для осуществления измерений, могут отличаться от значений плотности электролита, находящегося внутри блока пластин СА, на +0,05 г/см3 в то время, как для практики требуется оценивать интегральную плотность электролита с большей точностью: — высокая трудоемкость, т.

СОЮЗ СОВЕТСКИХ
СОЦИАЛИСТИЧЕСКИХ
РЕСПУБЛИК (ф)5 Н 01 М 10/42
ОП И САН И Е ИЗО БР ЕТЕ Н И Я!К ABTOPCHOMY СВИДЕТЕЛЬСТВУ (Ю )>
ГОСУДАРСТВ Е Н Н ОЕ ПАТЕ НТНО Е
ВЕДОМСТВО СССР (ГОСПАТЕНТ СССР) (21) 4903277/07 (22) 18. 01.91 (46) 23 ° 11.92. Бюл. t,» 43 (72) 10.П.Найденко, М.Д.Маслаков и Ю.В.Скачков (56) Притулюк В.А. Химические источники тока в авиации. M,: Воениздат, 1976, с. 28-29.
Дасоян M.A, Химические источники тока, Л.: Энергия, 1969, с, 82, 83, 569.
Справочник химика, М.-Л.: Химия, 1964, с. 594.
Справочник по электрохимии./Под ред. Сухотина А.M. Л.: Химия, 1981, с. 115, Р
Перельман В,И, Краткий справочник химика, M,: ГНТИ химической литературы, 1963, с. 405, Крайптон Т. Вторичные источники тока. M,: Мир, 1985, с, 175.
Устинов П.И, Стационарные аккумуляторные установки, M.: Энергия, 1970, с, 90.
Изобретение относится к технике измерения, конкретно к способам измерения плотности свинцовых аккумуляторов (CA).
Известен способ определения плотности электролита СА с помощью ареометра (!).
Основными недостатками данного способа являются:
— низкая достоверность измерения, т,к. значения плотности электролита
„„5U „„1777190A1 (54) СПОСОБ ОПРЕДЕЛЕНИЯ ПЛОТНОСТИ
ЭЛЕКТРОЛИТА СВИНИОВОГО АККУМУЛЯТОРА (57) Использование: способ предназначен для определения плотности электролита свинцового аккумулятора. Сущность изобретения: при определении плотности учитывается отданная текущая емкость свинцового аккумулятора, коэффициент пропорциональности между приращением разрядной электрической емкости аккумулятора и приращением плотности электролита. Кроме того, учитывается уровень электролита, при ращение плотности электролита за счет о самозаряда при 20 С. Текущую плотность электролита при разряде аккумулятора получают суммированием плотности электролита перед началом разряда и приращением плотности электро. лита за счет разряда и саморазряда аккумулятора. 1 табл. в верхней части бака СА, откуда берут некоторое количество электролита для осуществления измерений, могут отличаться от значений плотности электролита, находящегося внутри &oка пластин СА, íà +0,05 г/смз в то время, как для практики требуется оценивать интегральную плотность электролита с большей точностью: — высокая трудоемкость, т,к.
Известен также способ определения плотности электролита при стоянке CA без тока, принятый в качестве прототипа, путем измерения установившегося значения ЭДС. E свинцового аккумулятора и определения плотности электролита по формуле (7):
d = E — 0,84 (г/смз) (1)
Пднако этот способ имеет методическую погрешность до 0,01 г/смз и не позволяет определять плотность электролита СА в процессе разряда, т,к, при разряде невозможно измерятьЭДС, в то же время, контроль плотности электролита СА при разряде необходим, т,к. он позволяет оценивать состояние СА в процессе разряда, его остаточную емкость и выбирать оптимальный режим разряда.
Целью изобретения является повышение точности, а также измерение плотности электролита в процессе разряда. 25
Сущность .изобретения состоит в том, что в режиме стоянки аккумулятора без тока измеряют его установившуюся ЭДС, но в отличие от прототипа, с целью повышения точности, а также измерения плотности электролита в процессе разряда, предваритель» но определяют:
— зависимость установившейся ЭпС
СА от плотности электролита, напри» мер, при 25 С, используя известную аналитическую зависимость (2), которая обеспечивает большую точность определения плотности электролита по установившейся ЭЛС, чем это достига- 4 ется в прототипе при использовании эмпирической формулы;
— изменение активности серной кис» лоты и воды в водных растворах электролитов при изменении температуры 45 на 10С
— коэффициенты пропорциональности между приращением, разрядной емкости аккумулятора и приращениями плотности электролита, а также поправку к ним, учитывающую влияние уровня электролита в аккумуляторе на указанные коэффициенты пропорциональности, — приращение плотности электролита о за счет саморазряда при 20 С, При измерении плотности, электролита в режиме стоянки аккумулятора без то» ка дополнительно измеряют температуру электролита, и, используя известные температурный коэффициент Э,пС (2, с, 83) и изменения активной серной кислоты и воды в водных растворах электролитов при изменении температуры на 1 С, вычисляют ЭРС аккумулятора при 25 С, после чего, используя зависимость установившейся ЭДС от плотности электролита при 25ОС, определяют плотность электролита при
25 С, а в процессе разряда измеря» ют ток разряда, время разряда, тем» пературу электролита, вычисляют от» данную аккумулятором емкость, прира -.
Для определения плотности электролита предложенным способом предварительно определяют зависимость установившейся ЭлС свинцового ак» кумулятора от плотности электролита, например, при 25 С, используя известную аналитическую зависимость, кото рая обеспечивает большую точность определения плотности электролита по установившейся ЭЛС
E=2,041+0,0591 lg — — — — — ) (2) а PaSO
a H O — активность воды в водных растворах электро» литов °
Из формулы (2) не просматривается связь между ЭДС и плотностью элект» ролита СА, Однако, такая связь существует, поскольку активности а Нз80 и а Н О зависят от концентрации и температуры электролита.
Таблицы, отражающие эти зависимости, приведены, например,,в ; (3) и в (4), а концентрация и температура ,однозначно определяют плотность электролита. В (3) с, 522 приводится таблица, связывающая концентра» цию с плотностью электролита при
В (3) с, 522 приводится таблица, связывающая концентра» цию с плотностью электролита при
20 С, в (5) даются поправки плотности в зависимости от температуры, Указанные данные в совокупности позволяют определить зависимость плот0 6
f000 P
m = — — — — -/
M(f00-P) 5 1777!9 ности электролита от установившейся
ЭДС .СА при известной температуре, Ниже приводится таблица, в которой по результатам анализа данных (л.3, 4, 5, 6) определена зависимость установившейся ЭЯС CA от плотности рао створа серной кислоты при 25 С.
Указанные в таблице эксперимено тальные значения ЭЛС Еахсп при 25 С и концентрации в массовых процентах взяты из,(л.3, с. 81), При этомконцентрация в массовых процентах пересчитана на мольную концентрацию (моль/1000 г растворителя) по изве- 15 стной (л. 4, с. 494) формуле: где тп — малярная концентрация! 20
P — концентрация в массовых процентах1
М вЂ” молекулярный вес растворен-. ного вещества (Н ЯО ), выполнены расчеты и получены остальные данные таблицы.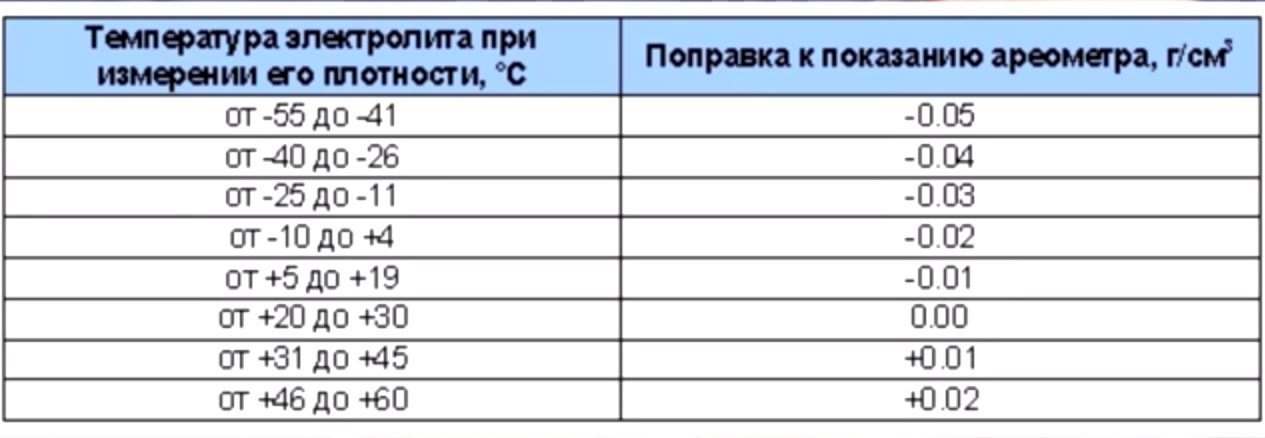 Если в таблице опустить первую строку, поскольку такие малые концентрации (плотности) в аккумуляторной практике не применяются, то погледний столбец указанной 30 таблицы показывает, что расчет плотности при стоянке CA без тока предложенным методом обеспечивает достаточно высокую точность, удовлетворяющую требованиям практики, 35
Если в таблице опустить первую строку, поскольку такие малые концентрации (плотности) в аккумуляторной практике не применяются, то погледний столбец указанной 30 таблицы показывает, что расчет плотности при стоянке CA без тока предложенным методом обеспечивает достаточно высокую точность, удовлетворяющую требованиям практики, 35
P предложенном способе предварительно определяют также. изменение активностей серной кислоты и воды в водных растворах электролитов при изменении температуры на 1 С. Это свя- 40 зано с предусмотренным в алгоритме, реализующем предложенный способ, пересчетом установившейся ЭДС с текущей
0 температуры на температуру 25 С. При разряде СА различными режимами от 45 одночасового до 75-часового плотность электролита d по окончании разряда изменяется в пределах от
1,210 до 1,029 г/смз при 25 С, что
— соответствует изменению молярной кон- 50 центрации m в пределах от 4,260 до
0,517 моль/1000 г, Как видно из (л.5.. с. 115) при концентрации 9,6
16 6 мас. 3, что соответствует m=1,08- .
3, что соответствует m=1,08- .
2,03 моль/1000 г, активность а Н О ц; в растворе серной кислоты практически не зависит от температуры. В диапазоне концентраций m = 4,260
0,517 моль/1000 r, которые имеют место по окончании разряда CA различными режимами, наиболее явно зависимость активности а Н О от температуры про»
2 о является при концентрации 28,3 мас.4 или 4,02 моль/1000 г, Такая концентрация электролита возможна после раз» ряда СА 1-часовым режимом. Но и в этом случае изменение активности а Н О на 1 С составляет менее 0,001, 2. что дает основание пренебречь им.
Таким образом, при разработке алгоритмов, реализующего предложенный способ, определения плотности электролита СА, принято допущение, что активность а Н О при тех концентрациях (плотностях) электролита, которые имеют место после окончания разряда различными режимами, не зависит от температуры.
Активность серной кислоты а Н БО при увеличении температуры уменьшается при всех концентрациях (плотностях), которые в практике эксплуатации СА имеет электролит (л.
Анализ изменения коэффициента активности у серной кислоты в функции температуры при тех концентрациях (плотностях) электролита, которые имеют место после разряда СА различными режимами, позволил установить, что для таких концентраций (плотнос» тей) при увеличении температуры на
1 С коэффициент активности серной кислоты уменьшается в 0,99 раз., Анализ изменения коэффициента активности серной кислоты в функции температуры в диапазоне концентраций (плотностей) электролита, которые имеют место в заряженном СА, позволил установить для таких концентраций (плотностей), что при увеличении температуры на 1 С уменьшается в о
0,98 раз.
Анализ изменения активности воды а Н О в функции температуры в диапазоне концентраций (плотностей) электролита, которые имеют место в заряженном СА позволил установить, что для таких концентраций (плотностей) при увеличении температуры на
1 С а Н О увеличивается в 0,9977раз.
Предложенный способ предусматривает также предварительное определение коэффициентов пропорциональности между приращениями разрядной емкости и приращениями плотности электролита.
Известно, что каждому ампер-часу количества электричества, отданному
С О где дд ñ
17771 о d сР если
1гв,1гР, к- к г о о
« К + t к-i., 2
t
Ip
6е
СА при разряде, соответствует расход
3,660 r серной кислоты и образование 0,672 г воды (л.2, с, 272-273), Однако получающееся при этом приращение плотности электролита, приведенное к одной температуре,, будет различаться в зависимости от начальной плотности электролита в момент начала разряда и его начального объема: чем больше начальная плотность электролита, тем меньше приращение плотности электролита.
Проведенные расчеты, например, для СА с площадью основания аккумуляторного бака внутри него, равной
2170 смг, с обьемом электролита 150 л, с измеряемым уровнем электролита над блоком пластин, равном 73 мм при 30 С, позволили получить следующие значе» ния коэффицяентов пропорциональности К: при d 25o 1 294, К = РР182 при 1,294 o d 25 f,246, К = 80833 при 1,246 > d 25 о. 1,208, К = 74615 25 при 1,208 ) d 25о 1,152, V = 89286: при 1,152 > д 25 = 1,089, К = 60625 при 1,089 ) d 25 K = 57059
1,208, К = 74615 25 при 1,208 ) d 25о 1,152, V = 89286: при 1,152 > д 25 = 1,089, К = 60625 при 1,089 ) d 25 K = 57059
На основе проведенных расчетов по-. лучено выражение для поправки P,ó÷è- 30 тывающей влияние высоты уровня электролита, как величины прямо пропорциональной обьему электролита на коэффициенты пропорциональности К указанных аккумуляторов: 35
P = (0 9982) 1 зо
rye h — высота уровня электролита, приведенная к температуре 30 С по из» 40 о вестной формуле:
h o = hg — 0,6(t- 30) мм, (6) где h — высота уровня электролита при температуре tС,, $5
t — измеренная температура, С.
Приращение плотности электролита за счет саморазряда определяется по результатам измерения плотности электролита в период стоянки СА без то- 5р ка, например, через каждые 24 ч и приводится к 20 С по формулам: о
2сг 4р 5 о о
d =gd — — — если t 730 С с. с о -20 о сР
20 ср 10
d =Ed с с t;-10 ср если 20 + с а 30 (á) о
tCf д5
d
d „, — плотность электролита о
У приведенная к 25 С, на конец предыдущих суток, — температура электролита на конец предыдущих суток.
Формулы (6) получены на основании (л,6, с. 175), где показано, что саморазряд СА после 20 С увеличива» о ется вдвое при каждом увеличении темо пературы на 10 С.
При определении плотности элект» ролита предложенным способом в период стоянки СА без тока измеряют установившуюся ЭДС, например, цифровым вольтметром, обеспечивающим измерение ЗДС, с четырьмя знаками после запятой, измеряют температуру электролита, например, с помощью термопреобразователя сопротивления, и, используя известный температурный коэффициент ЭДС,равный 0,00136 В/град (л.3, с. 83), а также предварительно полученные изменения активности серной кислоты и воды в водных растворах электролитов при изменении темпера» о туры на 1 С, вычисляют ЭРС аккумуляо тора при 25 С, после чего, используя предварительно полученную зависимость установившейся ЭДС от плотности электролита при 25 С (см, таблицу), определяют плотность электролита при
25 С, При определении плотности электролита в процессе разряда измеряют ток разряда, время разряда, температуру электролита, вычисляют отданную аккумулятором емкость по формулам:
СР IP ht, (7) приращение разрядной емкости, величина тока разряда, const — временной интервал измерения тока, 1777190
Л
C к (10) 30
1! у Cp d = d — > — у к
Š— 0,84, 35
5О ао (Мс
С,=КАС, (8) где С — отданная аккуиуляторои емP кость на текущий момент времени разряда. 5
5
Имея значения плотности электролита перед включением аккумулятора на разряд, выбирают в соответствии с нею коэффициент пропорциональности К, пересчитывают уровень электролита после последнего заряда, измеренный при температуре t на 30 С, по фор» муле (6), вычисляют поправку f5, учитывающую влияние уровня электролита в аккумуляторе на коэффициент пропор15 циональности К по формуле (5), вычисляют новое значение коэффициента
К пропорциональности К по фориуле
К =К (o) 20 вычисляют приращение плотности элек- тролита за счет разряда аккумулятора по формуле и текущую плотность электролита при
25 С по формуле: о где d — плотность электролита перед
1 началом разряда, измеренная при стоянке CA без тока.
Вычисляют приращение плотности электролита за счет саморазряда, для, чего предварительно вычисленное при-ращение плотности электролита за счет саморазряда при 20 С пересчитывают на текущую температуру по формулам: о йР t-20 о
Дс1 = ДЙ вЂ” — если t 730 С
С С
2оо t-10
Дй =Ad
10 если 20 (t
1о lgp0 о
Дс1с = hdс ecole t c 20 С вычисляют часовой саморазряд по формуле: после часа разряда опять вычисляют . 55 часовой саиоразряд для текущей температуры по формуле: о ц Лспо
55 часовой саиоразряд для текущей температуры по формуле: о ц Лспо
q — °
24 (14) По данным часового разряда для начала и по окончании каждого часа разряда вычисляют по формуле средний самора зряд за час
q = (q +q )/2 (15) и через каждый час разряда q сумми» руют и с плотностью электролита, по-. лученной по фориуле (11), Проведенная опытная проверка способа показала, что он обеспечивает высокую точность определения плотности электролита при стоянке СА без тока и в процессе разряда.
Использование предложенного способа повышает точность определения плот-: ности электролита СА при стоянке без тока и в процессе разряда, упрощает осуществление контроля плотности электролита СА, создает предпосылки для его автоматизации с использованием вычислительной техники.
Формула изобретения
Способ определения плотности элек» тролита свинцового аккумулятора в режиме стоянки его без тока путеи из» иерения установившегося значения ЭпС и вычисления плотности электролита по формуле где d — плотность электролита при
+15 С, E — установившееся значение ЭРС свинцового аккумулятора, отличающийся . теи, что, с целью повышения точности, а также измерения плотности электролита в процессе разряда, предварительно определяют зависимость установившейся
теи, что, с целью повышения точности, а также измерения плотности электролита в процессе разряда, предварительно определяют зависимость установившейся
ЭПС свинцового аккумулятора от плотности электролита при 25 С, изменение активности серноЙ кислоты и воды в водном растворе серной кислоо ты при изменении температуры на 1 С,. коэффициенты пропорциональности меж ду приращениями разрядной электрической емкости аккумулятора и приращениями плотности электролита, а также поправку к ним, учитывающую влияние уровня электролита на указанные коэффициенты пропорциональности, приращение плотности электролита за счет саиоразряда при 20 С, при определении плотности электролита измеряют установившуюся ЭДС ак11 1 кумулятора при стоянке его без тока, температуру электролита и, используя температурный коэффициент.3РО
0,00136 В/град и предварительно полученные изменения активностей серной кислоты и воды в водном растворе серной кислоты при изменении температуры на 1 С, вычисляют ЭДС аккумулятора при 25 С, после чего,используя зависимость установившейся
ЭДС от плотности электролита при
25 С, определяют плотность электро- лита при 25 С, а в процессе разряда измеряют ток разряда, время разряда, 777190 12 температуру электролита, вычисляют отданную аккумулятором электрическую емкость, приращение плотности электролита за счет разряда аккумулятора, приращение плотности электролита за счет саморазряда при измеренной (текущей) температуре, а текущую плотность электролита при разряде аккуму» лятора получают суммированием плотности электролита перед началом разряда и приращений плотности электролита за счет разряда и саморазряда аккумулятора, 15
1 р
r/сма при
25 С
P) г/сма при
29оС
М температура поправки плОТИОсти эмса
В
ЭДС расхождение с Е „ „, 2; моль/
1000 r раста. а Н,О
а Н,О
Ер ц у
В
ЭДС а l1 O 4 „,э;т+ при 25РС
1,281
7,61
0,00029 о,oo189
0,00903
0,06648
0,3086
1,2616
4, 5216
14,583
48,573
117,785
0,56
0,08
0,05
0,03
7519
0,01
0,01
0,06
0,02
0,04
0,09
0,04
Составитель И,Найденко
Редактор Т,Куркова Техред И,Моргентал Корректор й.Тупица
Заказ 11125 Тираж Подписное
ВНИИПЯ. Государственного комитета по изобретениям и открытиям при ГКНТ СССР
113035, Москва, Ж-35, Раушская наб., д. 4/5
Производственно-издательский комбинат «Патент», r.Óæãîðîä, ул. Гагарина, 101
090502
0,1006
0 1999 о 5
0,997
2,000
2>9939
4,004
5,006
5,9956
7,0077
8,0000
1, 0016
i 0o5
1,0112
l, O5P7
1,1124
1,1606
1,2038
1,2425
1, 2773
1,3090
1 3381
0,0002
0,0002
0,0002
0,00027
0,00036 о,ooo51
0,00062
0300068
0,00071
0,00073 о,ооо74
0 00076
1,0006
1,004
1,01
1,028
1,057
1,!1
1,15Р, 1, 200
l,239
1,274
1,305
1,334
0,9981
0,9963
0,9928
0,9819
0,9618
0,9126 о,Р516
0,7799
0,7032
0,6259
0,5509
0,4814
1, 7977 l, 8321
1,8805
1«9192
1,9738
2,0149
2э0533
2,0888
2, 1218
2 156
2, 1822
1,76183
1, 79625
1,83122
l,88102
1,91à45
1 97099
2 01370
2ю05289.
2,08974
2, 12368
2,15504
Как увеличить плотность электролита в автомобильном аккумуляторе
Внутри жидкостного автомобильного аккумулятора находится электролит – раствор серной кислоты в определенном соотношении с водой. Именно серная кислота катализирует химические процессы в батарее, которые позволяют получать из АКБ энергию. Важно, чтобы концентрация кислоты в растворе находилась на одном уровнем. Если она понизится, батарея будет выдавать меньше мощности, чем необходимо автомобилю. Определить концентрацию можно по плотности раствора.
Какие реакции протекают в аккумуляторе
В свинцово-кислотных аккумуляторах вся работа основывается на химических процессах. Интенсивность химической реакции зависит от конструкции и типа АКБ. Раньше в батареях использовали чистый свинец, поэтому элементы батареи были очень мягкими и служили недолго. Чтобы повысить прочность и срок службы аккумулятора, свинец стали легировать сурьмой.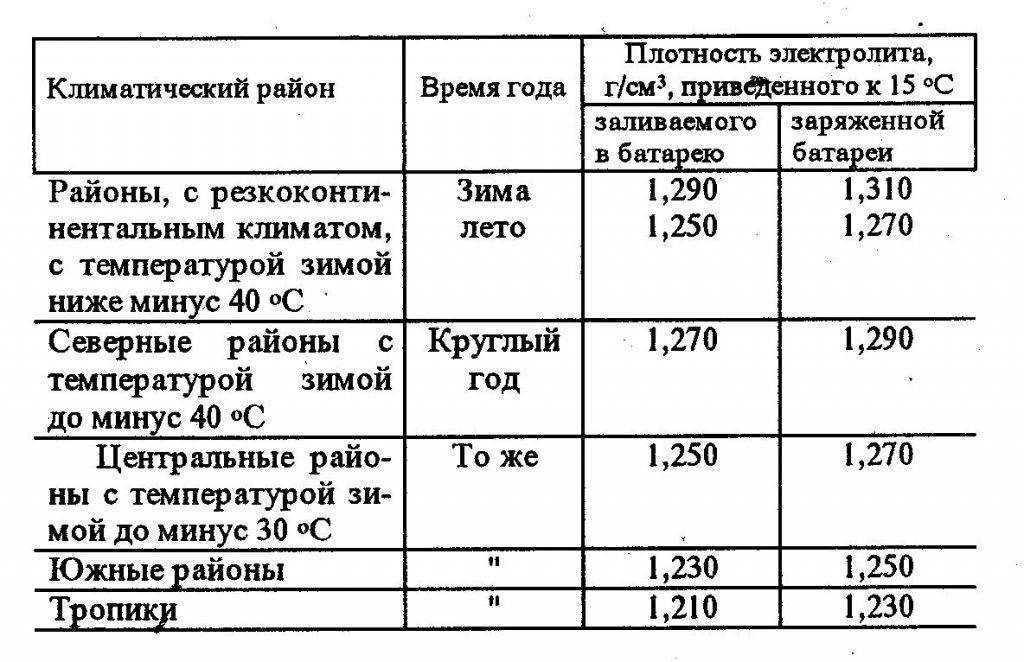 Такие батареи используются и сегодня. Содержание сурьмы в сплаве не превышает 6%, но эффективность работы аккумулятора и прочность решетках значительно увеличились. В более современных аккумуляторах сурьму заменили кальцием. Оба варианта аккумуляторов можно найти сегодня на рынке.
Такие батареи используются и сегодня. Содержание сурьмы в сплаве не превышает 6%, но эффективность работы аккумулятора и прочность решетках значительно увеличились. В более современных аккумуляторах сурьму заменили кальцием. Оба варианта аккумуляторов можно найти сегодня на рынке.
Окисление сплава свинца и сурьмы происходит только под воздействием электролита. Он является катализатором, который дает старт и поддерживает реакцию, но также может являться угрозой для целостности батареи, если соотношение серной кислоты и воды в растворе не соблюдается. Именно от этого соотношения зависит эффективность аккумулятора и срок его службы.
Кроме минусовых свинцовых решеток с добавлением сурьмы или кальция, которые погружаются в растворе кислоты с водой, в аккумуляторах есть положительные пластины, на них находится активная масса из оксида свинца. В одной АКБ шесть элементов по 2 вольта, в сумме дающие напряжение 12 вольт. В каждом из этих элементов есть положительные и отрицательные пластины.
Чтобы исключить короткое замыкание в батарее, элементы отделены друг от друга. Контактная пара работает через раствор, который обеспечивает движение заряженных частиц от одного электрода к другому. При разряде в аккумуляторе образуются вода и сульфат свинца, а в процессе зарядки состояние батареи возвращается к исходному.
Почему электролит теряет плотность?
Плотность электролита в аккумуляторной батарее не постоянная. Она зависит от заряда батареи. Чтобы определить плотность, рассчитывают количество чистого вещества в 1 кубическом сантиметре раствора. По мере эксплуатации аккумулятора серная кислота может превращаться в воду и обратно. Обратная реакция может уступать прямой по интенсивности. Часть сульфата свинца оседает на решетках, этот процесс называется сульфатацией пластин. В результате со временем содержание серной кислоты в аккумуляторной батарее снижается. Изменение плотности электролита – это нормальный результат работы аккумулятора, который неизбежен во время работы батареи. Но в этом процессе могут возникнуть нарушения, из-за чего плотность снижается быстрее установленного.
Но в этом процессе могут возникнуть нарушения, из-за чего плотность снижается быстрее установленного.
Чтобы плотность раствора в батарее менялась медленнее, можно только уменьшить интенсивность разряда батареи. Но эксплуатировать машину при этом будет сложно, поэтому остается только правильно использовать аккумулятор и вовремя его подзаряжать.
Важно отметить, что в исправной аккумуляторной батарее при разряде и заряде плотность меняется незначительно. К примеру, если фары проработают всю ночь, плотность электролита упадет с 1,4 граммов на кубический сантиметр до 1,1 граммов. После восстановления заряда плотность вернется к нормальным показателям.
Сколько будет работать аккумулятор
Первые годы эксплуатации проблем с плотностью электролита в аккумуляторе не возникает. После зарядки он каждый раз восстанавливается практически до исходного состояния. Но со временем батарея изнашивается, и плотность может упасть даже в полностью заряженном состоянии.
Часть сульфата свинца остается в виде осадка, который уже не вступает в химическую реакцию для восстановления электролита. Раствор засоряется осадком и содержание серной кислоты в нем падает. Обычно такое состояние наступает только после четырех-пяти лет использования аккумулятора. Но если батарею регулярно недозаряжают или неправильно эксплуатируют, то плотность может упасть и раньше. Чтобы точно определить, нужно ли ее восстанавливать, нужно сначала определить плотность раствора.
Как измерить плотность электролита в аккумуляторе?
Чтобы узнать, сколько серной кислоты нужно добавить для восстановления рабочих параметров, необходимо измерить плотность раствора. Для этого потребуются:
Сначала раствор набирают при помощи груши, присоединенной к стеклянной трубки. Внутри трубки устанавливают ареометр таким образом, чтобы он не касался стенок. По шкале ареометра определяют плотность электролита. Если показатель в заряженном аккумуляторе ниже 1,4 граммов на кубический сантиметр, плотность нужно повышать. Сделать это можно при помощи корректирующего электролита. После этого аккумулятор заряжают 30 минут, оставляют на 2 часа без эксплуатации и повторяют измерение.
Сделать это можно при помощи корректирующего электролита. После этого аккумулятор заряжают 30 минут, оставляют на 2 часа без эксплуатации и повторяют измерение.
Как восстанавливается плотность?
Увеличить плотность электролита в аккумуляторе можно тремя способами:
-
Полностью поменять электролит.
-
Добавить в раствор серной кислоты.
-
Использовать специальный корректирующий электролит.
Важно принимать во внимание, что испаряется их аккумулятора только вода. Потому если уровень электролита слишком низкий, доливать нужно только воду. Кислоту добавляют, если снижается плотность раствора. Доля кислоты определяется в зависимости от того, сколько ее не хватает. Так, при плотности 1,1 граммов на кубический сантиметр не хватает 0,3 грамма. Поэтому в недостающем количестве воды разбавляют до 30% кислоты и заливают в батарею.
Плотность электролита из калькулятора теплопоглощенного электролита
✖Тепло, поглощаемое электролитом, — это тепло, поглощаемое электролитом.ⓘ Тепло, поглощаемое электролитом [H] | Attojo ule per SecondAttowattBrake Horsepower (bhp) Btu (IT) в часBtu (IT) в минутуBtu (IT) в секундуBtu (th) в часBtu (th) в минутуBtu (th) в секундукалория (IT) в часкалория (IT) в минутукалория (IT) в секундукалория (th) в секунду ЧасКалория (терм) в минутуКалория (тепл) в секундуСантиджоуль в секундуСантиваттCHU в часДекаджоуль в секундуДекаваттДециджоуль в секундуДециваттЭрг в часЭрг в секундуЭксаджоуль в секундуЭксаваттФемтоджоуль в секундуФемтоваттФут-фунт-сила в часФут-фунт-сила в минутуФут-фунт-сила в секундуГигаджоуль в секундуГига ваттГектоджоуль в секундуГектоваттЛошадиная силаЛошадиная сила (550 футов* lbf per s)Лошадиная сила (бойлер)Лошадиная сила (электрическая)Лошадиная сила (метрическая)Лошадиная сила (вода)Джоуль в часДжоуль в минутуДжоуль в секундуКилокалория (ИТ) в часКилокалория (ИТ) в минутуКилокалория (ИТ) в секундуКилокалория (й) в часКилокалория (й) в минутуКилокалория (терм) в секундуКилоджоуль в часКилоджоуль в минутуКилоджоуль в секундуКиловольт-амперКиловаттMBHMBtu (IT) в часМегаджоуль в секундуМегаваттМикроджоуль в секундуМикроваттМиллиджоуль в секундуМилливаттMMBHMMBtu (IT) в часНаноджоуль в секундуНановаттНьютон-метр в секундуПетаджоуль в секундуПетаваттP ferdestarkeПикоджоуль в секундуПиковаттПланковская мощностьФунт-фут в часФунт-фут в минутуФунт-фут в секундуТераджоуль в секундуТераваттТонна (охлаждение)Вольт АмперВольт Ампер РеактивнаяВаттYоктоваттЙоттаваттЗептоваттЗеттаватт | +10% -10% | ||||
✖Объемный расход — это объем жидкости, проходящий в единицу времени. | акров-футов на День-акр-фут в часАкро-фут в годБаррель (США) в деньБаррель в часБаррель в минутуБаррель в секундуКубический сантиметр в деньКубический сантиметр в часКубический сантиметр в минутуКубический сантиметр в секундуКубический фут в часКубический фут в минутуКубический фут в секундуКубический дюйм в часКубический дюйм в минутуКубический дюйм в секундуCub ик Метр в деньКубический метр в часКубический метр в минутуКубический метр в секундуКубический миллиметр в минутуКубический миллиметр в секундуКубический ярд в часКубический ярд в минутуКубический ярд в секундуГаллон (Великобритания) в деньГаллон (Великобритания) в часГаллон (Великобритания) в минутуГаллон (Великобритания) в секундуГаллон (США) в деньГаллон (США) в часГаллон (США) в минутуГаллон (США) в секундуСто кубических футов в деньСто кубических футов в часСто кубических футов в минутуКилобаррель в деньЛитр в деньЛитр в часЛитр в минутуЛитр в секундуМиллилитр в деньМиллилитр в часМиллилитр в минутуМиллилитр в секундуМиллион литров в деньУнция в часУнция в минутуУнция в секундуУнция(Великобритания) в часУнция(Великобритания) в минутуУнция(Великобритания) в секундуФунт в деньФунт в час | +10% -10% | ||||
электролит [c электролит ] | Btu (IT) на фунт на градус Цельсия Btu (IT) на фунт на градус Фаренгейта Btu (IT) на фунт на градус Ранкина Btu (th) на фунт на градус Фаренгейта Btu (th) на фунт на Градус Ренкина Калория (IT) на грамм на градус Цельсия Калория (IT) на грамм на градус Фаренгейта Калория (th) на грамм на градус ЦельсияCHU на фунт на градус ЦельсияДжоуль на грамм на ЦельсияДжоуль на килограмм на градус ЦельсияДжоуль на килограмм на ккилокалорию (IT) на килограмм на градус ЦельсияКилокалория (IT) на килограмм на ккилокалорию (й) на килограмм на градус Цельсия Килокалория (й) на килограмм на килограмм-силу метр на килограмм на кельвин-килоджоуль на килограмм на градус Цельсия-килоджоуль на килограмм на килограмм-фунт-силу фут на фунт на градус Ренкина | +10% -10% | ||||
1 кипячение ] | ЦельсияДелильФаренгейтКельвинНьютонРэнкинРомюрРомерТройная точка воды | ✖Температура окружающего воздуха — это температура, при которой начинается процесс утрамбовки. | ЦельсияDelisleFahrenheitKelvinNewtonRankineReaumurRomerTriple point of water | +10% -10% 900 07 |
✖Плотность электролита показывает плотность электролита в определенной области. Это берется как масса на единицу объема данного объекта.ⓘ Плотность электролита из теплопоглощающего электролита [ρ электролит ] | Сантиграмм на литрДециграмм на литрДекаграмм на литрПлотность землиФемтограмм на литрЗерно на кубический футЗерно на галлон (Великобритания)Зерно на галлон (США)Грамм на кубический сантиметрГрамм на кубический метрГрамм на кубический миллиметрГрамм на литрГрамм на миллилитрГектограмм на литрКилограмм на кубический сантиметрКилограмм на кубический дециметрКилограмм на кубический метрКилограмм за Лиммегаграмма на лимикрограмму на лимиллиграмм на кубическую сантиметермиллиграмму на кубические метлимиллиграммы на кубические миллиметермиллиграммы на литеранограмму на литр на кубический подход на кубический дюйм на галлон (в Великобритании) унс на галлон (США) Пикограмма на литр. | ⎘ Копировать |
👎
Формула
Перезагрузить
👍
Плотность электролита из теплопоглощающего раствора электролита
ШАГ 0: Сводка предварительных расчетов
ШАГ 1: Преобразование входных данных в базовые единицы
Тепло, поглощаемое электролитом: 12 киловатт —> 12000 ватт (проверьте преобразование здесь)
Объемный расход: 47,9 кубических миллиметра в секунду —> 4.79E-08 Кубический метр в секунду (Проверьте преобразование здесь)
Удельная теплоемкость электролита: 4,18 КДж на килограмм на К —> 4180 Джоуль на килограмм на К (Проверьте преобразование здесь)
Температура кипения электролита : 368,15 Кельвина —> 368,15 Кельвина Преобразование не требуется
Температура окружающего воздуха: 308,15 Кельвина —> 308,15 Кельвина Преобразование не требуется
ШАГ 2. Вычисление формулы
Вычисление формулы
ШАГ 3. Преобразование результата в единицу измерения выхода
998891,230733885 Килограмм на кубический метр —> преобразование не требуется
< 6 Тепло, поглощаемое электролитом КалькуляторыПлотность электролита из термопоглощающей формулы электролита
Плотность электролита = Теплота, поглощаемая электролитом / (Объемный расход * Удельная теплоемкость электролита * (Точка кипения электролита — температура окружающего воздуха))
ρ электролит = H/(Q*c электролит *(θ кипение -θ окружающая среда ))
Что такое I закон электролиза Фарадея?
Первый закон электролиза Фарадея гласит, что химическое изменение, происходящее во время электролиза, пропорционально пропущенному току и электрохимической эквивалентности материала анода.
Как рассчитать плотность электролита из теплопоглощающего электролита?
Калькулятор плотности электролита из теплопоглощенного электролита использует Плотность электролита = Тепло, поглощаемое электролитом / (Объемный расход * Удельная теплоемкость электролита * (Точка кипения электролита-температура окружающего воздуха)) для расчета плотности электролита, Плотность электролита по формуле теплопоглощающего электролита определяется как отношение массы к единице объема данного электролита. Плотность электролита обозначается цифрой ρ электролит символ.
Как рассчитать плотность электролита из теплопоглощающего электролита с помощью этого онлайн-калькулятора? Чтобы использовать этот онлайн-калькулятор для плотности электролита из теплопоглощаемого электролита, введите Тепло, поглощаемое электролитом (H) , Объемный расход (Q) , Удельная теплоемкость электролита (c электролит ) , Кипение Температура электролита (θ кипения ) и температура окружающего воздуха (θ окружающий ) и нажмите кнопку расчета. Вот как можно объяснить расчет плотности электролита из теплопоглощающего электролита с заданными входными значениями -> 998891,2 = 12000/(4,79E-08*4180*(368,15-308,15)) .
Вот как можно объяснить расчет плотности электролита из теплопоглощающего электролита с заданными входными значениями -> 998891,2 = 12000/(4,79E-08*4180*(368,15-308,15)) .
Часто задаваемые вопросы
Какова плотность электролита из теплопоглощающего электролита?
Плотность электролита из формулы теплопоглощающего электролита определяется как отношение массы к единице объема данного электролита и представляется как ρ электролит = H/(Q*c электролит *(θ кипение -θ окружающая среда )) или Плотность электролита = тепло, поглощаемое электролитом/(объемный расход*удельная теплоемкость электролит*(Точка кипения электролита-температура окружающего воздуха)) . Тепло, поглощаемое электролитом, — это тепло, поглощаемое электролитом, объемный расход — это объем жидкости, проходящий в единицу времени, удельная теплоемкость электролита — это теплота, необходимая для повышения температуры единицы массы данного вещества на заданное количество, температура кипения электролита — это температура, при которой жидкость начинает кипеть и превращается в пар, а температура окружающего воздуха — это температура, при которой начинается процесс набивки.
Как рассчитать плотность электролита из теплопоглощающего электролита?
Плотность электролита по формуле электролита, поглощаемого теплом, определяется как отношение массы к единице объема данного электролита, рассчитанное с использованием Плотность электролита = теплота, поглощаемая электролитом/(объемный расход*удельная теплоемкость электролита* (Точка кипения электролита-температура окружающего воздуха)) . Чтобы рассчитать плотность электролита из электролита, поглощаемого теплом, вам нужно тепло, поглощенное электролитом 9.0168 (H) , Объемный расход (Q) , Удельная теплоемкость электролита (c электролит ) , Температура кипения электролита (θ кипения ) & Температура окружающего воздуха ( θ окружающая среда ) . С помощью нашего инструмента вам необходимо ввести соответствующие значения теплоты, поглощаемой электролитом, объемного расхода, удельной теплоемкости электролита, температуры кипения электролита и температуры окружающего воздуха, и нажать кнопку расчета.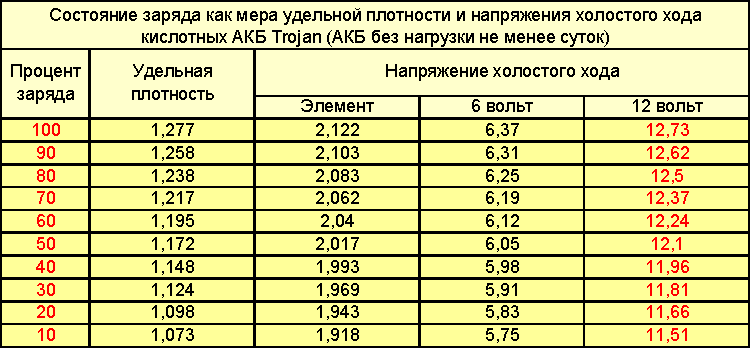 Вы также можете выбрать единицы измерения (если есть) для ввода (ов) и вывода.
Вы также можете выбрать единицы измерения (если есть) для ввода (ов) и вывода.
Поделиться
Скопировано!Понимание критической роли плотности тока обмена в поведении металлического лития при электроосаждении
1. Линь Д., Лю Ю., Цуй Ю., Нац. нанотехнологии. 2017, 12, 194. [PubMed] [Google Scholar]
2. Брюс П.Г., Фройнбергер С.А., Хардвик Л.Дж., Тараскон Дж.М., Nat. Матер. 2012, 11, 19. [PubMed] [Google Scholar]
3. Лю Б., Чжан Дж.-Г., Сюй В., Джоуль 2018, 2, 833. [Google Scholar]
4. Бикер Г., Винтер М., Бикер П., Phys. хим. хим. физ. 2015, 17, 8670. [PubMed] [Google Scholar]
5. Ву Ф., Юань Ю.-С., Ченг Х.-Б., Бай Ю., Ли Ю., Ву С., Чжан Ц., Материал накопления энергии. 2018, 15, 148. [Google Scholar]
6. Адамс Б.Д., Чжэн Дж., Рен С., Сюй В., Чжан Дж.-Г., Adv. Энергия Матер. 2018, 8, 1702097. [Google Scholar]
7. Cheng X.B., Zhang R., Zhao C.Z., Zhang Q., Chem. преп. 2017, 117, 10403. [PubMed] [Google Scholar]
8. Xiong S., Liu Y., Jankowski P., Liu Q., Nitze F., Xie K., Song J., Matic A., Adv. Функц. Матер.
2020, 30, 2001444. [Google Scholar]
Xiong S., Liu Y., Jankowski P., Liu Q., Nitze F., Xie K., Song J., Matic A., Adv. Функц. Матер.
2020, 30, 2001444. [Google Scholar]
9. Li N.W., Yin Y.X., Yang C.P., Guo Y.G., Adv. Матер. 2016, 28, 1853. [PubMed] [Google Scholar]
10. Li G., Liu Z., Huang Q., Gao Y., Regula M., Wang D., Chen L.-Q., Wang D., Nat. Энергия 2018, 3, 1076. [Google Scholar]
11. Ли С., Ван Х., Катберт Дж., Лю Т., Уитакр Дж. Ф., Матияшевски К., Джоуль 2019, 3, 1637. [Google Scholar]
12.
Цао З., Ли Б., Ян С., Adv. Матер.
2019, 31, 1
0. [PubMed] [Google Scholar]
13. Фан С., Цзи С., Чен Л., Чен Дж., Дэн Т., Хань Ф., Юэ Дж., Пяо Н., Ван Р., Чжоу С., Сяо С., Чен Л., Ван С. ., нац. Энергия 2019, 4, 882. [Google Scholar]
14. Tikekar M.D., Choudhury S., Tu Z., Archer L.A., Nat. Энергия 2016, 1, 16114. [Google Scholar]
15. Liu Y., Xiong S., Wang J., Jiao X., Li S., Zhang C., Song Z., Song J., Energy Storage Mater. 2019, 19, 24. [Google Scholar]
16. Ли Х., Рен С., Ню С., Ю Л., Энгельхард М. Х., Чо И., Рё М.-Х., Джин Х. С., Ким Х.-Т., Лю Дж., Сюй В., Чжан Дж. .-Г., Adv. Функц. Матер.
2017, 27, 1704391. [Google Scholar]
Ли Х., Рен С., Ню С., Ю Л., Энгельхард М. Х., Чо И., Рё М.-Х., Джин Х. С., Ким Х.-Т., Лю Дж., Сюй В., Чжан Дж. .-Г., Adv. Функц. Матер.
2017, 27, 1704391. [Google Scholar]
17. Liu Y., Xiong S., Deng J., Jiao X., Song B., Matic A., Song J., Sci. Китай Матер. 2020, 63, 1036. [Google Scholar]
18. Лю Дж., Бао З. Н., Цуй Ю., Дуфек Э. Дж., Гуденаф Дж. Б., Халифа П., Ли К. Ю., Лиав Б. Ю., Лю П., Мантирам А., Мэн Ю. С., Субраманиан В. Р., Тони М. Ф., Вишванатан В. В., Уиттингем М. С., Xiao J., Xu W., Yang J.H., Yang X.Q., Zhang J.G., Nat. Энергия 2019, 4, 180. [Google Scholar]
19. Лю Д., Шадике З., Лин Р., Цянь К., Ли Х., Ли К., Ван С., Юй Ц., Лю М., Ганапати С., Цинь С., Ян К.-Х. , Wagemaker M., Kang F., Yang X.-Q., Li B., Adv. Матер. 2019, 31, 1806620. [PubMed] [Google Scholar]
20. Ли Ю., Ци Ю., Energy Environ. науч. 2019, 12, 1286. [Google Scholar]
21. Gaissmaier D., Fantauzzi D., Jacob T., J. Chem. физ. 2019, 150, 041723. [PubMed] [Google Scholar]
22. Fan Y., Wang T., Legut D., Zhang Q., J. Energy Chem.
2019, 39, 160. [Google Scholar]
Fan Y., Wang T., Legut D., Zhang Q., J. Energy Chem.
2019, 39, 160. [Google Scholar]
23. Тевари Д., Мукерджи П. П., J. Mater. хим. А 2019, 7, 4668. [Google Scholar]
24. Ожабес Ю., Гунселер Д., Ариас Т. А., 2015, arXiv:1504.05799.
25. Линг С., Банерджи Д., Мацуи М., Электрохим. Акта 2012, 76, 270. [Google Scholar]
26. Флери В., Шазавиль Ж.-Н., Россо М., Саповал Б., Дж. Электроанал. хим. 1990, 290, 249. [Google Scholar]
27. Chazalviel J., Phys. Преп. А 1990, 42, 7355. [PubMed] [Google Scholar]
28. Россо М., Бриссо С., Тейссо А., Долле М., Саннье Л., Тараскон Ж.-М., Буше Р., Ласко С., Электрохим. Акта 2006, 51, 5334. [Google Scholar]
29. Бай П., Ли Дж., Брашетт Ф. Р., Базант М. З., Energy Environ. науч. 2016, 9, 3221. [Google Scholar]
30. Бай П., Го Дж. З., Ван М., Кусима А., Су Л., Ли Дж., Брашетт Ф. Р., Базант М. З., Джоуль 2018, 2, 2434. [Google Scholar]
31.
Нациавас П. П., Вайнберг К., Розато Д., Ортиз М.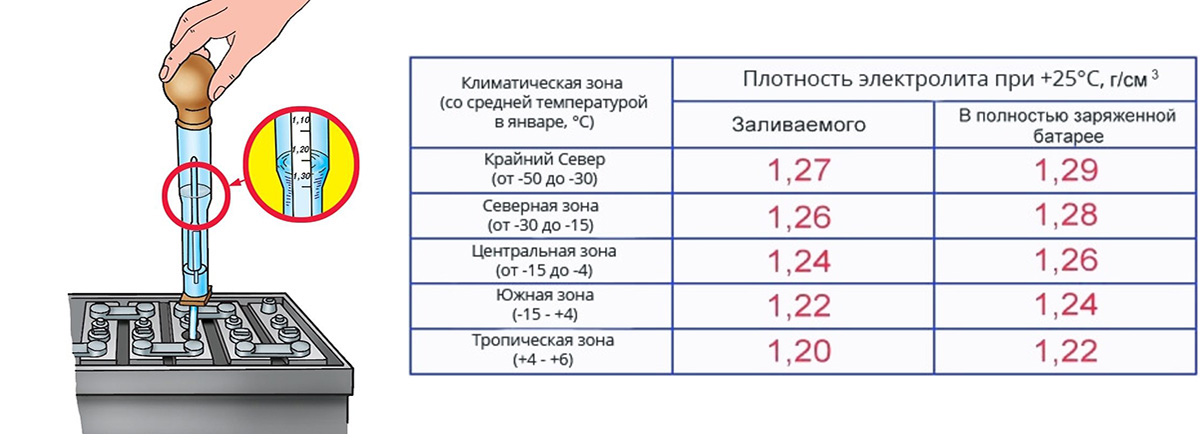 , Дж. Мех. физ. Твердые тела
2016, 95, 92. [Google Scholar]
, Дж. Мех. физ. Твердые тела
2016, 95, 92. [Google Scholar]
32. Чен Л., Чжан Х.В., Лян Л.Ю., Лю З., Ци Ю., Лу П., Чен Дж., Чен Л.-К., Дж. Источники энергии 2015, 300, 376. [Google Scholar]
33. Норсков Дж. К., Блигаард Т., Логадотир А., Китчин Дж. Р., Чен Дж. Г., Панделов С., Стимминг У., J. Electrochem. соц. 2005, 152, J23. [Google Scholar]
34. Шенви Н., Кемпе Дж., Уэйли К.Б., Phys. Преп. А 2003, 67, 052307. [Google Scholar]
35. Окадзима Ю., Шибута Ю., Судзуки Т., Comput. Матер. науч. 2010, 50, 118. [Google Scholar]
36. Николич Н. Д., Попов К. И., Живкович П. М., Бранкович Г., Дж. Электроанал. хим. 2013, 691, 66. [Google Scholar]
37. Monroe C., Newman J., J. Electrochem. соц. 2003, 150, А1377. [Google Scholar]
38. Галова М., Кладекова Д., Surf. Технол. 1980, 11, 371. [Google Scholar]
39. Рейичи Ю., Тошикацу С., Юкио М., Ясухару О., Bull. хим. соц. Япония. 1969, 42, 2741. [Google Scholar]
40.
Liu Y., Xu X., Jiao X. , Guo L., Song Z., Xiong S., Song J., Chem. англ. Дж.
2019, 371, 294. [Google Scholar]
, Guo L., Song Z., Xiong S., Song J., Chem. англ. Дж.
2019, 371, 294. [Google Scholar]
41. Бокрис Дж. О. М., Разумней Г. А., Фундаментальные аспекты электрокристаллизации, Springer, Нью-Йорк: 1967. [Google Scholar]
42. Эли Д. Р., Яна А., Гарсия Р. Э., Дж. Источники питания 2014, 272, 581. [Google Scholar]
43. Ely D.R., García R.E., J. Electrochem. соц. 2013, 160, А662. [Академия Google]
44. Wang J., Huang W., Pei A., Li Y., Shi F., Yu X., Cui Y., Nat. Энергия 2019, 4, 664. [Google Scholar]
45. Stark J.K., Ding Y., Kohl P.A., J. Electrochem. соц. 2013, 160, Д337. [Google Scholar]
46. Aguilera L., Xiong S., Scheers J., Matic A., J. Mol. жидкость 2015, 210, 238. [Google Scholar]
47. Тамура Т., Йошида К., Хачида Т., Цучия М., Накамура М., Казуэ Ю., Тачикава Н., Докко К., Ватанабэ М., Chem. лат. 2010, 39, 753. [Google Scholar]
48. Xiong S., Diao Y., Hong X., Chen Y., Xie K., J. Electroanal. хим. 2014, 719, 122. [Google Scholar]
49. Qian J., Henderson W.A., Xu W., Bhattacharya P., Engelhard M., Borodin O., Zhang J.G., Nat. коммун.
2015, 6, 6362. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Qian J., Henderson W.A., Xu W., Bhattacharya P., Engelhard M., Borodin O., Zhang J.G., Nat. коммун.
2015, 6, 6362. [Бесплатная статья PMC] [PubMed] [Google Scholar]
50. Фанг С., Ли Дж., Чжан М., Чжан Ю., Ян Ф., Ли Дж. З., Ли М. Х., Альварадо Дж., Шредер М. А., Ян Ю., Лу Б., Уильямс Н., Сеха М., Ян Л., Цай М., Гу Дж., Сюй К., Ван С., Мэн Ю. С., Природа 2019, 572, 511. [PubMed] [Google Scholar]
51. Cohen Y.S., Cohen Y., Aurbach D., J. Phys. хим. Б 2000, 104, 12282. [Google Scholar]
52. Zheng J., Kim M.S., Tu Z., Choudhury S., Tang T., Archer L.A., Chem. соц. преп. 2020, 49, 2701. [PubMed] [Google Scholar]
53. Yang C.P., Yin Y.X., Zhang S.F., Li N.W., Guo Y.G., Nat. коммун. 2015, 6, 8058. [Бесплатная статья PMC] [PubMed] [Google Scholar]
54. Zhang X., Lv R., Wang A., Guo W., Liu X., Luo J., Angew. хим., межд. Эд. 2018, 57, 15028. [PubMed] [Google Scholar]
55.
Лю Л., Инь Ю.-X., Ли Дж.-Ю., Ли Н.-В., Цзэн X.-X., Е Х., Го Ю.-Г., Ван Л.-Дж.

 ⓘ Объемный расход [Q]
ⓘ Объемный расход [Q] ⓘ Температура окружающего воздуха [θ окружающая среда ]
ⓘ Температура окружающего воздуха [θ окружающая среда ] (Великобритания)Фунт на галлон (США)Слаг на кубический футСлаг на кубический дюймСлаг на кубический ярдТонна (длинная) на кубический ярдТонна (короткая) на кубический ярд
(Великобритания)Фунт на галлон (США)Слаг на кубический футСлаг на кубический дюймСлаг на кубический ярдТонна (длинная) на кубический ярдТонна (короткая) на кубический ярд