6. Пониженная или повышенная плотность электролита
Плотность электролита понижается в основном при разряде аккумуляторов и сульфатации электродов. При понижении плотности электролита увеличивается внутренние сопротивление батареи и снижается ее емкость. В результате падает сила тока в цепи работающего стартера, а поэтому уменьшаются частота вращения якоря и мощность стартера, что затрудняет пуск двигателя, особенно в зимнее время. Кроме того, в зимнее время может произойти замерзание электролита.
Плотность электролита повышается при испарении воды во время перезаряда аккумуляторов или в результате доливки в аккумуляторы электролита, а не воды. В случае повышения плотности электролита больше нормы ускоряется разрушение активного вещества и решеток электродов, а также ускоряется сульфатация активного вещества, что снижает емкость и срок службы батареи.
Плотность
электролита измеряют денсиметром или
плотнометром (рис. 3). Денсиметр имеет
цену деления 10 кг/м
3). Денсиметр имеет
цену деления 10 кг/м
Таблица 1. Температурные поправки к показаниям денсиметра для приведения плотности электролита к 25 єС
Температура электролита, єС | Поправка, г/см3 | Температура электролита, єС | Поправка, г/см3 |
-65. ..-50 ..-50 | -0,06 | -4…+10 | -0,02 |
-49…-35 | -0,05 | +11…+25 | -0,01 |
-34…-20 | -0,04 | +26…+40 | +0,01 |
-19…-5 | -0,03 | +41… | +0,02 |
Более точно температурную поправку к показаниям денсиметра можно подсчитать. На каждый градус изменения температуры в показания денсиметра следует вводить поправку, равную 0,7 кг/м3 (0,0007 г/см3). Если температура выше 25 єС, поправку к показаниям прибавляют, если ниже — вычитают.
Для измерения плотности электролита денсиметром необходимо с помощью резиновой груши (см. рис. 25) несколько раз (для удаления пузырьков воздуха со стенок колбы 1) набрать электролит до всплытия поплавка 2. Не вынимая денсиметр из аккумулятора и не допуская касания поплавком стенок колбы, по впадине метиска электролита в колбе и по шкале поплавка определяют плотность электролита.
В
корпусе плотнометра 3 помещены
семь пластмассовых поплавков различной
массы. Поплавок, регистрирующий плотность
1,27 г/см3,
окрашен. На корпусе против каждого
поплавка выполнена надпись наименьшей
плотности, при которой всплывает
поплавок. Плотность определяют по тому
всплывающему поплавку, против которого
выполнена надпись с большей цифрой.
На корпусе против каждого
поплавка выполнена надпись наименьшей
плотности, при которой всплывает
поплавок. Плотность определяют по тому
всплывающему поплавку, против которого
выполнена надпись с большей цифрой.
Определение плотности производят по положению поплавков через некоторое время после заполнения корпуса электролитом, что необходимо для выравнивания температуры электролита и поплавков. После этого поплавки займут определенное положение, т. е. опустятся или поднимутся.
Плотность
электролита в проверяемых аккумуляторах
батареи не должна отличатся более чем
на 0,01 г/см Значения плотности электролита в
аккумуляторах батареи в зависимости
от климатического района эксплуатации
и времени года приведены в табл. 2
Значения плотности электролита в
аккумуляторах батареи в зависимости
от климатического района эксплуатации
и времени года приведены в табл. 2
Таблица 2. Нормы плотности электролита*
Климатические районы | Время года | Плотность электролита, приведенная к 25 єС, г/см3 | |
заливаемого | заряженной батареи | ||
Очень холодный | Зима | 1,28 | 1,30 |
Лето | 1,24 | 1,26 | |
Холодный | Круглый год | 1,26 | 1,28 |
Умеренный | Круглый год | 1,24 | 1,26 |
Теплый, влажный, жаркий, сухой | Круглый год | 1,21 | 1,23 |
По
плотности электролита в аккумуляторах
судят о степени разреженности аккумуляторов
и о пригодности всей батареи к эксплуатации.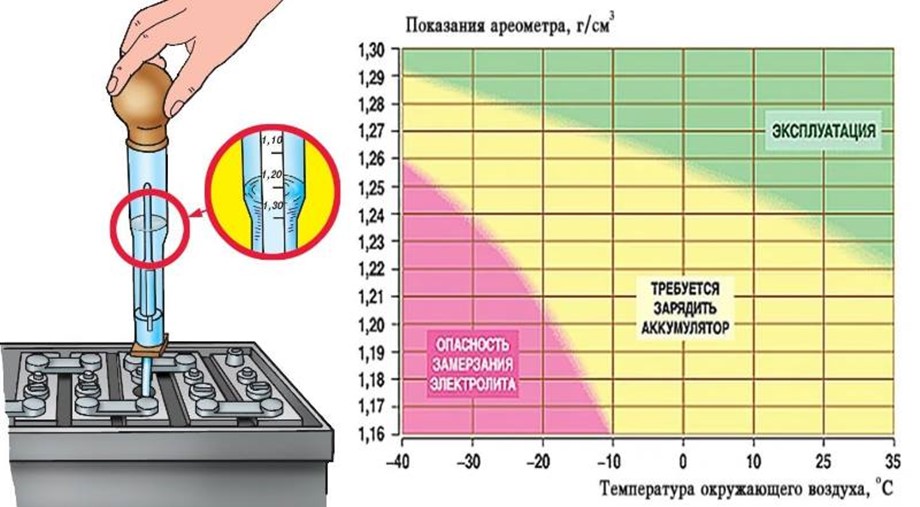
Снижение плотности электролита на 0,01 г/см3 по отношению к плотности у полностью заряженного аккумулятора соответствует разряду аккумулятора соответствует разряду аккумулятора примерно на 6%. Например, если плотность электролита в заряженном аккумуляторе была 1,28 г/см3, а измеренная при +25 єС — 1,22 г/см3, то плотность понизилась на 36%.
Степень разряженности всей батареи определяется по степени разряженности всей батареи определяется по степени разряженности аккумулятора, имеющего самую низкую плотность электролита. Батареи, разряженные более чем на 25% зимой и более чем на 50% летом, снимают с эксплуатации и заряжают.
В зимнее время на автомобилях с наружной установкой аккумуляторных батарей их необходимо укреплять, а при эксплуатации батарей в очень холодной зоне увеличить плотность электролита (см. табл. 2).
Короткое
замыкание электродов происходит при
разрушении сепараторов, большом выпадении
активного вещества на дно бака и на
кромках сепараторов, выступающих над
верхней частью электродов. При работе
батареи электролит в аккумуляторах все
время перемешивается между нижней и
верхней частями бака аккумулятора и
переносит частицы высыпавшегося
активного вещества на верхние торцы
электродов и сепараторов, что и вызывает
частичное замыкание электродов. Частичное
замыкание электродов возникает и при
образовании наростов свинца на кромках
минусовых электродов.
При работе
батареи электролит в аккумуляторах все
время перемешивается между нижней и
верхней частями бака аккумулятора и
переносит частицы высыпавшегося
активного вещества на верхние торцы
электродов и сепараторов, что и вызывает
частичное замыкание электродов. Частичное
замыкание электродов возникает и при
образовании наростов свинца на кромках
минусовых электродов.
Короткозамкнутый аккумулятор быстро разряжается, и электроды его сульфатируются. Плотность электролита в таком аккумуляторе будет менее нормы.
При полном коротком замыкании аккумулятор зарядить нельзя, а напряжение его будет равно нулю. Короткое замыкание пластин определяется сравнением ЭДС аккумуляторов батареи с напряжением, измеренным вольтметром без нагрузки (Рис. 4).
Подсчитывая ЭДС по плотности электролита:
ЭДС = 0,84 + г25,
где
г25 —
плотность электролита, приведенная к
25 єС, г/см3.
Если замеренное напряжение будет меньше ЭДС, подсчитанной по плотности электролита (меньше 2 В), то в аккумуляторе имеется частичное короткое замыкание электродов. В случае полного короткого замыкания показание вольтметра будет равно нулю.
При полном коротком замыкании батарею нужно ремонтировать. Для устранения частичного замыкания электродов аккумулятор промывают дистиллированной водой.
Плотность электролита в аккумуляторе – важные данные
Падение плотности электролита в аккумуляторе автомобиля – одна из широко известных проблем, с которой нередко сталкиваются автовладельцы. Поэтому мы решили рассмотреть её в деталях. Наша сегодняшняя статья поможет вам узнать, как измерить плотность электролита и каким должен быть его уровень в АКБ.
Во многих случаях снижение плотности электролита связано с обыкновенным испарением раствора. Зачастую такое происходит после закипания жидкости в случае слишком длительной зарядки. Это одна из причин того, что аккумулятор начал быстро разряжаться.
Это одна из причин того, что аккумулятор начал быстро разряжаться.
Для того чтобы поддерживать в АКБ необходимое количество жидкости используется дистиллированная вода. Однако далеко не все понимают, что нужно также следить за плотностью электролита. Ведь выкипает не лишь вода, но и электролит. В итоге через определенный промежуток времени его плотность опускается до минимальных значений. Именно в таких случаях автомобилистам приходится узнавать, как повысить плотность аккумулятора. Что же понадобится для восстановления работоспособности автомобильной АКБ?
Полезные рекомендации
- Определять плотность электролита рекомендуется при температуре воздуха около 20-22°С.
- Придерживайтесь правил безопасности во время использования кислоты (перчатки и очки не помешают точно).
- Поскольку плотность воды и электролита отличается, во время разведения последнего помните, что кислоту нужно добавлять в воду. В противном случае ожоги могут быть очень сильными («Химик, запомни как оду — льют кислоту в воду»).

- Предварительно подыщите подходящие емкости для замены и разведения электролита.
- Аккумулятор нельзя переворачивать вверх дном.
- После зарядки АКБ плотность электролита в нём возрастает.
- Упомянутые далее действия и показатели плотности электролита актуальны для кислотных аккумуляторов.
Инструменты и материалы
- Ареометр (определяет плотность электролита).
- Резиновая груша.
- Мерная емкость.
- Вода дистиллированная.
- Кислота для аккумулятора.
- Электролит.
- Раствор соды пищевой.
- Дрель.
- Паяльник.
Как определить уровень электролита в аккумуляторе
В жаркое время вода испаряется гораздо быстрее, чем зимой. Поэтому уровень электролита в АКБ автомобиля рекомендуется регулярно проверять именно в теплый период года (идеальный вариант – ежемесячно). Если корпус аккумулятора изготовлен со слегка прозрачного пластика, можно визуально определить приблизительный уровень электролита в банках. Помочь также могут соответствующие метки на корпусе, с помощью которых можно установить, надо ли доливать дистиллированную воду.
Помочь также могут соответствующие метки на корпусе, с помощью которых можно установить, надо ли доливать дистиллированную воду.
Если же корпус далеко не прозрачный, придется открутить пробки и определить уровень с помощью тонкой трубки из стекла. Необходимо опустить трубку в заливное отверстие, чтобы она коснулась верхней сетки пластин, после чего закрыть верхнее её отверстие с помощью пальца и вытащить. Оптимальный уровень электролита аккумулятора должен составлять в пределах 10-15 миллиметров.
Плотность электролита в цифрах
Рекомендации по увеличению плотности электролита
- В первую очередь следует определить плотность электролита в разных банках аккумулятора. Многие автолюбители задают вопрос о том, какая должна быть плотность аккумулятора. В данном случае необходимо учитывать местные условия климата. Например, на севере страны данный показатель будет более высоким, по сравнению с югом. Оптимальной является плотность раствора в пределах 1.25-1.
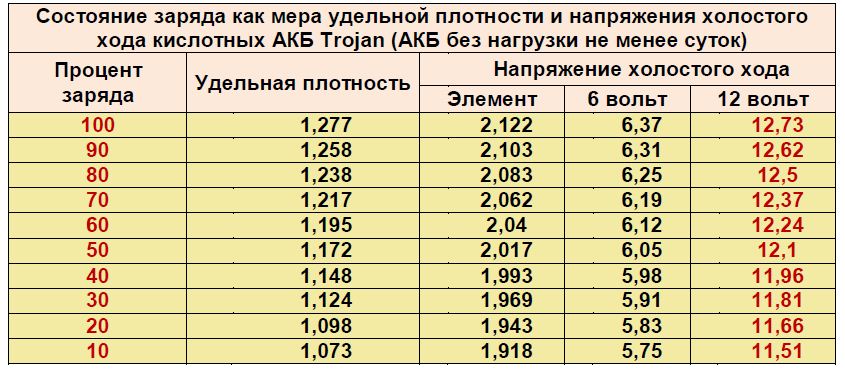 29. Показатели в разных банках не должны отличаться больше, чем на 0.01. Если результаты измерений показали, что плотность равна 1.18-1.20, необходимо просто добавить электролит, имеющий плотность 1.27.
29. Показатели в разных банках не должны отличаться больше, чем на 0.01. Если результаты измерений показали, что плотность равна 1.18-1.20, необходимо просто добавить электролит, имеющий плотность 1.27. - Выбираем одну из банок, из которой следует откачать максимальное количество прежнего раствора, воспользовавшись резиновой грушей. Не забудьте определить объем полученной жидкости.
- Добавляем новый электролит, причем его количество должно быть вдвое меньшим, чем количество слитого.
- Трясем и качаем АКБ в разные стороны, чтобы обеспечить перемешивание жидкостей.
- Определяем плотность. В случае необходимости добавляем вторую часть электролита. Осуществлять вышеупомянутые действия необходимо до того времени, пока плотность не будет подходящей.
- Далее доливаем требуемое количество дистиллированной воды.
Как поднять плотность в аккумуляторе – два варианта
- Если плотность не достигает даже 1.18, необходимо использовать аккумуляторная кислота, поскольку она имеет гораздо более высокую плотность.
 Все нужно делать в такой же последовательности, как и в случае заливки нового электролита.
Все нужно делать в такой же последовательности, как и в случае заливки нового электролита. - В некоторых случаях может понадобиться полная замена электролита. Для этого нужно воспользоваться резиновой грушей и откачать максимальное количество жидкости и полностью закрыть отверстия для вентиляции на банках АКБ. Аккумулятор надо положить на бок и просверлить отверстия, используя сверло на 3-5 миллиметров. Отверстия необходимо сделать в каждой банке. Затем выполняется промывка аккумулятора с помощью дистиллированной воды. В конце отверстия придется запаять, для чего применяют пластмассу, обладающую устойчивостью к воздействию кислоты.
Для этих целей прекрасно подойдут старые пробки банок аккумулятора.
На финальном этапе производим заливку нового электролита. Рекомендуется применять раствор, приготовленный своими силами. Его плотность должна быть немного выше той, которая рекомендована для ваших климатических условий.
Не забывайте, что наши советы о том, как поднять плотность электролита в аккумуляторе, не помогут вам в том случае, если АКБ сильно изношена. Поскольку в автомобильном аккумуляторе протекают определенные химические процессы, даже замена электролита не может обеспечить долгий срок эксплуатации АКБ, которым и отличается новый аккумулятор.
Поскольку в автомобильном аккумуляторе протекают определенные химические процессы, даже замена электролита не может обеспечить долгий срок эксплуатации АКБ, которым и отличается новый аккумулятор.
Иногда приходится просто покупать новый аккумулятор, о выборе которого по марке машины написано тут.
Предыдущая запись
Следующая запись
Экспериментальные измерения и моделирование вязкости и плотности тройных растворов хлоридов кальция и калия
1. Руис-Лламас А., Масиас-Салинас Р. Моделирование динамической вязкости ионных растворов. Инд.Инж. хим. Рез. 2015;54:7169–7179. doi: 10.1021/acs.iecr.5b01664. [CrossRef] [Google Scholar]
2. Магомедов Ю.Б., Алхасов А.Б. Динамическая вязкость водных растворов солей при высоких температурах, давлениях и концентрациях. Дж. Инж. физ. Термофиз. 2007; 80: 1216–1222. дои: 10.1007/s10891-007-0157-й. [CrossRef] [Google Scholar]
3. Qiblawey H, Abu Jdayil B. Вязкость и плотность тройного раствора хлорида магния + хлорид натрия + вода от (293,15 до 318,15 K) J. Chem. англ. Данные. 2010;55:3322–3326. дои: 10.1021/je100111w. [CrossRef] [Google Scholar]
Chem. англ. Данные. 2010;55:3322–3326. дои: 10.1021/je100111w. [CrossRef] [Google Scholar]
4. Васкес-Кастильоа Г., Иглесиас-Сильва Г.В., Холл К.Р. Расширение модели Макаллистера для корреляции кинематической вязкости растворов электролитов. Равновесие жидкой фазы. 2013; 58:44–49. doi: 10.1016/j.fluid.2013.07.052. [Перекрестная ссылка] [Академия Google]
5. Голдсак Д., Франкетто Р. Вязкость концентрированных растворов электролитов I. Концентрационная зависимость при фиксированной температуре. Может. Дж. Хим. 1977; 55: 1062–1072. дои: 10.1139/v77-148. [CrossRef] [Google Scholar]
6. Majali F, Ettouney H, Abdel-Jabbar N, Qiblawey H. Конструкция и эксплуатационные характеристики установок обратного осмоса пилотного масштаба. Опреснение. 2008; 222:441–450. doi: 10.1016/j.desal.2007.01.169. [CrossRef] [Google Scholar]
7. Qiblawey H, Banat F, Al-Nasser Q. Лабораторная установка для очистки воды с использованием бытовой установки обратного осмоса с фотоэлектрическим приводом. Десалин. Водное лечение. 2009 г.;7:53–59. doi: 10.5004/dwt.2009.695. [CrossRef] [Google Scholar]
Десалин. Водное лечение. 2009 г.;7:53–59. doi: 10.5004/dwt.2009.695. [CrossRef] [Google Scholar]
8. Панагопулос А., Хараламбус К.Дж., Лоизиду М. Методы утилизации рассола и технологии очистки опреснения — обзор. науч. Общая окружающая среда. 2019;693:133545. doi: 10.1016/j.scitotenv.2019.07.351. [PubMed] [CrossRef] [Google Scholar]
9. Menon AK, Haechler I, Kaur S, et al. Усиленное солнечное испарение с использованием фототермического зонта для управления сточными водами. Нац. Поддерживать. 2020;3:144–151. doi: 10.1038/s41893-019-0445-5. [CrossRef] [Google Scholar]
10. Mohameed H, Ulrich J. Влияние значения pH на скорость роста и растворения хлорида калия. Кристалл. Рез. Технол. 1996; 31: 27–31. doi: 10.1002/crat.2170310107. [CrossRef] [Google Scholar]
11. Mohameed H, Abdel-Jabbar N, Takrouri K, Nasr A. Оптимальная стратегия охлаждения на основе моделей для периодических процессов кристаллизации. хим. англ. Рез. Дес. 2003; 81: 578–584. doi: 10.1205/026387603765444528. [CrossRef] [Google Scholar]
[CrossRef] [Google Scholar]
12. Ахмад Н., Баддур Р. Обзор источников, эффектов, методов утилизации и правил попадания рассола в морскую среду. Океанское побережье. Управление 2014;87:1–7. doi: 10.1016/j.ocecoaman.2013.10.020. [Перекрестная ссылка] [Академия Google]
13. Эрреро-Гонсалес М., Ной Адмон Н., Домингес-Рамос А., Ибаньес Р., Вольфсон А., Ирабиен А. Оценка экологической устойчивости валоризации рассола методом обратного осмоса морской воды с помощью электродиализа с биполярными мембранами. Окружающая среда. науч. Загрязн. Рез. 2020;27:1256–1266. doi: 10.1007/s11356-019-04788-w. [PubMed] [CrossRef] [Google Scholar]
14. Pollyea R, Chapman M, Jayne R, Hao WuH. Сброс сточных вод с нефтяных месторождений с высокой плотностью вызывает более глубокие, сильные и продолжительные землетрясения. Нац. коммун. 2019;10:3077. doi: 10.1038/s41467-019-11029-8. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
15. Kim B, et al. Очистка высокоминерализованных солевых растворов многоступенчатым ионно-концентрационным поляризационным опреснением. науч. Отчет 2016; 6: 31850. doi: 10.1038/srep31850. [Статья бесплатно PMC] [PubMed] [CrossRef] [Google Scholar]
науч. Отчет 2016; 6: 31850. doi: 10.1038/srep31850. [Статья бесплатно PMC] [PubMed] [CrossRef] [Google Scholar]
16. Джованни Г., Пабло С. Эффекты кинетической вязкости растворителя как зонды для изучения механизмов действия ферментов. Биохимия. 2018;57:3445–3453. doi: 10.1021/acs.biochem.8b00232. [PubMed] [CrossRef] [Академия Google]
17. Huitian J, Walid E, Aboudheir A, Mahinpey N. Плотность, вязкость, показатель преломления и электропроводность деградированных растворов моноэтаноламина при стандартных температурах. Дж. Хим. англ. Данные. 2018; 63:1969–1976. doi: 10.1021/acs.jced.7b01101. [CrossRef] [Google Scholar]
18. Qiblawey H, Arshad MH, Easa A, Atilhan M. Вязкость и плотность тройного раствора хлорида кальция + хлорид натрия + вода от T = (293,15 до 323,15) K. J. Chem. англ. Данные. 2014;59:2133–2143. doi: 10.1021/je500070k. [Перекрестная ссылка] [Академия Google]
19. Чжан Х.Л., Чен Г.Х., Хань С.Дж. Вязкость и плотность H 2 O + NaCl + CaCl 2 и H 2 O + KCl + CaCl 2 при 298,15 К. J. Chem. англ. Данные. 1997; 42: 526–530. doi: 10.1021/je9602733. [CrossRef] [Google Scholar]
J. Chem. англ. Данные. 1997; 42: 526–530. doi: 10.1021/je9602733. [CrossRef] [Google Scholar]
20. Out DJP, Los JM. Вязкость водного раствора одновалентных электролитов от 5 до 95 °С. Дж. Солют. хим. 1980; 9:19–35. doi: 10.1007/BF00650134. [CrossRef] [Google Scholar]
21. Цзян Дж., Стэнли И.С. Новая модель вязкости растворов электролитов. Инд.Инж. хим. Рез. 2003;42:6267–6272. doi: 10.1021/ie0210659. [CrossRef] [Google Scholar]
22. Кестин Дж., Шенкленд И.Р., Пол Р. Вязкость водных растворов KCl в диапазоне температур 25–200 и диапазоне давлений 0,1–30 МПа. Междунар. Дж. Термофиз. 1981;2(4):301–314. doi: 10.1007/BF00498761. [CrossRef] [Google Scholar]
23. Каминский М. Концентрация и температурная зависимость вязкости водных растворов сильных электролитов. III. KCl, K 2 SO 4 , MgCl 2 , BeSO 4 и MgSO 4 растворы. З. Физ. хим. 1957; 12: 206–231. doi: 10.1524/зпч.1957.12.3_4.206. [CrossRef] [Google Scholar]
24. Маркус Ю. Влияние ионов на структуру воды: создание и разрушение структуры. хим. 2009; 109:1346–1370. doi: 10.1021/cr8003828. [PubMed] [CrossRef] [Google Scholar]
Маркус Ю. Влияние ионов на структуру воды: создание и разрушение структуры. хим. 2009; 109:1346–1370. doi: 10.1021/cr8003828. [PubMed] [CrossRef] [Google Scholar]
25. Leyendekkers JV. Вязкость водных растворов электролитов и модель ТТГ. Дж. Солют. хим. 1979;8(12):853–859. doi: 10.1007/BF00644882. [Перекрестная ссылка] [Академия Google]
26. Goldsack DE, Franchetto RC. Вязкость концентрированных растворов электролитов. II. Температурная зависимость. Может. Дж. Хим. 1978; 56: 1442–1450. дои: 10.1139/v78-236. [CrossRef] [Google Scholar]
27. Zafarani-Moattar MT, Majdan-Cegincara RM. Моделирование и прогнозирование вязкости водных смешанных растворов электролитов. Инд.Инж. хим. Рез. 2009; 48: 5833–5844. doi: 10.1021/ie801933u. [CrossRef] [Google Scholar]
28. Hu Y, Zhang X, Jin C, Peng X. Теория полуидеального решения. 3. Расширение вязкости многокомпонентных водных растворов. Дж. Солют. хим. 2010;39: 1828–1844. doi: 10.1007/s10953-010-9565-2. [CrossRef] [Google Scholar]
29. Абдулагатов ИМ, Азизов НД. Вязкость водных растворов хлорида кальция при высоких температурах и высоких давлениях. Равновесие жидкой фазы. 2006; 240:204–219. doi: 10.1016/j.fluid.2005.12.036. [CrossRef] [Google Scholar]
Абдулагатов ИМ, Азизов НД. Вязкость водных растворов хлорида кальция при высоких температурах и высоких давлениях. Равновесие жидкой фазы. 2006; 240:204–219. doi: 10.1016/j.fluid.2005.12.036. [CrossRef] [Google Scholar]
30. Zhang J, Moosavi M, Rostami AA, Vargas MM. Моделирование вязкости смесей вода + алкандиолы. Дж. Мол. жидкость 2018; 249:326–333. doi: 10.1016/j.molliq.2017.11.005. [Перекрестная ссылка] [Академия Google]
31. Лалиберте М. Модель расчета теплоемкости водных растворов с обновленными данными о плотности и вязкости. Дж. Хим. англ. Данные. 2009; 54: 1725–1760. doi: 10.1021/je8008123. [CrossRef] [Google Scholar]
32. Гонсалвес Ф.А., Кестин Дж. Вязкость растворов CaCl 2 в диапазоне 20–50 °C. Бер. Бунзенгес. физ. хим. 1979; 83: 24–27. doi: 10.1002/bbpc.19790830105. [CrossRef] [Google Scholar]
33. Александров А.А., Джураева Е.В., Утенков В.Ф. Вязкость водного раствора хлорида натрия. Высокий темп. 2012;50:354–358. дои: 10.1134/S0018151X12030029. [CrossRef] [Google Scholar]
[CrossRef] [Google Scholar]
34. Кестин Дж., Халифа Х.Э., Коррейя Р.Дж. Таблицы динамической и кинематической вязкости водных растворов NaCl в интервале температур 20–150 °С и диапазоне давлений 0,1–35 МПа. Дж. Физ. хим. Ссылка Данные. 1981; 10: 71–80. дои: 10.1063/1.555641. [CrossRef] [Google Scholar]
35. Hu YF, Lee H. Прогнозирование вязкости смешанного раствора электролита на основе абсолютной теории Эрвина и полуидеальной модели гидратации. Электрохим. Акта. 2003;48:1789–1796. doi: 10.1016/S0013-4686(03)00226-3. [CrossRef] [Google Scholar]
36. Glasstone S, Laidler KJ, Eyring H. Theory of Rate Process. Нью-Йорк: Макгроу-Хилл; 1941. [Google Scholar]
37. Кумар А. Простые уравнения для прогнозирования объемных свойств водных концентрированных смесей электролитов. проц. Индийская акад. науч. хим. науч. 1986; 96: 97–101. [Google Scholar]
38. Yang J, et al. Систематическое изучение простых подходов к прогнозированию термодинамических и транспортных свойств многокомпонентных растворов. Инд.Инж. хим. Рез. 2010;49: 7671–7677. doi: 10.1021/ie100752w. [CrossRef] [Google Scholar]
Инд.Инж. хим. Рез. 2010;49: 7671–7677. doi: 10.1021/ie100752w. [CrossRef] [Google Scholar]
39. Махиуддин С., Исмаил К. Зависимость вязкости системы Mg(NO3) 2 –H 2 O от температуры и концентрации. Может. Дж. Хим. 1982; 60: 2883–2888. doi: 10.1139/v82-413. [CrossRef] [Google Scholar]
40. Махиуддин С., Исмаил К. Концентрационная зависимость вязкости водных растворов электролитов от более высокой концентрации. Дж. Физ. хим. 1983; 87: 5241–5244. doi: 10.1021/j150643a036. [Перекрестная ссылка] [Академия Google]
41. Афзал М., Салим М., Махмуд М.Т. Температурная и концентрационная зависимость вязкости водных электролитов от 20 до 50 °С. Хлориды Na+, K+, Mg2+, Ca2+, Ba2+, Sr2+, Co2+, Ni2+, Cu2+ и Cr3+ J. Chem. англ. Данные. 1989; 34: 339–346. doi: 10.1021/je00057a023. [CrossRef] [Google Scholar]
42. Goldsack DE, Franchetto AA. Вязкость концентрированных растворов электролитов. III. Закон смеси. Электрохим. Акта. 1977; 22: 1287–1294. doi: 10. 1016/0013-4686(77)87012-6. [Перекрестная ссылка] [Академия Google]
1016/0013-4686(77)87012-6. [Перекрестная ссылка] [Академия Google]
43. Новлан М.Ф. Прогнозирование вязкости растворов смешанных электролитов по данным по одной соли. Может. Дж. Хим. англ. 1980; 58: 637–642. doi: 10.1002/cjce.5450580514. [CrossRef] [Google Scholar]
44. Патвардхан В.С., Кумар А. Единый подход к прогнозированию термодинамических свойств водных растворов смешанных электролитов. Часть I: давление пара и теплота парообразования. Айше Дж. 1986; 32:1419–1428. doi: 10.1002/aic.690320903. [CrossRef] [Google Scholar]
45. Патвардхан В.С., Кумар А. Единый подход к прогнозированию термодинамических свойств водных растворов смешанных электролитов. Часть II: объемные, тепловые и другие свойства. Айше Дж. 1986;32:1429–1438. doi: 10.1002/aic.690320904. [CrossRef] [Google Scholar]
46. Sun, Y. et al. Экспериментальные и модельные исследования плотности водных растворов хлорида 1-карбоксиметил-3-метилимидазолия, хлорида 1-карбоксиметил-3-пропилимидазолия и хлорида 1-(2-гидроксиэтил)-3-пропилимидазолия при (29315, 29815 и 30315) ) К.

 +55
+55