Антифриз и его свойства
Search — Remove Shortcode
Поиск материалов
plg_search_jcomments
Войти
Регистрация
- Главная
- Техничка
- Антифриз и его свойства
Вторник, 26 апреля 2016
Каждый автовладелец хотел бы, чтобы двигатель его автомобиля всегда находился в исправном состоянии и не доставлял дополнительных забот. Охлаждающая жидкость (далее — ОЖ), о которой пойдёт речь в статье, является очень важным расходным материалом для работы силового агрегата.
Всем известно, что для обеспечения нормального функционирования двигателя его детали и узлы обязательно нужно охлаждать. Наиболее распространенными являются системы охлаждения с принудительной жидкостной циркуляцией. ОЖ, циркулирующие в этой системе, нагреваются более чем до 100 градусов, а остывание их происходит после остановки силового агрегата.

Стоит сразу прояснить, что российские охлаждающие жидкости, которые не замерзают под воздействием отрицательных температур, с давних пор носят название «тосол». Таким образом, тосол это то же самое, что и антифриз.
Все ОЖ состоят из воды и спектра специальных присадок. И вот этот раствор и защищает силовой агрегат автомобиля от превышения допустимой для работы мотора температуры и коррозии деталей системы охлаждения. К тому же, он же и помогает быстрее согреться мотору зимой. Если вы попробуете растереть пальцами антифриз, то обнаружите что он жирный. Это специальные присадки, которые служат для смазывания элементов системы охлаждения (например, помпы) и предотвращают рассыхание её резиновых и пластиковых элементов (патрубков, уплотнений и т.д.). Из этого становится понятным, что на защиту силового агрегата и системы охлаждения не последнее влияние оказывает качество ОЖ.

Перечислим основные свойства антифриза:
1. Способность сопротивляться отрицательным температурам, оставаясь в жидком состоянии;
2. Способность не закипать в определенном температурном диапазоне;
3. Негорючесть;
4. Антифриз не должен пениться;
5. Повышенная теплоемкость и теплопроводность;
6. Антифриз не должен быть агрессивным к материалам деталей системы охлаждения;
7. Охлаждающая жидкость должна оставаться в стабильном состоянии, независимо от того эксплуатируется она в системе охлаждения или хранится в канистре;
Когда необходимо производить замену антифриза в автомобиле?
Со временем характеристики антифриза меняются из-за постоянного воздействия на него то высокой, то низкой температуры. Помимо этого в систему охлаждения попадают и инородные вещества. Все это приводит к тому, что охлаждающая жидкость начинает пениться, агрессивно относиться к металлам, количество щелочи в ней начинает изменяться и т.

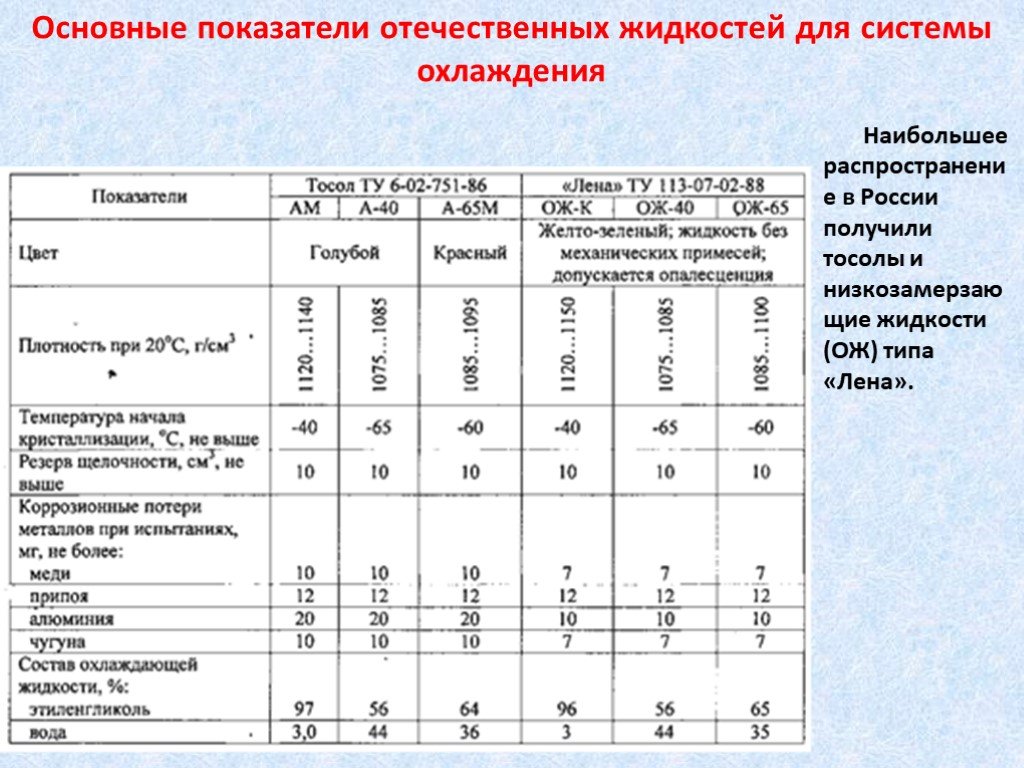
Раньше для производства «охлаждайки» применяли воду, спирт, специальные соли и глицерин. На сегодняшний момент химическая промышленность далеко шагнула вперед, и эти компоненты заменены современными составами, которые обладают улучшенными характеристиками.
Как правило, для систем охлаждения современных автомобилей применяют антифризы, основанием для которых служит этиленгликоль (его используют для снижения температуры замерзания растворов на основе воды).

Такая смесь отлично отвечает всем необходимым свойствам охлаждающей жидкости. А вот недостатком такой смеси является ядовитость этиленгликоля. При попадании его в организм человека сильно поражаются печень и почки, и хотя об этой опасности не знает только тот, кто не умеет читать, случаи отравления фиксировались. С точки зрения экологии обычный слив отработанного антифриза в канализацию или на землю также опасен. Из-за указанных выше факторов производителям пришлось искать более безопасную альтернативу.
Результатом стало появление охлаждающих жидкостей на основе пропиленгликоля. Хоть его полностью безвредным нельзя назвать, но зато он намного менее токсичен. Недостатком таких антифризов является повышенная вязкость при низкой температуре, что немного препятствует его прокачиванию по системе охлаждения. Но главным минусом такой жидкости стоит считать ее высокую цену. Именно по этой причине на рынке почти не представлено антифризов такого типа.
В плане отрицательного воздействия на детали системы охлаждения оба этих состав одинаковы.
 Как уже упоминалось выше, чтобы охлаждающая жидкость не воздействовала на металл, резину и пластиковые элементы в нее добавляют присадки. В зависимости от их состава антифризы и делятся на группы.
Как уже упоминалось выше, чтобы охлаждающая жидкость не воздействовала на металл, резину и пластиковые элементы в нее добавляют присадки. В зависимости от их состава антифризы и делятся на группы.Самой распространенной классификацией антифризов на территории СНГ является деление их по спецификации концерна VAG на: G11, G12 и G13 (силикатные, карбоксилатные и пропиленгликолевые соответственно).
Что касается цвета антифриза, то тут единого стандарта нет. Нитритные могут иметь синий или голубой цвет, группа G11 обычно зеленого цвета (хотя бывают желтые, синие и красные), G12 чаще всего красного цвета (но могут быть зеленого и желтого), G13 обычно имеют оранжевый или желтый цвет.
Какого цвета выбрать антифриз для своей машины?
Стоит отметить, что все антифризы изначально не имеют никакого цвета, в яркие цвета их специально окрашивает производитель. Помимо производственной и маркетинговой необходимости яркая окраска охлаждающей жидкости предупреждает об опасности (как было сказано выше — все антифризы ядовиты), также яркий цвет помогает визуально определить уровень антифриза в бачке.
 Еще потеря цвета указывает и на потерю свойств охлаждающей жидкости. Ели антифриз вашей машины стал непонятного бурого цвета, то его срочно нужно заменить.
Еще потеря цвета указывает и на потерю свойств охлаждающей жидкости. Ели антифриз вашей машины стал непонятного бурого цвета, то его срочно нужно заменить.Какие марки антифриза можно смешивать или доливать к другим маркам
Исходя из вышесказанного, не стоит при покупке антифриза ориентироваться на его цвет. В качестве ориентира стоит использовать инструкцию по эксплуатации вашего автомобиля, в которой будет указана спецификация рекомендованной жидкости, либо на маркировку, которую видно на бачке, либо на его крышке куда заливается ОЖ.
Что будет если смешать антифризы разных цветов?
Если вы хотите долить небольшое количество антифриза до уровня в бачке, то стоит покупать антифриз с тем же цветом.
Если антифриз нужного вам цвета отсутствует по какой-либо причине, а ситуация не терпит отлагательств, то перед доливкой в систему другого антифриза проведите не большой тест. Наберите, например, шприцем небольшое количество жидкости из расширительного бачка вашей машины и смешайте его в небольшой стеклянной емкости с жидкостью, которую собираетесь долить.
Если по прошествии небольшого промежутка времени визуальных изменений в получившемся растворе не произошло (хлопья, осадок и др.), то можете производить доливку.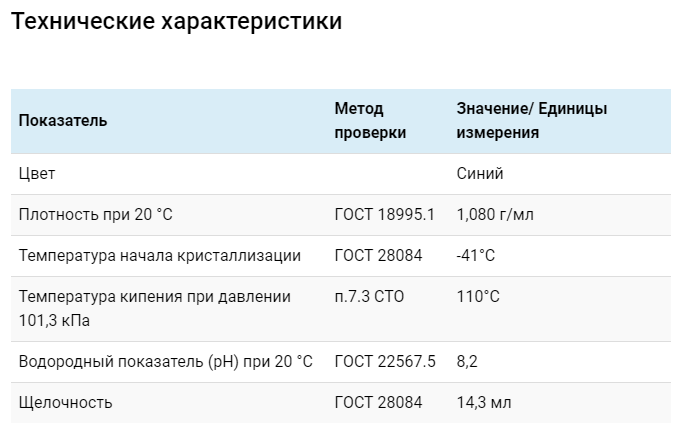
Хотелось бы остановиться на вопросе – почему вам приходится доливать антифриз? Если за время эксплуатации год-два машины уровень в бачке понизился на сантиметр (плюс-минус) то волноваться не стоит. В данном случае имело место его естественное испарение (вернее воды, которая присутствует в его составе). Но если вам часто приходится доливать антифриз в бачок – то стоит искать причину, по которой он уходит. И главное – куда он уходит. Для начала проверьте на герметичность систему охлаждения. Проще все это сделать так – утром отгоните автомобиль от места стоянки и исследуйте площадь, на которой стоял ваш автомобиль. Если там все сухо, и следов протекания нет, то дело осложняется. Скорее всего, антифриз уходит через пробитую прокладку ГБЦ в блок двигателя. Об этом вам скажет возросший уровень масла и его состояние – масло будет с желтыми сгустками и неоднородного состояния.

Если вам предстоит полная смена антифриза в системе, а нужной вам спецификации нет в магазине, то можно брать жидкость любого цвета.
Как именно самостоятельно слить антифриз из системы? Начнем с того, что полностью его вы не сольете, часть его все равно останется в блоке. Для слива предусмотрен краник, который обычно располагается внизу радиатора, если краника нет, то необходимо просто ослабить хомут нижнего патрубка радиатора, после чего снять патрубок. Важно! Процедуру стоит выполнять только на остывшем двигателе.
Далее залейте немного антифриза в систему через крышку радиатора (именно через нее), и когда его соты покроются жидкостью, заведите мотор. Через соты начнет выходить воздух. Далее постепенно доливайте ОЖ до необходимого уровня.
Стоит ли промывать систему при замене антифриза?
Это зависит от цвета и состояния слитой жидкости.
 Если она непонятного или бурого цвета, с грязью и инородными вкраплениями, то необходимо промыть систему. Чем промывать? В идеале, промывать необходимо тем, что обираетесь заливать, чтобы уже не смешивать чистый антифриз ни с чем. Но в целях экономии большинство автовладельцев промывают систему водой.
Если она непонятного или бурого цвета, с грязью и инородными вкраплениями, то необходимо промыть систему. Чем промывать? В идеале, промывать необходимо тем, что обираетесь заливать, чтобы уже не смешивать чистый антифриз ни с чем. Но в целях экономии большинство автовладельцев промывают систему водой.В общем, из статьи становится понятно, что на стояние системы охлаждения, а значит — и двигателя, не последнее влияние оказывают характеристики охлаждающей жидкости. Необходимо соблюдать регламент ее замены, а также постоянно мониторить ее состояние, и в случае необходимости — менять раньше регламента.
Видео, которое ответит на вопрос — можно ли смешивать антифрез разных марок:
Автор
Super UserКомментируют
Топ блоги
Вследствие реконструкции стоимость автомобиля Audi A3 увеличилась
Для чего авто нужен спойлер?
Состоялась премьера нового седана Elantra от Hyundai
Нововведения в ПДД на 2016 год.
Volkswagen Golf GTI Mark I
технические характеристики, преимущества и недостатки, совместимость с тосолом G1
Силовая установка автомобиля может безотказно работать только в ситуации, когда используется качественная охлаждающая жидкость. Некоторые автолюбители уверены, что к антифризу предъявляются невысокие требования. Это мнение ошибочно, и к выбору охлаждающей жидкости необходимо подходить ответственно. Одним из самых популярных на рынке является антифриз G11.
Основные виды жидкости
Содержание
- Основные виды жидкости
- Тосол класса G11
- Антифризы типов G 12 и G 13
- Различия между G 12 и G 11
Охлаждающие жидкости для автомобилей называются антифризом. Английское слово antifreeze на русский переводится, как «незамерзающий». В состав всех охлаждающих жидкостей входят следующие вещества:
- Этиленгликоль — около 90%.
- Различные присадки — от 5 до 7%.
- Вода — 3−5%.
Этиленгликоль представляет собой двухатомный спирт. В чистом виде это маслянистая жидкость, имеющая сладковатый вкус. Температура кипения вещества составляет 200 градусов, а замерзает оно при температуре в -12,3 градуса. Следует помнить, что этиленгликоль ядовит, и летальной для человека может стать доза в 200−300 г.
Так как в составе всех антифризов содержится в сумме 95% воды и двухатомного спирта, то отличаются они только присадками. Именно от этих веществ зависит качество работы силовой установки. Хотя выбору этих жидкостей и необходимо уделять повышенное внимание, сегодня не существует единого стандарта, и производители ориентируются на национальные.
Такой сложной ситуации в классификации не существует ни у каких других жидкостей, используемых автолюбителями. Следует отдать должное немецкому концерну Фольксваген, решившему классифицировать все антифризы. В результате на рынке представлены три группы веществ: G 11, G 12, и G 13.
Тосол класса G11
Производится антифриз G 11 по традиционной технологии — силикатной. В качестве присадок в жидкостях этого типа используются в различных сочетаниях такие неорганические вещества, как нитриты, бораты, нитраты, фосфаты и силикаты. Они покрывают защитным слоем поверхность системы охлаждения. Это позволяет защитить элементы конструкции от разрушения, но одновременно существенно уменьшается теплоотдача.
Кроме этого вещества, джи 11 имеют еще один недостаток — от вибраций защитный слой постепенно разрушается и осыпается. А также стоит заметить, что упавшие частицы защитного слоя подхватываются жидкостью и начинают выполнять роль абразивного материала, разрушая встречающиеся на пути детали. Именно из-за этого автолюбителям и приходится производить замену антифриза ежегодно.
Антифризы типов G 12 и G 13
Производители осознали, что жидкость G 11 обладает рядом недостатков, и направили свои усилия на их устранение. Это стало возможным после освоения технологии органических кислот, в частности карбоновых. При их использовании защитный слой образуется лишь в местах появления коррозии, а не на всей поверхности охлаждающей системы.
При их использовании защитный слой образуется лишь в местах появления коррозии, а не на всей поверхности охлаждающей системы.
Тосол G 12 имеет следующие преимущества:
- Высокий показатель теплоотдачи.
- Защитный слой не осыпается под воздействием вибраций.
- Срок эксплуатации составляет от 3 до 5 лет.
Однако без недостатков не обошлось — эти жидкости не являются средством профилактики коррозии и начинают работать лишь после ее появления. Чтобы избавиться от этого «минуса», производители решили объединить две технологии, и в результате на рынке появились продукты с индексом G 12+, еще через несколько лет и G 12++.
В 2012 году был создан еще одни класс тосола — G 13. Основным различием между этими жидкостями и предыдущими является безопасная и экологически чистая основа — пропиленгликоль. В остальном технологически они идентичны веществам класса G 12++.
Различия между G 12 и G 11
Так как эти вещества могут отличаться цветом, то вопрос о том, какой лучше использовать, весьма актуален. Следует помнить, что во время производства эти жидкости вовсе не имеют цвета. Красители добавляются лишь для того, чтобы потребитель смог отличить антифриз от других жидкостей. Вот в чем разница антифриза G11 и G12.
Следует помнить, что во время производства эти жидкости вовсе не имеют цвета. Красители добавляются лишь для того, чтобы потребитель смог отличить антифриз от других жидкостей. Вот в чем разница антифриза G11 и G12.
В настоящее время не существует единого стандарта, регламентирующего цветовую палитру антифризов. Технические характеристики антифриза G11 зеленого аналогичны параметрам других веществ этого класса. При выборе охлаждающей жидкости обращать внимание на цвет не стоит. Однако некоторые автолюбители подбирают вещество по этому параметру в зависимости от материала радиатора:
- Латунь либо медь — антифриз G11 красный.
- Алюминий и сплавы этого металла — антифриз зелёный G11 или синего цвета.
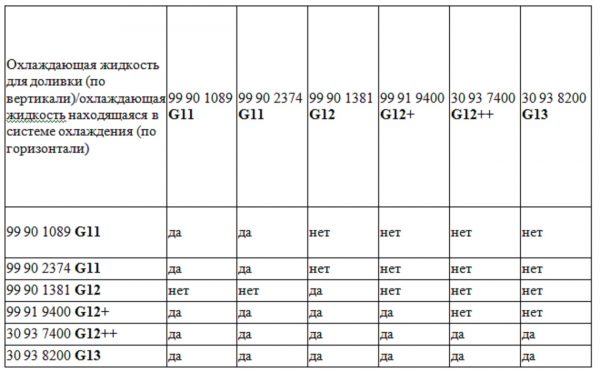
А вот вопрос о совместимости жидкостей разных классов весьма актуален. Следует помнить, что смешивать вещества G 11 с G 12 нельзя, так как второе вещество сразу потеряет все свои преимущества. Допускается совместное использование тосола G 12 и G 12+.
Чтобы избежать проблем при покупке поддержанного автомобиля, перед сменой антифриза стоит слить старый и полностью прочистить систему.
Антифриз/охлаждающая жидкость — техосмотр автомобиля
- Обзор услуг
- Плановое техническое обслуживание
- Техосмотр
- Интерактивная схема автомобиля
Описание
Наиболее распространенная формула антифриза имеет зеленый цвет и использует этиленгликоль в качестве основы с добавлением антикоррозионных присадок. Этиленгликолевая часть формулы обеспечивает важные антифризные свойства, а присадки обеспечивают антифризы. ржавчина и антикоррозионные свойства. Начиная с 1995, большинство автомобилей GM начали поставляться с завода, заполненными антифризом с увеличенным сроком службы, имеющим торговую марку DEX-COOL ® . Заметно отличаясь по внешнему виду, DEX-COOL ® и его аналоги на вторичном рынке имеют оранжевый/янтарный цвет. Он по-прежнему использует этиленгликоль в качестве основы, но содержит другой пакет присадок, чем стандартный антифриз зеленого цвета. Эта охлаждающая жидкость предназначена для защиты систем охлаждения на срок до 225 000 километров или пять лет. Другие составы антифриза включают безсиликатный для японских автомобилей и безфосфатный для европейских автомобилей.
Он по-прежнему использует этиленгликоль в качестве основы, но содержит другой пакет присадок, чем стандартный антифриз зеленого цвета. Эта охлаждающая жидкость предназначена для защиты систем охлаждения на срок до 225 000 километров или пять лет. Другие составы антифриза включают безсиликатный для японских автомобилей и безфосфатный для европейских автомобилей.
Назначение
При правильном смешивании антифриз и вода обеспечивают отличные антифризные, антикипящие и антикоррозионные свойства.
Советы/предложения по обслуживанию
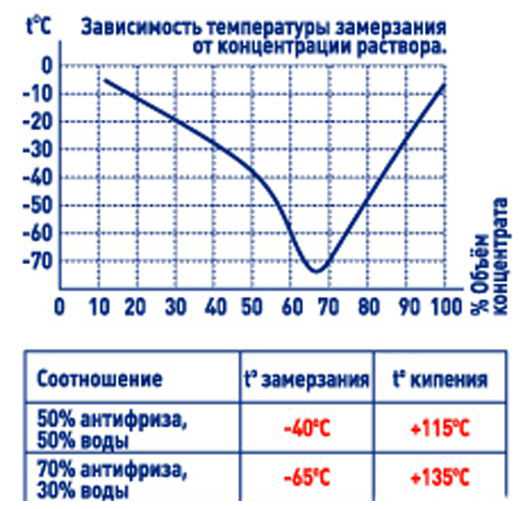
Обратитесь к руководству пользователя, чтобы узнать о спецификациях использования антифриза. Антифриз при смешивании с водой в соотношении 50/50 обеспечивает превосходные антифризные, антикоррозийные и антифризные свойства. В очень холодных условиях соотношение стандартного этиленгликоля может достигать 70 % антифриза и 30 % воды. С DEX-COOL ® максимальное соотношение антифриза к воде 60/40. Хотя антифриз типа DEX-COOL ® можно смешивать со стандартным антифризом на основе этиленгликоля, срок службы DEX-COOL ® снижается до 5 лет/225 000 часов. Таким образом, лучше не смешивать типы антифриза без крайней необходимости.
Таким образом, лучше не смешивать типы антифриза без крайней необходимости.
Все охлаждающие жидкости должны быть разбавлены водой в надлежащем соотношении и не должны использоваться в полную силу. Полноценный антифриз на самом деле имеет температуру замерзания на выше (это означает, что он будет менее эффективен), чем при смешивании с водой. Как правило, стандартный антифриз на основе этиленгликоля следует менять каждые два года или каждые 40 000 километров пробега. Несмотря на то, что защита охлаждающей жидкости от замерзания может быть проверена ареометром (защита от замерзания падает только при чрезмерном разбавлении, а не при старении), присадки со временем разрушаются.
При замене охлаждающей жидкости также удобно заменить неисправные шланги системы охлаждения. Протекающие, ломкие, губчатые, потрескавшиеся или прогнившие шланги следует заменить перед заливкой нового антифриза. Соединения шланговых хомутов также должны быть проверены, чтобы убедиться, что они надежны и не имеют утечек.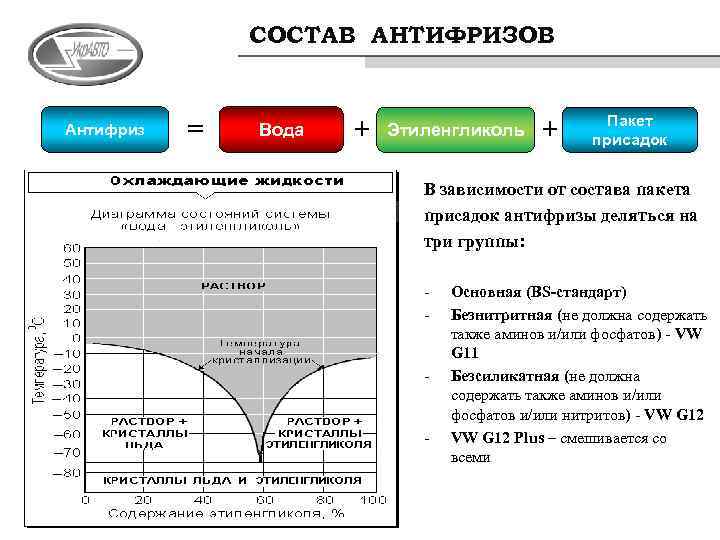 Если вы решили обслуживать систему охлаждения самостоятельно, соблюдайте крайнюю осторожность: открытие горячего радиатора или бачка/переливного бачка охлаждающей жидкости может привести к серьезным ожогам. Прежде чем приступать к техническому обслуживанию или ремонту системы обогрева/охлаждения, убедитесь, что и двигатель, и система охлаждения остыли. Из-за более низкого профиля капота и тесных отсеков двигателя также возможно, что ваш автомобиль может быть оснащен воздухоотводчиком для системы охлаждения. Если из системы охлаждения не удалить воздух должным образом, воздух может остаться в системе и стать причиной нестабильной температуры или, в крайних случаях, повреждения двигателя или системы охлаждения. Если вы не уверены в каком-либо аспекте обслуживания системы охлаждения, не рискуйте. Осмотрите свой автомобиль у профессионального сервисного техника.
Если вы решили обслуживать систему охлаждения самостоятельно, соблюдайте крайнюю осторожность: открытие горячего радиатора или бачка/переливного бачка охлаждающей жидкости может привести к серьезным ожогам. Прежде чем приступать к техническому обслуживанию или ремонту системы обогрева/охлаждения, убедитесь, что и двигатель, и система охлаждения остыли. Из-за более низкого профиля капота и тесных отсеков двигателя также возможно, что ваш автомобиль может быть оснащен воздухоотводчиком для системы охлаждения. Если из системы охлаждения не удалить воздух должным образом, воздух может остаться в системе и стать причиной нестабильной температуры или, в крайних случаях, повреждения двигателя или системы охлаждения. Если вы не уверены в каком-либо аспекте обслуживания системы охлаждения, не рискуйте. Осмотрите свой автомобиль у профессионального сервисного техника.
Белки-антифризы и их практическое применение в промышленности, медицине и сельском хозяйстве
1. Стивенс К.А., Семрау Дж. , Чириак Д., Личко М., Кэмпбелл Р.Л., Лангелан Д.Н., Смит С.П., Дэвис П.Л., Аллингем Дж.С. Циркуляризация пептидного остова повышает термостабильность белка-антифриза, Белковая наука: публикация. Белок Соц. 2017; 26:1932–1941. doi: 10.1002/pro.3228. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
, Чириак Д., Личко М., Кэмпбелл Р.Л., Лангелан Д.Н., Смит С.П., Дэвис П.Л., Аллингем Дж.С. Циркуляризация пептидного остова повышает термостабильность белка-антифриза, Белковая наука: публикация. Белок Соц. 2017; 26:1932–1941. doi: 10.1002/pro.3228. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
2. Davies P.L. Белки, связывающие лед: замечательное разнообразие структур для остановки и запуска роста льда. Тенденции биохим. науч. 2014;39: 548–555. doi: 10.1016/j.tibs.2014.09.005. [PubMed] [CrossRef] [Google Scholar]
3. Bang J.K., Lee J.H., Murugan R.N., Lee S.G. Антифризные пептиды и гликопептиды и их производные: потенциальное использование в биотехнологии. Мар. Наркотики. 2013;11:2013–2041. doi: 10.3390/md11062013. [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
4. Воец И.К. От белков, связывающих лед, до антифризов на биологической основе. Мягкая материя. 2017;13:4808–4823. doi: 10.1039/C6SM02867E. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
5. Flores A., Quon J.C., Perez A.F., Ba Y. Механизмы антифризных белков исследованы с помощью метода сайт-направленной спиновой маркировки. Евро. Биофиз. Дж. 2018; 47:611–630. doi: 10.1007/s00249-018-1285-3. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Flores A., Quon J.C., Perez A.F., Ba Y. Механизмы антифризных белков исследованы с помощью метода сайт-направленной спиновой маркировки. Евро. Биофиз. Дж. 2018; 47:611–630. doi: 10.1007/s00249-018-1285-3. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
6. Kim H.J., Lee J.H., Hur Y.B., Lee C.W., Park S.H. Морские белки-антифризы: структура, функции и применение для криоконсервации в качестве потенциального криопротектора. Мар. Наркотики. 2017;15:27. doi: 10.3390/md15020027. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
7. Balcerzak A.K., Capicciotti C.J., Briard J.G., Ben R.N. Разработка ингибиторов рекристаллизации льда: от белков-антифризов (глико) до малых молекул. Р. Соц. хим. Доп. 2014;4:42682–42696. doi: 10.1039/C4RA06893A. [CrossRef] [Google Scholar]
8. Laezza A., Casillo S., Cosconati C.I., Biggs A., Fabozzi L., Paduano A., Iadonisi E., Novellino M.I., Gibson A., Corsaro M.M., et al. . Декорирование полисахарида хондроитина треонином: синтез, конформационное исследование и активность ингибирования перекристаллизации льдом. Биомакромолекулы. 2017;18:2267–2276. doi: 10.1021/acs.biomac.7b00326. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Биомакромолекулы. 2017;18:2267–2276. doi: 10.1021/acs.biomac.7b00326. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
9. Кристиансен Э., Захариассен К.Э. Механизм, с помощью которого антифризные белки рыб вызывают тепловой гистерезис. Криобиология. 2005; 51: 262–280. doi: 10.1016/j.cryobiol.2005.07.007. [PubMed] [CrossRef] [Google Scholar]
10. Xiang H., Yang X., Ke L., Hu Y. Свойства, биотехнологии и применение белков-антифризов. биол. макромол. 2020; 153: 661–675. doi: 10.1016/j.ijbiomac.2020.03.040. [PubMed] [CrossRef] [Google Scholar]
11. Celik Y., Drori R., Pertaya-Braun N., Altan A., Barton T. Микрожидкостные эксперименты показывают, что антифризных белков, связанных с кристаллами льда, достаточно, чтобы предотвратить их рост. . проц. Натл. акад. науч. СОЕДИНЕННЫЕ ШТАТЫ АМЕРИКИ. 2013;110:1309–1314. doi: 10.1073/pnas.1213603110. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
12. Кавахара Х. Характеристика функций биологических материалов, обладающих способностью контролировать рост кристаллов льда.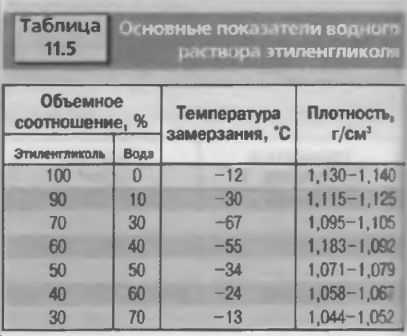 Матер. науч. 2012 г.: 10.5772/54535. [CrossRef] [Google Scholar]
Матер. науч. 2012 г.: 10.5772/54535. [CrossRef] [Google Scholar]
13. Hayward J.A., Haymet A.D.J. Поверхность раздела лед/вода: молекулярно-динамическое моделирование базальной, призменной, {2021} и {2110} границ раздела льда Ih. хим. физ. 2001; 114:3713–3726. дои: 10.1063/1.1333680. [Перекрестная ссылка] [Академия Google]
14. Олийве Л.Л., Мейстер К., Де Врис А.Л., Думан Л.Г., Го С., Баккер Х.Дж., Воетс Л.И. Блокирование быстрого роста кристаллов льда за счет небазальной адсорбции белков-антифризов. проц. Натл. акад. науч. СОЕДИНЕННЫЕ ШТАТЫ АМЕРИКИ. 2016;113:3740–3745. doi: 10.1073/pnas.1524109113. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
15. Kuiper M.J., Lankin C., Gauthier S.Y., Walker V.K., Davies P.L. Очистка антифризных белков адсорбцией на льду. Биохим. Биофиз. Рез. коммун. 2003; 300: 645–648. дои: 10.1016/S0006-291Х(02)02900-5. [PubMed] [CrossRef] [Google Scholar]
16. Ding X., Zhang H., Chen H.L., Wang H., Qian X. Экстракция, очистка и идентификация белков-антифризов из пивоваренного ячменя, акклиматизированного к холоду ( Hordeum vulgare Л.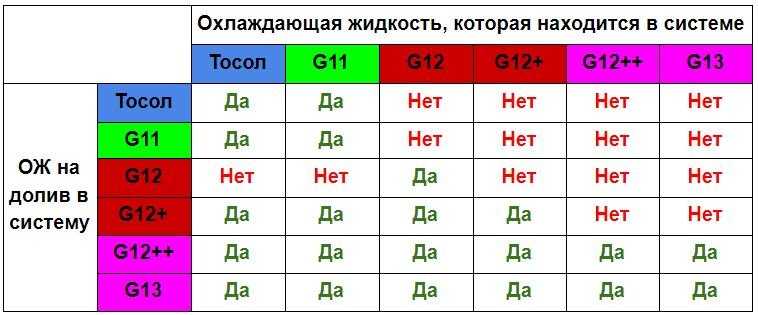 ) Пищевая хим. 2015; 175:74–81. doi: 10.1016/j.foodchem.2014.11.027. [PubMed] [CrossRef] [Google Scholar]
) Пищевая хим. 2015; 175:74–81. doi: 10.1016/j.foodchem.2014.11.027. [PubMed] [CrossRef] [Google Scholar]
17. Mao M.G., Chen Y., Liu R.T., Lu HQ, Gu J. Транскриптом из печени тихоокеанской трески раскрывает типы аполипопротеинов и анализ экспрессии AFP-IV, структурного аналога с ApoA-I млекопитающих, Сравнительная биохимия и физиология. Часть D Геном. протеом. 2018;28:204–212. doi: 10.1016/j.cbd.2018.10.001. [PubMed] [CrossRef] [Академия Google]
18. Sharma B., Sahoo D., Deswal R. Одностадийная очистка и характеристика белков-антифризов из листьев и ягод морозостойкого кустарника облепихи ( Hippophae rhamnoides ) Sep. Sci. 2018;41:3938–3945. doi: 10.1002/jssc.201800553. [PubMed] [CrossRef] [Google Scholar]
19. Cheng J., Hanada Y., Miura A., Tsuda S., Kondo H. Гидрофобные участки связывания со льдом придают гиперактивность антифризного белка гриба снежной плесени. Биохим. J. 2016 doi: 10.1042/BCJ20160543. [PubMed] [CrossRef] [Академия Google]
20. Basu K., Garnham C.P., Nishimiya Y., Tsuda S., Braslavsky I. Определение лед-связывающих плоскостей белков-антифризов с помощью флуоресцентной аффинности ледяных плоскостей. Вис. Эксп. 2014;83:e51185. дои: 10.3791/51185. [Статья бесплатно PMC] [PubMed] [CrossRef] [Google Scholar]
Basu K., Garnham C.P., Nishimiya Y., Tsuda S., Braslavsky I. Определение лед-связывающих плоскостей белков-антифризов с помощью флуоресцентной аффинности ледяных плоскостей. Вис. Эксп. 2014;83:e51185. дои: 10.3791/51185. [Статья бесплатно PMC] [PubMed] [CrossRef] [Google Scholar]
21. Knight C.A., Cheng C.C., DeVries AL. Адсорбция альфа-спиральных антифризных пептидов на конкретных плоскостях поверхности кристаллов льда. Биофиз, Дж. 1991; 59: 409–418. doi: 10.1016/S0006-3495(91)82234-2. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
22. Халева Л., Челик Ю., Бар-Долев М., Пертая-Браун Н., Канер А., Дэвис П.Л. Микрожидкостное устройство холодного пальца для исследования белков, связывающих лед. Biophys J. 2016; 111:1143–1150. doi: 10.1016/j.bpj.2016.08.003. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
23. Cheng Y., Yang Z., Tan H., Liu R., Chen G., Jia Z. Анализ участков связывания льда у рыб антифризный белок типа II с помощью квантовой механики. Биофиз Дж. 2002; 83: 2202–2210. дои: 10.1016/S0006-3495(02)73980-5. [Статья PMC бесплатно] [PubMed] [CrossRef] [Google Scholar]
Биофиз Дж. 2002; 83: 2202–2210. дои: 10.1016/S0006-3495(02)73980-5. [Статья PMC бесплатно] [PubMed] [CrossRef] [Google Scholar]
24. Loewen M.C., Gronwald W., Sönnichsen F.D., Sykes B.D., Davies P.L. Сайт связывания льда антифризного белка морского ворона отличается от сайта связывания углеводов гомологичного лектина С-типа. Биохим. Дж. 1998; 37:17745–17753. doi: 10.1021/bi9820513. [PubMed] [CrossRef] [Google Scholar]
25. Knight C.A., Hallett J., DeVries A.L. Влияние растворенных веществ на рекристаллизацию льда: метод оценки. Криобиология. 1988;21:55–60. doi: 10.1016/0011-2240(88)
-X. [PubMed] [CrossRef] [Google Scholar]
26. Tomczak M.M., Marshall C.B., Gilbert J.A., Davies P.L. Простой метод определения ингибирования рекристаллизации льда антифризными белками. BBRC J. 2003; 311: 1041–1046. doi: 10.1016/j.bbrc.2003.10.106. [PubMed] [CrossRef] [Google Scholar]
27. Stubbs C., Wilkins L.E., Fayter A.E.R., Walker M., Gibson M.I. Мультивалентная презентация полимеров, ингибирующих рекристаллизацию льда, на наночастицах сохраняет активность. Являюсь. хим. соц. 2018; 35:7347–7353. doi: 10.1021/acs.langmuir.8b01952. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Являюсь. хим. соц. 2018; 35:7347–7353. doi: 10.1021/acs.langmuir.8b01952. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
28. Yu S.-H., Yang P., Sun T., Qi Q., Wang X.-Q., Chen X.M., Фэн Ю. Транскриптомный и протеомный анализ способности к переохлаждению и добыче антифризных белков китайской белой восковой щитовки. наук о насекомых. 2016; 23:430–437. doi: 10.1111/1744-7917.12320. [PubMed] [CrossRef] [Google Scholar]
29. Карраско М.А., Бюхлер С.А., Арнольд Р.Дж., Сформо Т., Барнс Б.М. Изучение способности аляскинского жука к глубокому переохлаждению Cucujus clavipes puniceus с помощью высокопроизводительной протеомики. протеом. Дж. 2012; 75:1220–1234. doi: 10.1016/j.jprot.2011.10.034. [PubMed] [CrossRef] [Google Scholar]
30. Кумар М., Салдана Х., Кумар Р., Бхаттачария Х., Соуза Н. In-Silco Анализ антифризных белков рыб и их физико-химическая характеристика. Чистое приложение. Бионауч. 2018; 1:1392–1398. doi: 10.18782/2320-7051.6354. [CrossRef] [Google Scholar]
31. Wellig S., Hamm P. Спасительный слой антифризных белков анализируется с помощью марковской модели состояния. физ. хим. Дж. 2018; 49: 11014–11022. doi: 10.1021/acs.jpcb.8b04491. [PubMed] [CrossRef] [Google Scholar]
Wellig S., Hamm P. Спасительный слой антифризных белков анализируется с помощью марковской модели состояния. физ. хим. Дж. 2018; 49: 11014–11022. doi: 10.1021/acs.jpcb.8b04491. [PubMed] [CrossRef] [Google Scholar]
32. Doxey A.C., Yaish M.W., Griffith M., McConkey B.J. Упорядоченные поверхностные углероды различают белки-антифризы и их участки, связывающие лед. Нац. Биотехнолог. 2006; 24:852–855. doi: 10.1038/nbt1224. [PubMed] [CrossRef] [Google Scholar]
33. Кандасвами К.К., Чоу К.С., Мартинец Т., Моллер С., Сугантан П.Н. AFP-Pred: метод случайного леса для прогнозирования белков-антифризов по свойствам, полученным из последовательности. Теор. биол. 2011; 270:56–62. doi: 10.1016/j.jtbi.2010.10.037. [PubMed] [CrossRef] [Академия Google]
34. Xiao X., Hui M., Liu Z. iAFP-Ense: ансамблевый классификатор для идентификации антифризного белка путем включения модели Грея и PSSM в PseAAC. член биол. 2016; 249:845–854. doi: 10.1007/s00232-016-9935-9. [PubMed] [CrossRef] [Google Scholar]
35. He X., Han K., Hu J., Yan H., Yang J.Y., Shen H.B., Yu D.J. Целевая заморозка: идентификация белков-антифризов с помощью комбинации весов с использованием информации об эволюции последовательности и псевдоаминокислотного состава. член биол. 2015; 248:1005–1014. doi: 10.1007/s00232-015-9811-з. [PubMed] [CrossRef] [Google Scholar]
He X., Han K., Hu J., Yan H., Yang J.Y., Shen H.B., Yu D.J. Целевая заморозка: идентификация белков-антифризов с помощью комбинации весов с использованием информации об эволюции последовательности и псевдоаминокислотного состава. член биол. 2015; 248:1005–1014. doi: 10.1007/s00232-015-9811-з. [PubMed] [CrossRef] [Google Scholar]
36. Nadu T. Оценка методов прогнозирования вторичной структуры белка in-silico с использованием статистических методов. Биомед. Биотехнолог. Рез. Ж. 2017; 5:29–36. doi: 10.4103/bbrj.bbrj_28_17. [CrossRef] [Google Scholar]
37. Бхаттачари М., Хота А., Кар А., Чини Д.С., Малик Р.К. In-silico Структурное и функциональное моделирование последовательностей антифризного белка (АФП) морской дужки ( Zoarces americanus , Bloch & Schneider 1801) Жене. англ. Биотехнолог. 2018;16:721–730. doi: 10.1016/j.jgeb.2018.08.004. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
38. Мушараф М.Д. Антифризные белки рыб: вычислительный анализ и физико-химическая характеристика. Междунар. Курс. фарм. 2012; 1:18–26. doi: 10.3329/icpj.v1i2.9412. [CrossRef] [Google Scholar]
Междунар. Курс. фарм. 2012; 1:18–26. doi: 10.3329/icpj.v1i2.9412. [CrossRef] [Google Scholar]
39. Идрис С., Надим С., Канвал С., Эхсан Б., Юсуф А., Надим С., Райока М.И. Анализ последовательности in silico, моделирование гомологии и функциональная аннотация Ocimum basilicum гипотетический белок G1CT28_OCIBA. Биоавтоматизация. 2012;16:111–118. [Google Scholar]
40. Долев Б., Браславский М., Дэвис П.Л. Белки, связывающие лед, и их функции. Анну. Преподобный Биохим. 2016; 85: 515–542. doi: 10.1146/annurev-biochem-060815-014546. [PubMed] [CrossRef] [Google Scholar]
41. Jia Z., Davies P.L. Белки-антифризы: необычное взаимодействие рецептор-лиганд. Тенденции биохим. науч. 2002; 27:101–106. doi: 10.1016/S0968-0004(01)02028-X. [PubMed] [CrossRef] [Академия Google]
42. Чакраборти С., Биман Дж. Необычная история о структурной эволюции, гидратации и функциях. проц. Индийская национальная наука. акад. 2018;1:169–187. doi: 10.16943/ptinsa/2018/49553. [CrossRef] [Google Scholar]
43. Mahatabuddin S., Hanada Y., Nishimiya Y., Miura A. Зависимая от концентрации олигомеризация альфа-спирального антифризного полипептида делает его гиперактивным. науч. 2017;7:42501. doi: 10.1038/srep42501. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Mahatabuddin S., Hanada Y., Nishimiya Y., Miura A. Зависимая от концентрации олигомеризация альфа-спирального антифризного полипептида делает его гиперактивным. науч. 2017;7:42501. doi: 10.1038/srep42501. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
44. Нишимия Ю., Кондо Х., Такамичи М., Сугимото Х., Судзуки М., Миура А., Цуда С. Кристаллическая структура и мутационная анализ Са 2+ — независимый антифризный белок II типа длиннорылого браконьера, Brachyopsis rostratus . Мол. биол. 2008; 382: 734–746. doi: 10.1016/j.jmb.2008.07.042. [PubMed] [CrossRef] [Google Scholar]
45. Рудсари Х., Гофф Х.Д. Ледяные структурирующие белки растений: механизм действия и применение в пищевых продуктах. Еда Рез. 2012; 46: 425–436. doi: 10.1016/j.foodres.2011.12.018. [CrossRef] [Google Scholar]
46. Huang Q., Hu R., Zhu H., Peng C., Chen L. Холодостойкая активность мультидоменного антифризного белка типа III из антарктической бельдюги Lycodrchths deaborni , обнаруженный у трансгенных табаков. Аква. Рыбы. 2019: 1–6. doi: 10.1016/j.aaf.2019.11.006. [CrossRef] [Google Scholar]
Аква. Рыбы. 2019: 1–6. doi: 10.1016/j.aaf.2019.11.006. [CrossRef] [Google Scholar]
47. Sönnichsen F.D., DeLuca C.I., Davies P.L., Sykes B.D., Sönnichsen F.D., DeLuca C.I., Davies P.L., Sykes B.D. Усовершенствованная структура раствора антифриза III типа: гидрофобные группы могут быть вовлечены в энергетику взаимодействия белок-лед. Состав. 1996; 4: 1325–1337. doi: 10.1016/S0969-2126(96)00140-2. [PubMed] [CrossRef] [Академия Google]
48. Урбанчик М., Гора Дж., Латайка Р., Норберт С. Антифризные гликопептиды: от структуры и структуры активности до современных подходов в химическом синтезе. Аминокислоты. 2017;49:209–222. doi: 10.1007/s00726-016-2368-z. [Статья бесплатно PMC] [PubMed] [CrossRef] [Google Scholar]
49. Думан Дж. С. Белки и гликопептиды, связывающие лед животных (белки-антифризы). Эксп. биол. 2015; 218:1846–1855. doi: 10.1242/jeb.116905. [PubMed] [CrossRef] [Google Scholar]
50. Ye Q., Eves R., Campbell R.L., Davies P.L. В кристаллической структуре белков-антифризов насекомых обнаруживаются упорядоченные воды на связывающей лед поверхности. Биохим. 2020;17:3271–3286. DOI: 10.1042/BCJ20200539. [PubMed] [CrossRef] [Google Scholar]
Биохим. 2020;17:3271–3286. DOI: 10.1042/BCJ20200539. [PubMed] [CrossRef] [Google Scholar]
51. Брайон А., Вибоу Н., Дермау В. Анализ экспрессии генов в геноме факультативных репродуктивных диапауз у двупятнистого паутинного клеща. БМС Геном. 2013;14:815. дои: 10.1186/1471-2164-14-815. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
52. Гуз Н., Топрак У., Дагери А. Идентификация предполагаемого гена антифризного белка, который сильно экспрессируется во время подготовки к зиме у солнечных вредителей. Физиол насекомых. 2014;68:30–35. doi: 10.1016/j.jinsphys.2014.06.021. [PubMed] [CrossRef] [Академия Google]
53. Хон В., Гриффит М., Чонг П., Ян Д.С.К. Экстракция и выделение белков-антифризов из листьев озимой ржи ( Secale злаковый L.). Завод Физиол. Бетесда. 1994; 104: 971–980. doi: 10.1104/стр.104.3.971. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
54. Provesi J.G., Volentim P.A., Arisi A.C.M. Белки-антифризы в естественно акклиматизированных к холоду листьях Drimys angustifolia , Senecio icoglossus и Eucalyptus вид. Пищевая Технол. 2016;19:e2016110. дои: 10.1590/1981-6723.11016. [CrossRef] [Google Scholar]
Пищевая Технол. 2016;19:e2016110. дои: 10.1590/1981-6723.11016. [CrossRef] [Google Scholar]
55. Муньос П.А., Маркес С.Л., Гонсалес Ф.Д. Структура и применение белков-антифризов антарктических бактерий. микроб. Клеточные фабрики. 2017;16:138–150. doi: 10.1186/s12934-017-0737-2. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
56. Устун Н.С., Турхан С. Белки-антифризы: характеристики, механизмы действия, источники и применение в пищевых продуктах. Пищевой процесс. Сохранить 2015;39: 3189–3197. doi: 10.1111/jfpp.12476. [CrossRef] [Google Scholar]
57. Boonsupthip W., Lee T.C. Применение белка-антифриза для консервирования пищевых продуктов: Эффект белка-антифриза III типа для сохранения гелеобразующего замороженного и охлажденного актомиозина. Пищевая наука. 2003; 68: 1804–1809. doi: 10.1111/j.1365-2621.2003.tb12333.x. [CrossRef] [Google Scholar]
58. Пейн С.Р., Янг О.А. Влияние предубойного введения белков-антифризов на качество замороженного мяса. Мясная наука. 1995;41:147–155. doi: 10.1016/0309-1740(94)00073-G. [PubMed] [CrossRef] [Google Scholar]
Мясная наука. 1995;41:147–155. doi: 10.1016/0309-1740(94)00073-G. [PubMed] [CrossRef] [Google Scholar]
59. Ding X., Zhang H., Liu W., Wang L., Qian H. Извлечение антифризных белков моркови ( Daucus carota ) и оценка их воздействия на замороженная белая соленая лапша. Технология пищевых биопроцессов. 2014;7:842–852. doi: 10.1007/s11947-013-1101-0. [CrossRef] [Google Scholar]
60. Zhang C., Zhang H., Wang L., Gao H., Guo X.N. Влияние белков-антифризов моркови на консистенцию и свойства замороженного теста и летучих соединений мякиша. Пищевая наука. Технол. 2007;41:1029–1036. doi: 10.1016/j.lwt.2007.07.010. [CrossRef] [Google Scholar]
61. Чжан С., Чжан Х., Ван Л. Влияние антифризных белков моркови ( Daucus carota ) на ферментативную способность замороженного теста. Еда Рез. Междунар. 2007; 40: 763–769. doi: 10.1016/j.foodres.2007.01.006. [CrossRef] [Google Scholar]
62. Панадеро Дж., Рандес Ф., Прието Дж.А. Гетерологическая экспрессия антифризного пептида I типа GS-5 в пекарских дрожжах повышает устойчивость к замораживанию и обеспечивает повышенное газообразование в замороженном тесте. Агр. Пищевая хим. 2005;53:9966–9970. doi: 10.1021/jf0515577. [PubMed] [CrossRef] [Google Scholar]
Агр. Пищевая хим. 2005;53:9966–9970. doi: 10.1021/jf0515577. [PubMed] [CrossRef] [Google Scholar]
63. Xu H.-N., Huang W., Jia C., Kim Y., Liu H. Оценка водоудерживающей способности и хлебопекарных свойств замороженного теста, содержащего лед. структурирование белков озимой пшеницы. Зерновые науки. 2009; 49: 250–253. doi: 10.1016/j.jcs.2008.10.009. [CrossRef] [Google Scholar]
64. Liu M., Liang Y., Zhang H., Wu G., Wang L., Qian H. Получение рекомбинантного антифризного белка моркови с помощью Pichia pastoris GS115 и его криозащитное действие на свойства замороженного теста и качество хлеба. Пищевая наука. Технол. 2018;96:543–550. doi: 10.1016/j.lwt.2018.05.074. [CrossRef] [Google Scholar]
65. Шейх М., Цуда С. Применение белков-антифризов: Практическое использование качественных продуктов из японских рыб. Доп. Эксп. Мед. биол. 2018;13:321–337. doi: 10.1007/978-981-13-1244-1_17. [PubMed] [CrossRef] [Google Scholar]
66. Фукусима М., Цуда С., Йошизава Ю. Изготовление высокопористого оксида алюминия, полученного методом замораживания желатина с антифризным белком. Являюсь. Керам. соц. 2013;96:1029–1031. doi: 10.1111/jace.12229. [CrossRef] [Google Scholar]
Изготовление высокопористого оксида алюминия, полученного методом замораживания желатина с антифризным белком. Являюсь. Керам. соц. 2013;96:1029–1031. doi: 10.1111/jace.12229. [CrossRef] [Google Scholar]
67. Gwak Y., Park J.I., Kim M., Kim H.S., Kwon M.J., Oh S.J., Kim Y.P., Jin E.S. Создание антиобледенительных поверхностей путем прямой иммобилизации антифризных белков на алюминии. Нац. науч. Отчет 2015; 5: 1038–1046. doi: 10.1038/srep12019. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
68. Chen Z., Huang C.Y., Zhao M., Yan W., Chien C.W., Chen M., Yang H., Machiyama H., Lin S. Характеристики и возможное происхождение самородного алюминия в отложениях холодного просачивания с северо-востока Южно-Китайского моря. заявл. науч. вычисл. 2011;40:363–370. doi: 10.1016/j.jseaes.2010.06.006. [Перекрестная ссылка] [Академия Google]
69. Gwak I.G., sic Jung W., Kim HJ, Kang S.H., Jin E. Белок-антифриз в антарктических морских диатомовых водорослях, Chaetoceros neogracile. Мар. Биотехнолог. 2010;12:630–639. doi: 10.1007/s10126-009-9250-x. [PubMed] [CrossRef] [Google Scholar]
Мар. Биотехнолог. 2010;12:630–639. doi: 10.1007/s10126-009-9250-x. [PubMed] [CrossRef] [Google Scholar]
70. Gwak Y., Jung W., Lee Y., Kim J.S., Kim C.G., Ju J.H., Song C., Hyun J.K., Jin E. Внутриклеточный белок-антифриз из Антарктическая микроводоросль, реагирующая на различные стрессы окружающей среды. FASEB J. 2014; 28:4924–4935. doi: 10.1096/fj.14-256388. [PubMed] [CrossRef] [Академия Google]
71. Kreilgaard L., Frokjaer S., Flink J.M., Randolph T.W., Carpenter J.F. Влияние добавок на стабильность рекомбинантного человеческого фактора XIII во время сублимационной сушки и хранения в сухом твердом веществе. Арка Биохим. Биофиз. 1998; 360:121–134. doi: 10.1006/abbi.1998.0948. [PubMed] [CrossRef] [Google Scholar]
72. Кошик Дж. К., Бхат Р. Почему трегалоза является исключительным стабилизатором белка? Анализ термостабильности белков в присутствии совместимого осмолита трегалозы. биол. хим. 2003; 278:26458–26465. doi: 10.1074/jbc.M300815200. [PubMed] [CrossRef] [Академия Google]
73. Учида Т., Нагаяма М., Гохара К. Вязкость раствора трегалозы при низких температурах, измеренная методом динамического светорассеяния: трегалоза подавляет перенос молекул для роста кристаллов льда. Дж. Крист. Рост. 2009; 311:4747–4752. doi: 10.1016/j.jcrysgro.2009.09.023. [CrossRef] [Google Scholar]
Учида Т., Нагаяма М., Гохара К. Вязкость раствора трегалозы при низких температурах, измеренная методом динамического светорассеяния: трегалоза подавляет перенос молекул для роста кристаллов льда. Дж. Крист. Рост. 2009; 311:4747–4752. doi: 10.1016/j.jcrysgro.2009.09.023. [CrossRef] [Google Scholar]
74. Фикриг Э., Эйзинг М., Абрахам Н., Нилаканта Г. Противоинфекционные свойства белка-антифриза. 10792332B2. Патент США. 2020 6 октября;
75. Heisig M., Agaisse H., Fikrig E. Антивирулентные свойства белка-антифриза. Клеточный пресс. 2014;9: 417–424. doi: 10.1016/j.celrep.2014.09.034. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
76. Ярели М., Рамос Л. Биология выживания клеток на холоде: Основы биосохранения тканей и органов. Доп. Биоконсерв. 2010;96:15–62. [Google Scholar]
77. Абрахам Н.М., Лю Л., Ютрас Б.Л., Мерфин К., Акар А., Яровинский Т.О., Саттон Э., Хейзиг М., Якобс-Вагнер К. Антивирулентный белок клеща усиливает действие антибиотиков против Золотистый стафилококк . Антимикроб. Агенты Чемотер. 2017; 61 doi: 10.1128/AAC.00113-17. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Антимикроб. Агенты Чемотер. 2017; 61 doi: 10.1128/AAC.00113-17. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
78. Ли Дж., Ким С.К., Юм Х.В., Ким Х.Дж., Ли Дж.Р. Влияние трех различных типов белков-антифризов на криоконсервацию и трансплантацию ткани яичников мышей. ПЛОС ОДИН. 2015;10:1371–1385. doi: 10.1371/journal.pone.0126252. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
79. Kuwayama M., Vajta G., Kato O., Labo S. Высокоэффективный метод витрификации для криоконсервации ооцитов человека. Воспр. биомед. Онлайн. 2005; 11: 300–308. doi: 10.1016/S1472-6483(10)60837-1. [PubMed] [CrossRef] [Академия Google]
80. Кратохвилова И., Копечная О., Бачикова А., Пагачова Е., Фалькова И., Эллиотт С.Е. Изменения ядер криоконсервированных клеток служат индикаторами процессов при замораживании и оттаивании. Ленгмюр. 2019; 35:7496–7508. doi: 10.1021/acs.langmuir.8b02742. [PubMed] [CrossRef] [Google Scholar]
81. Yang J., Pan C., Zhang J., Sui X.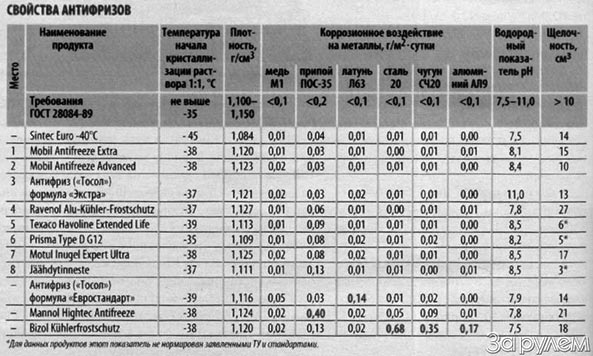 , Zhu Y., Wen C., Zhang L. Изучение потенциала биосовместимых осмопротекторов как высокоэффективных криопротекторы. Являюсь. хим. науч. заявл. Матер. 2017;9: 42516–42524. doi: 10.1021/acsami.7b12189. [PubMed] [CrossRef] [Google Scholar]
, Zhu Y., Wen C., Zhang L. Изучение потенциала биосовместимых осмопротекторов как высокоэффективных криопротекторы. Являюсь. хим. науч. заявл. Матер. 2017;9: 42516–42524. doi: 10.1021/acsami.7b12189. [PubMed] [CrossRef] [Google Scholar]
82. Карпентер Ф.Дж., Хансен Т.Н. Белок-антифриз модулирует выживаемость клеток во время криоконсервации: опосредование через влияние на рост кристаллов льда. Физиология. 1992; 89: 8953–8957. doi: 10.1073/pnas.89.19.8953. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
83. Harding M.M., Anderberg P.I., Haymet A.D.J. Гликопротеин «антифриз» полярных рыб. Биохим. 2003; 270:1381–1392. [PubMed] [Академия Google]
84. Ван Дж.Х. Всесторонняя оценка эффектов и механизмов антифризных белков при низкотемпературном хранении. Криобиология. 2000;41:1–9. doi: 10.1006/cryo.2000.2265. [PubMed] [CrossRef] [Google Scholar]
85. Lee J.R., Youm H.W., Lee H.J., Suh C.H.S. Влияние антифризного белка на криоконсервацию и трансплантацию ткани яичника.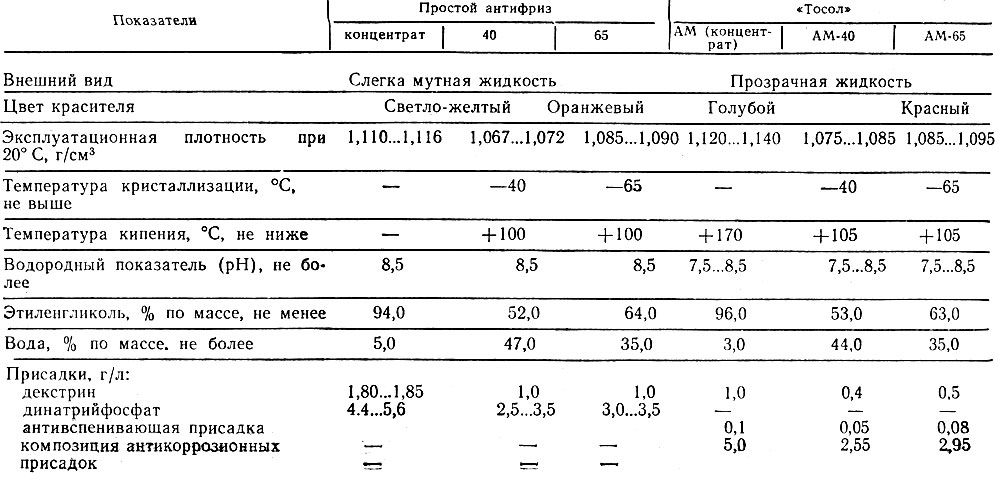 Йонсей Мед. Дж. 2015; 56: 778–784. doi: 10.3349/ymj.2015.56.3.778. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Йонсей Мед. Дж. 2015; 56: 778–784. doi: 10.3349/ymj.2015.56.3.778. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
86. Лян С., Юань Б., Квон Дж. В., Ан М., Цуй Х. С., Банг Дж. К., Ким Н. Х. Влияние добавок антифризного гликопротеина 8 во время витрификации на способность к развитию бычьих ооцитов. Териогенология. 2016;86:485–494.e1. doi: 10.1016/j.theriogenology.2016.01.032. [PubMed] [CrossRef] [Google Scholar]
87. Багис Х., Актопраклигил Д., Меркан Х.О., Юрдусев Н., Тургут Г., Секмен С., Арат С., Цетин С. Стабильная передача и транскрипция ньюфаундленда Ген антифризного белка (АФП) рыбы океанской дудки типа III у трансгенных мышей и гипотермическое хранение трансгенных яичников и семенников. Мол. Воспр. Дев. 2006;73:1404–1411. doi: 10.1002/mrd.20601. [PubMed] [CrossRef] [Академия Google]
88. Джо Дж.В., Джи Б.К., Су К.С., Ким С.Х. Благотворное влияние белков-антифризов на витрификацию незрелых ооцитов мышей. ПЛОС ОДИН. 2012;7:e37043. doi: 10.1371/journal. pone.0037043. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
pone.0037043. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
89. Джо Дж. В., Джи Б. К., Ли Дж. Р., Су С. Влияние среды для инвитрификации с добавлением антифризного белка на способность мышиных ооцитов к развитию. Плодородный. Стерильно. 2011;96:1239–1245. doi: 10.1016/j.fertnstert.2011.08.023. [PubMed] [CrossRef] [Академия Google]
90. Чавес Д.Ф., Кампело И.С., Силва М., Бхат М.Х., Тейшейра Д.И.А., Мело Л.М., Соуза-Фабджан Дж.М.Г., Мермиллод П., Фрейтас В.Дж.Ф. Использование антифриза типа III для витрификации созревших in vitro ооцитов крупного рогатого скота. Криобиология. 2016;73:324–328. doi: 10.1016/j.cryobiol.2016.10.003. [PubMed] [CrossRef] [Google Scholar]
91. Zandiyeh S., Ebrahimi F., Sabbaghian M. Применение белка-антифриза при криоконсервации спермы. Малиновый паблик. 2018;1:22–34. doi: 10.31031/PRM.2018.01.000520. [Перекрестная ссылка] [Академия Google]
92. Zilli L., Beirão J., Schiavone R., Herraez M.P., Gnoni A. Сравнительный протеомный анализ криоконсервированных жгутиков и белка головной плазматической мембраны сперматозоидов морского леща: влияние антифризного белка.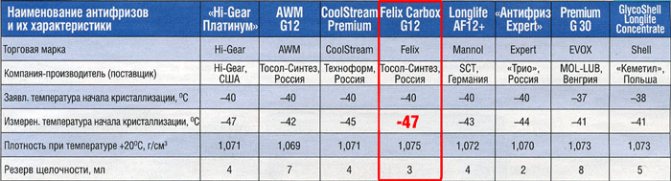 ПЛОС ОДИН. 2016;9:e99992. doi: 10.1371/journal.pone.0099992. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
ПЛОС ОДИН. 2016;9:e99992. doi: 10.1371/journal.pone.0099992. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
93. Qadeer S., Khan M.A., Ansari M.S., Rakha B.A., Ejaz R., Iqbal R., Younis M., Ullah N., DeVries A.L. Эффективность антифризных гликопротеинов для криоконсервации Нили-Рави ( Bubalus bubalis ) сперма быка буйвола. Аним. Воспр. науч. 2015; 157:56–62. doi: 10.1016/j.anireprosci.2015.03.015. [PubMed] [CrossRef] [Google Scholar]
94. Кадир С., Хан М.А., Ансари М.С., Ракха Б.А., Эджаз Р., Хусна А.У., Ашик М., Икбал Р., Улла Н., Ахтер С. Оценка антифризного белка III для криоконсервации спермы буйволиного быка NiliRavi (Bubalus bubalis). Аним. Воспр. науч. 2014; 148:26–31. doi: 10.1016/j.anireprosci.2014.04.013. [PubMed] [CrossRef] [Академия Google]
95. Shaliutina-Kolešová A., Dietrich M., Xian M., Nian R. Влияние трансферрина семенной плазмы на криоконсервированную сперму карпа Cyprinus carpio и сравнение с бычьим сывороточным альбумином и антифризными белками. Аним. Воспр. науч. 2019;204:125–130. doi: 10.1016/j.anireprosci.2019.03.013. [PubMed] [CrossRef] [Google Scholar]
Аним. Воспр. науч. 2019;204:125–130. doi: 10.1016/j.anireprosci.2019.03.013. [PubMed] [CrossRef] [Google Scholar]
96. Martinez-Paramo S., Barbosa V., Perez-Cerezales S., Robles V., Herraez M.P. Криопротекторные эффекты белков-антифризов, доставленных в эмбрионы рыбок данио. Криобиология. 2009 г.;58:128–133. doi: 10.1016/j.cryobiol.2008.11.013. [PubMed] [CrossRef] [Google Scholar]
97. Амир Г., Рубинский Б., Кассиф Ю., Горовиц Л., Смолинский А.К., Лави Дж. Сохранение структуры миоцитов и целостности митохондрий при низкотемпературной криоконсервации сердец млекопитающих для трансплантация с использованием белков-антифризов — исследование с помощью электронной микроскопии. Евро. доц. Кардио-Торак. Surg. 2003; 24: 292–296. doi: 10.1016/S1010-7940(03)00306-3. [PubMed] [CrossRef] [Google Scholar]
98. Амир Г., Горовиц Л., Рубинский Б., Юсиф Б.С., Лави Дж., Смолинский А.К. Незамерзающая криоконсервация сердец крыс при отрицательных температурах с использованием антифризного протеина I и антифризного протеина III. Криобиология. 2004; 48: 273–282. doi: 10.1016/j.cryobiol.2004.02.009. [PubMed] [CrossRef] [Google Scholar]
Криобиология. 2004; 48: 273–282. doi: 10.1016/j.cryobiol.2004.02.009. [PubMed] [CrossRef] [Google Scholar]
99. Амир Г., Рубинский Б., Горовиц Л., Миллер Л., Леор Дж., Кассиф Ю., Мишали Д., Смолинский А.К., Лави Дж. Продолж. 24 -часовая консервация гетеротопически трансплантированных крысиных сердец при температуре ниже нуля с использованием белков-антифризов, полученных из арктических рыб. Анна. Торак. Surg. 2004; 77: 1648–1655. doi: 10.1016/j.athoracsur.2003.04.004. [PubMed] [CrossRef] [Google Scholar]
100. Muldrew K., Rewcastle J., Donnelly B.J., Saliken J.C., Liang S., Goldie S., Olson M., Baissalov R., Sandison G. Антифризные пептиды Flounder повысить эффективность криохирургии. Криобиология. 2001; 42: 182–189.. doi: 10.1006/cryo.2001.2321. [PubMed] [CrossRef] [Google Scholar]
101. Багис Х., Аккоц Т., Тасс А., Ктопраклигил Д.А. Криогенное действие белка-антифриза на яичники трансгенных мышей и получение живого потомства путем ортотопической трансплантации криоконсервированных яичников мышей.