Способы защиты металлов от коррозии
Железо и сплавы на его основе подвержены коррозии – разрушению, которое происходит вследствие химического или электрохимического взаимодействия компонентов металлов и сплавов с различными веществами окружающей среды. В результате этих окислительно-восстановительных реакций металлы связываются в оксиды, что приводит к потере их эксплуатационных свойств. Первые проявления разрушительного процесса – образование на поверхности пятен рыжего цвета. Своевременные меры по предотвращению коррозии обеспечивают значительное продление срока службы металлических изделий и конструкций.
Виды коррозии металлов
Коррозионные процессы различаются по характеру разрушения, механизму протекания процесса, типу агрессивной среды, вызывающей коррозию.
Характер разрушения
По этому признаку выделяют следующие типы коррозии:
- Сплошная – равномерная или неравномерная. Затрагивает равномерно всю поверхность металлоизделия или конструкции.

- Местная. Поражаются отельные участки поверхности.
- Питтинг-коррозия (точечная). Поражения – отдельные, глубокие или сквозные.
- Межкристаллитная. Разрушающиеся области располагаются вдоль границ зерен.
Механизм протекания коррозии
Основные типы коррозии – химическая и электрохимическая. Химические коррозионные процессы протекают в результате химреакций, при которых разрушаются металлические связи, а образуются новые – между атомами металла и окислителя. Химическая коррозия возникает при контакте металлов и сплавов со средами, не проводящими электрический ток. Она может быть жидкостной и газовой.
- Газовая коррозия протекает в агрессивных газовых и паровых средах при отсутствии сконденсированной влаги на поверхности металлоизделия или металлоконструкции. Она может стать причиной полного разрушения железа и сплавов на его основе. На поверхности алюминия и алюминиевых сплавов в газовых средах образуется защитная пленка, защищающая их от коррозии.
 Примеры газов, которые становятся причиной возникновения химических коррозионных процессов: кислород, диоксид серы, сероводород.
Примеры газов, которые становятся причиной возникновения химических коррозионных процессов: кислород, диоксид серы, сероводород. - Жидкостная коррозия протекает при контакте металлической поверхности с жидкими неэлектролитами – нефтью и нефтепродуктами. При наличии даже небольшого количества воды этот химический процесс легко превращается в электрохимический.
Электрохимическая коррозия возникает при контакте металлов и сплавов с жидкостями-электролитами вследствие протекания двух взаимосвязанных процессов:
- анодный – ионы металла переходят в раствор электролита;
- катодный – электроны, которые образовались на стадии анодного этапа, связываются частицами окислителя.
В зависимости от среды, в которой протекают электрохимические коррозионные процессы, различают следующие типы коррозии:
- Атмосферная. Самая распространенная. Протекает в условиях атмосферы или другого влажного газа.

- В растворах электролитов – кислотах, щелочах, солях, обычной воде.
- Почвенная. Скорость процесса зависит от состава грунта. Наименее агрессивны песчаные почвы, наиболее – кислые почвы.
- Аэрационная. Ее вызывает неравномерный доступ воздушной среды к разным частям изделий и конструкций.
- Биологическая. Ее провоцируют микроорганизмы, которые в результате жизнедеятельности вырабатывают углекислый газ, сероводород и другие газы, вызывающие коррозионные процессы.
- Электрическая. Возникает из-за блуждающих токов, которые появляются при эксплуатации электротранспорта.
Общий вывод! Коррозионные процессы активнее всего развиваются на поверхностях, удобных для отложения пыли, осадков, плохо обдуваемых воздушными струями. Поэтому они подвержены застою воздуха, накоплению и длительному сохранению на поверхности влаги.
Способы защиты металла от коррозии
На стадии производства стали в ее состав могут вводиться легирующие добавки, которые предотвращают появление очагов всех (или некоторых) видов коррозии. Таким элементом является, хром, которого должно быть не менее 13 % от общего количества всех компонентов. Для предотвращения возникновения и развития коррозии в сталях без легирующих добавок используют следующие методы антикоррозионной защиты – конструктивные, пассивные, активные.
Конструктивные
Заключаются в защите поверхности металла с помощью нетонкослойных покрытий – панелей, резиновых прокладок, заслонов. Эти способы имеют мало преимуществ: их сложно, а иногда невозможно реализовать, материалы для конструктивной защиты стоят дорого и после монтажа занимают много места. Их применяют нечасто и только в местах, где они скрыты от глаз.
Пассивные
На металлическое изделие наносится тонкослойное покрытие, которое выполняет чисто барьерные характеристики, то есть процесс защиты заключается в предотвращении контакта металла с наружной средой..jpg)
Преимущества пассивного способа: невысокая цена и удобное нанесение покрытий, большой ассортимент составов разных цветов и характеристик, создание надежного барьера между металлом и окружающей средой. Недостатки: невысокая устойчивость к механическим повреждениям, необходимость периодически обновлять барьерный слой.
Активные (электрохимические)
Самый распространенный способ создания активной защиты для стальной поверхности – цинкование (горячее, термодиффузионное, гальваническое, холодное). Первые три технологии осуществимы только в производственных условиях. Чаще всего используется горячее цинкование. Стальной листовой прокат цинкуют на непрерывных линиях. Преимущества такого процесса: возможность получать цинковый слой достаточной толщины, высокие автоматизация и производительность процесса.
Принцип активного защитного действия цинка заключается в том, что он обладает меньшей скоростью коррозии в данной среде, что позволяет ему обеспечить электрохимическую катодную защиту стальной основы. При нанесении на сталь цинкового покрытия цинк с железом образуют гальваническую пару, в которой цинк является более активным металлом. При контакте с влагой и другими коррозионноопасными средами цинк-анод отдает электроны, которые принимает железо-катод, что позволяет ему сохранять свои технические характеристики. Защитный процесс длится до полного исчезновения цинкового слоя.
Плюсы цинкования – долговечность и возможность добавлять цинковый слой в процессе эксплуатации изделий и конструкций. Минусы – необходимость в тщательной подготовке поверхности, обязательное соблюдении технологических правил, сложность утилизации токсичных отходов.
Другие статьи:
Закалка стали
Отпуск стали
Состав и свойства стали
Электрохимическая защита трубопроводов от коррозии — электронный каталог продукции,разработка мобильных приложений,АОС,автоматизированные обучающие системы,семинары по нефтегазовой тематике,разработка СТУ,СТУ
Электрохимическая защита от коррозии состоит из катодной и дренажной защиты. Катодная защита трубопроводов осуществляется двумя основными методами: применением металлических анодов-протекторов (гальванический протекторный метод) и применением внешних источников постоянного тока, минус которых соединяется с трубой, а плюс — с анодным заземлением (электрический метод).Рис. 1. Принцип работы катодной защиты
Гальваническая протекторная защита от коррозии
Наиболее очевидным способом осуществления электрохимической защиты металлического сооружения, имеющего непосредственный контакт с электролитической средой, является метод гальванической защиты, в основу которого положен тот факт, что различные металлы в электролите имеют различные электродные потенциалы.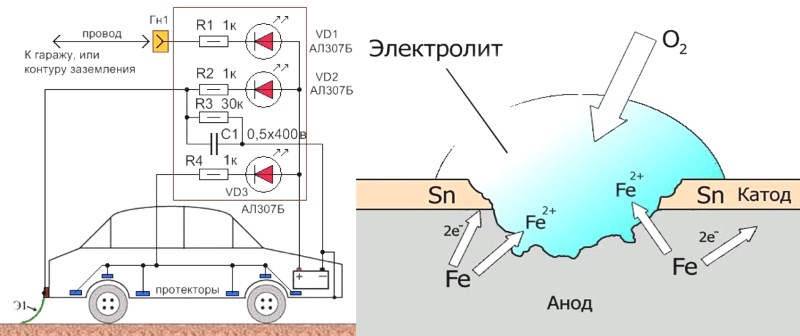 Таким образом, если образовать гальванопару из двух металлов и поместить их в электролит, то металл с более отрицательным потенциалом станет анодом-протектором и будет разрушаться, защищая металл с менее отрицательным потенциалом. Протекторы, по существу, служат портативными источниками электроэнергии.
Таким образом, если образовать гальванопару из двух металлов и поместить их в электролит, то металл с более отрицательным потенциалом станет анодом-протектором и будет разрушаться, защищая металл с менее отрицательным потенциалом. Протекторы, по существу, служат портативными источниками электроэнергии.
В качестве основных материалов для изготовления протекторов используются магний, алюминий и цинк. Из сопоставления свойств магния, алюминия и цинка видно, что из рассматриваемых элементов магний обладает наибольшей электродвижущей силой. В то же время одной из наиболее важных практических характеристик протекторов является коэффициент полезного действия, показывающий долю массы протектора, использованной на получение полезной электрической энергии в цепи. К.П.Д. протекторов, изготовленных из магния и магниевых сплавов, редко превышают 50 % в, в отличие от протекторов на основе Zn и Al с К.П.Д. 90 % и более.
Рис. 2. Примеры магниевых протекторов
Обычно протекторные установки применяются для катодной защиты трубопроводов, не имеющих электрических контактов со смежными протяженными коммуникациями, отдельных участков трубопроводов, а также резервуаров, стальных защитных кожухов (патронов), подземных резервуаров и емкостей, стальных опор и свай, и других сосредоточенных объектов.
В то же время протекторные установки очень чувствительны к ошибкам в их размещении и комплектации. Неправильный выбор или размещение протекторных установок приводит к резкому снижению их эффективности.
Катодная защита от коррозии
Наиболее распространенный метод электрохимической защиты от коррозии подземных металлических сооружений — это катодная защита, осуществляемая путем катодной поляризации защищаемой металлической поверхности. На практике это реализуется путем подключения защищаемого трубопровода к отрицательному полюсу внешнего источника постоянного тока, называемого станцией катодной защиты. Положительный полюс источника соединяют кабелем с внешним дополнительным электродом, сделанным из металла, графита или проводящей резины. Этот внешний электрод размещается в той же коррозионной среде, что и защищаемый объект, в случае подземных промысловых трубопроводов, в почве. Таким образом, образуется замкнутая электрическая цепь: дополнительный внешний электрод — почвенный электролит — трубопровод — катодный кабель — источник постоянного тока — анодный кабель. В составе данной электрической цепи трубопровод является катодом, а дополнительный внешний электрод, присоединенный к положительному полюсу источника постоянного тока, становится анодом. Данный электрод называется анодным заземлением. Отрицательно заряженный полюс источника тока, присоединенный к трубопроводу, при наличии внешнего анодного заземления катодно поляризует трубопровод, при этом потенциал анодных и катодных участков практически выравнивается.
В составе данной электрической цепи трубопровод является катодом, а дополнительный внешний электрод, присоединенный к положительному полюсу источника постоянного тока, становится анодом. Данный электрод называется анодным заземлением. Отрицательно заряженный полюс источника тока, присоединенный к трубопроводу, при наличии внешнего анодного заземления катодно поляризует трубопровод, при этом потенциал анодных и катодных участков практически выравнивается.
Таким образом, система катодной защиты состоит из защищаемого сооружения, источника постоянного тока (станции катодной защиты), анодного заземления, соединительных анодной и катодной линий, окружающей их электропроводной среды (почвы), а также элементов системы мониторинга — контрольно-измерительных пунктов.
Дренажная защита от коррозии
Дренажная защита трубопроводов от коррозии блуждающими токами осуществляется путем направленного отвода этих токов к источнику или в землю. Установка дренажной защиты может быть нескольких видов: земляной, прямой, поляризованный и усиленный дренажи.
Рис. 3. Станция дренажной защиты
Земляной дренаж осуществляется заземлением трубопроводов дополнительными электродами в местах их анодных зон, прямой дренаж — созданием электрической перемычки между трубопроводом и отрицательным полюсом источника блуждающих токов, например рельсовой сетью электрифицированной железной дороги. Поляризованный дренаж в отличие от прямого обладает только односторонней проводимостью, поэтому при появлении положительного потенциала на рельсах дренаж автоматически отключается. В усиленном дренаже дополнительно в цепь включается преобразователь тока, позволяющий увеличивать дренажный ток.
P.S. Обзор технических решений по ЭХЗ других металлических конструкций и сооружений можно прочитать здесь.
Хотите узнать больше о коррозии металлических конструкций и методах противокоррозионной защиты?
Скачайте наше специализированное учебно-справочное приложение «Защита от коррозии»
comments powered by HyperComments
16.
 8: Электрохимическая коррозия — Химия LibreTexts
8: Электрохимическая коррозия — Химия LibreTexts- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 265
- Стивен Лоуэр
- Университет Саймона Фрейзера
Цели обучения
Убедитесь, что вы полностью поняли следующие основные идеи. Особенно важно, чтобы вы знали точное значение всех выделенных терминов в контексте этой темы.
- Электрохимическая коррозия металлов происходит, когда электроны от атомов на поверхности металла переносятся на подходящий акцептор электронов или деполяризатор . Вода должна присутствовать, чтобы служить средой для переноса ионов.
- Наиболее распространенными деполяризаторами являются кислород, кислоты и катионы менее активных металлов.

- Поскольку электроны проходят через сам металлический объект, анодная и катодная области (две половины электрохимической ячейки) могут находиться далеко друг от друга.
- Анодные области имеют тенденцию развиваться в местах, где металл находится под напряжением или защищен от кислорода.
- Контакт с другим металлом, прямой или косвенный, может привести к коррозии более активного металла.
- Коррозию стали можно подавить с помощью цинкования , то есть путем покрытия ее цинком, более активным металлом, растворение которого оставляет на металле отрицательный заряд, препятствующий дальнейшему растворению Fe 2+ .
- Катодная защита с использованием внешнего источника напряжения широко применяется для защиты подземных сооружений, таких как резервуары, трубопроводы и опоры. Источником может быть расходуемый анод из цинка или алюминия, сетевой или фотогальванический источник питания.
Коррозию можно определить как разрушение материалов в результате химических процессов. Из них наиболее важной на сегодняшний день является электрохимическая коррозия металлов, при которой процесс окисления М → М + + е – облегчается наличием подходящего акцептора электронов, иногда называемого в науке о коррозии как деполяризатор.
Из них наиболее важной на сегодняшний день является электрохимическая коррозия металлов, при которой процесс окисления М → М + + е – облегчается наличием подходящего акцептора электронов, иногда называемого в науке о коррозии как деполяризатор.
В некотором смысле коррозию можно рассматривать как самопроизвольный возврат металлов в их руды; огромное количество энергии, затраченной на добычу, очистку и производство металлов в полезные предметы, рассеивается множеством различных путей. Экономические аспекты коррозии намного значительнее, чем думает большинство людей; предполагаемая стоимость коррозии только в США составляла 276 миллиардов долларов в год. Из них около 121 миллиарда долларов было потрачено на борьбу с коррозией, а разница в 155 миллиардов долларов осталась чистыми потерями для экономики. Коммунальные услуги, особенно системы питьевого водоснабжения и канализации, испытывают наибольшее экономическое воздействие, а автомобили и транспорт занимают второе место.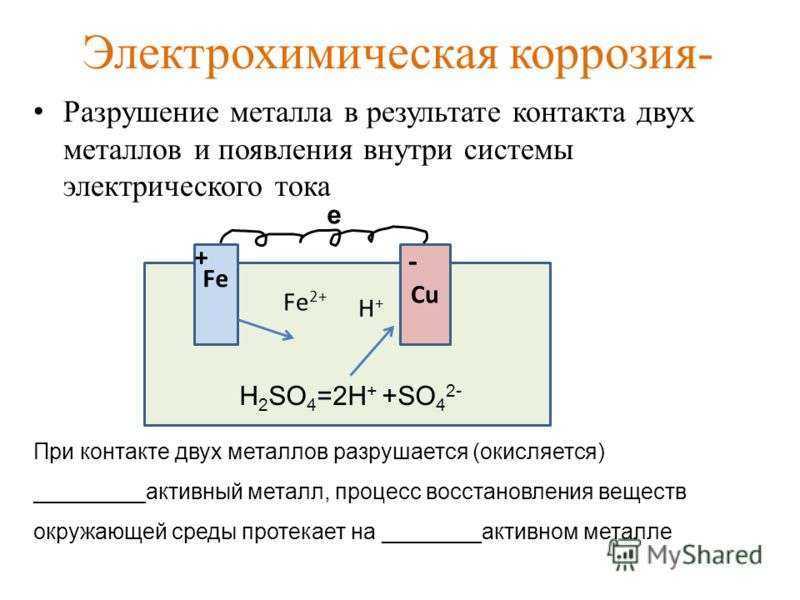
Ячейки коррозии и реакции
Особенностью большинства процессов коррозии является то, что стадии окисления и восстановления происходят в разных местах металла. Это возможно, потому что металлы являются проводящими, поэтому электроны могут течь через металл от анодных к катодным областям (рисунок \(\PageIndex{1}\)). Присутствие воды необходимо для переноса ионов к металлу и от него, но тонкой пленки адсорбированной влаги может быть достаточно.
Рисунок \(\PageIndex{1}\): Коррозия — это двухэтапный процесс. Рисунок \(\PageIndex{1}\): Электрохимическая коррозия железа. Коррозия часто начинается в месте (1), где металл находится под напряжением (на изгибе или сварке) или изолирован от воздуха (где соединяются два куска металла или под слабо прилипшей пленкой краски). Ионы металла растворяются в пленке влаги, а электроны мигрируют в другое место (2), где они поглощаются 9{–}} \rightarrow \ce{M(s)} \label{1.7.2c}\], где \(\ce{M}\) — металл.
То, какие части металла служат анодами и катодами, может зависеть от многих факторов, как видно из обычно наблюдаемых неравномерных структур коррозии. Атомы в областях, подвергшихся напряжению, которые могут быть получены путем формовки или механической обработки, часто имеют более высокую свободную энергию и, таким образом, имеют тенденцию становиться анодными.
Атомы в областях, подвергшихся напряжению, которые могут быть получены путем формовки или механической обработки, часто имеют более высокую свободную энергию и, таким образом, имеют тенденцию становиться анодными.
Если одна часть металлического предмета защищена от атмосферы так, что недостаточно \(\ce{O2}\) для создания или поддержания оксидной пленки, эта «защищенная» область часто будет местом, где коррозия наиболее активна. активный. Тот факт, что такие места обычно скрыты от глаз, объясняет большую часть трудностей в обнаружении коррозии и борьбе с ней.
Рисунок \(\PageIndex{3}\): Точечная коррозия Большинство металлов покрыты тонкой оксидной пленкой, препятствующей анодному растворению. Когда коррозия действительно возникает, иногда в металле образуются узкие отверстия или ямки. Дно этих ямок, как правило, лишено кислорода, что способствует дальнейшему прорастанию ямок в металл. (CC BY 3.0 непортированная; Стивен Лоуэр)
(CC BY 3.0 непортированная; Стивен Лоуэр)В отличие от анодных участков, которые, как правило, локализованы в определенных областях поверхности, катодная часть процесса может происходить практически где угодно. Поскольку оксиды металлов обычно являются полупроводниками, большинство оксидных покрытий не препятствуют потоку электронов к поверхности, поэтому почти любая область, которая подвергается воздействию \(\ce{O2}\) или какого-либо другого акцептора электронов, может действовать как катод. Тенденция мест, лишенных кислорода, к анодированию является причиной многих широко наблюдаемых моделей коррозии.
Ржавые автомобили и пятна в ванных комнатах
Любой, кто владел старым автомобилем, видел коррозию на стыках между частями кузова и под лакокрасочным покрытием. Вы также заметите, что как только начинается коррозия, она имеет тенденцию питаться сама собой. Одна из причин этого заключается в том, что одним из продуктов реакции восстановления O 2 является гидроксид-ион.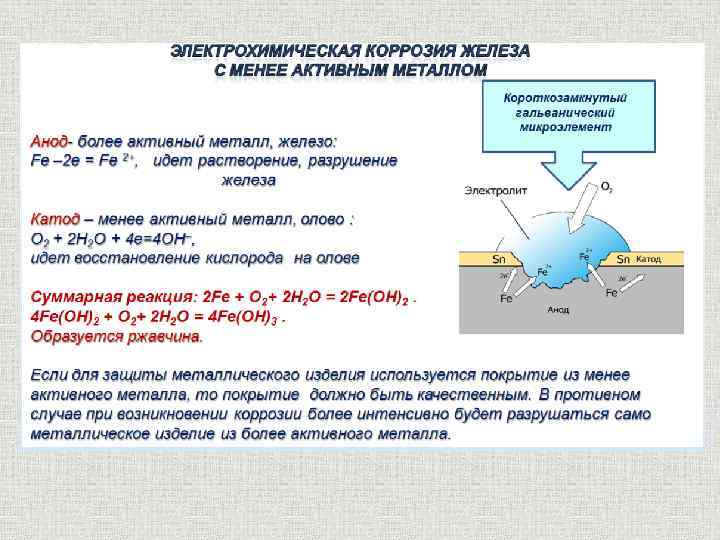 Высокий уровень pH, создаваемый в этих катодных областях, имеет тенденцию разрушать защитную оксидную пленку и может даже смягчить или ослабить пленки краски, так что эти участки могут стать анодными. Большее поступление электронов способствует более интенсивному катодному действию, что порождает еще больше анодных участков и т.д.
Высокий уровень pH, создаваемый в этих катодных областях, имеет тенденцию разрушать защитную оксидную пленку и может даже смягчить или ослабить пленки краски, так что эти участки могут стать анодными. Большее поступление электронов способствует более интенсивному катодному действию, что порождает еще больше анодных участков и т.д.
Очень распространенной причиной коррозии является контакт двух разнородных металлов, что может произойти вблизи крепежных деталей или сварных швов. В месте соединения собирается влага, действующая как электролит и образующая ячейку, в которой два металла служат электродами. Влага и токопроводящие соли на внешних поверхностях образуют внешний токопроводящий путь, эффективно замыкая элемент накоротко и вызывая очень быструю коррозию; Вот почему автомобили так быстро ржавеют в тех местах, где дороги посыпают солью, чтобы растопить лед.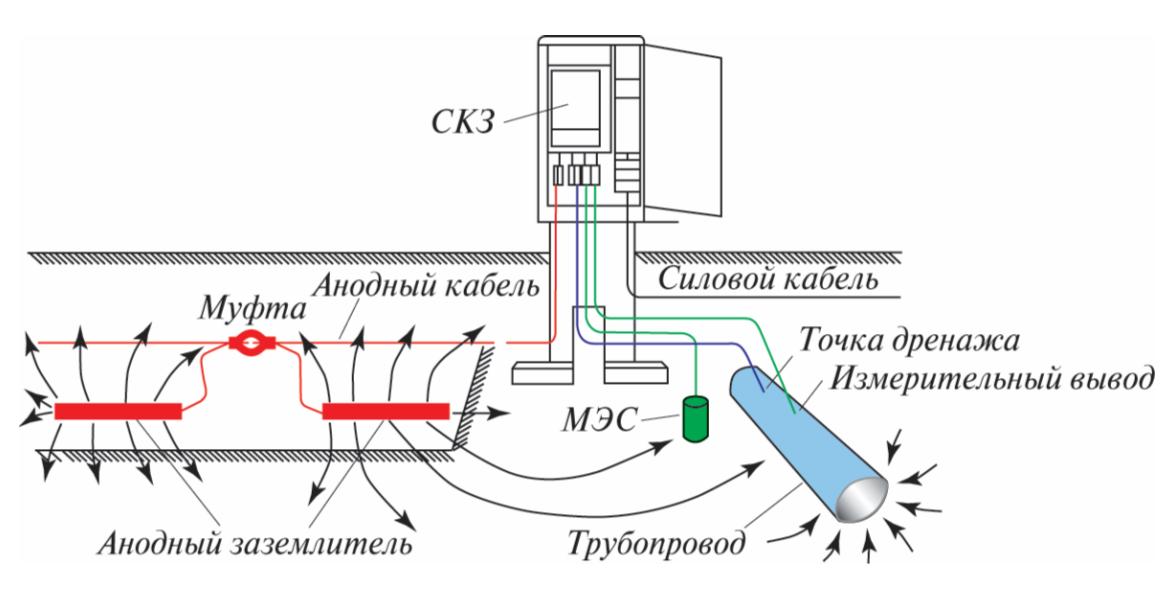 9{3+}}\) соли, выпадающие в осадок в виде зеленоватых пятен.
9{3+}}\) соли, выпадающие в осадок в виде зеленоватых пятен.
Контроль коррозии
Поскольку для возникновения коррозии должны иметь место как катодная, так и анодная стадии, предотвращение любой из них остановит коррозию. Наиболее очевидная стратегия — остановить оба процесса, покрыв объект краской или другим защитным покрытием. Даже если это будет сделано, вероятно, будут места, где покрытие сломано или не проникает, особенно если есть отверстия или резьба. Более сложный подход состоит в том, чтобы нанести на металл небольшой отрицательный заряд, что затруднит протекание реакции: 9{-}}.\]
Метод защиты 1: расходуемые покрытия
Одним из способов создания этого отрицательного заряда является нанесение покрытия из более активного металла. Таким образом, очень распространенным способом защиты стали от коррозии является покрытие ее тонким слоем цинка; этот процесс известен как цинкование. Цинковое покрытие, будучи менее благородным, чем железо, склонно к избирательной коррозии. Растворение этого жертвенного покрытия оставляет после себя электроны, которые концентрируются в железе, делая его катодным и, таким образом, препятствуя его растворению.
Растворение этого жертвенного покрытия оставляет после себя электроны, которые концентрируются в железе, делая его катодным и, таким образом, препятствуя его растворению.
Эффект покрытия железа менее активным металлом дает интересный контраст. Хорошим примером является обычная луженая банка (справа). Пока оловянное покрытие остается неповрежденным, все в порядке, но воздействие влажной атмосферы даже на крошечную часть нижележащего железа вызывает коррозию. Электроны, выпущенные из железа, перетекают в олово, делая железо более анодным, так что теперь олово активно способствует коррозии железа! Вы, наверное, замечали, как быстро разлагаются жестяные банки, оставленные на открытом воздухе.
Метод защиты 2: катодная защита
Более сложная стратегия заключается в поддержании постоянного отрицательного электрического заряда на металле, чтобы предотвратить его растворение в виде положительных ионов. Поскольку вся поверхность принудительно переходит в катодное состояние, этот метод известен как катодная защита . Источником электронов может быть внешний источник питания постоянного тока (обычно используемый для защиты нефтепроводов и других заглубленных конструкций), или это может быть коррозия другого, более активного металла, такого как кусок цинка или алюминия, зарытый в землю поблизости. , как показано на иллюстрации заглубленного резервуара для хранения пропана ниже.
Поскольку вся поверхность принудительно переходит в катодное состояние, этот метод известен как катодная защита . Источником электронов может быть внешний источник питания постоянного тока (обычно используемый для защиты нефтепроводов и других заглубленных конструкций), или это может быть коррозия другого, более активного металла, такого как кусок цинка или алюминия, зарытый в землю поблизости. , как показано на иллюстрации заглубленного резервуара для хранения пропана ниже.
Эта страница под названием 16.8: Электрохимическая коррозия распространяется под лицензией CC BY 3.0 и была создана, изменена и/или курирована Стивеном Лоуэром с помощью исходного контента, который был отредактирован в соответствии со стилем и стандартами платформы LibreTexts; подробная история редактирования доступна по запросу.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Автор
- Стивен Лоуэр
- Лицензия
- СС BY
- Версия лицензии
- 3,0
- Показать страницу TOC
- № на стр.

- Теги
- катодная защита
- коррозия
- коррозионная стойкость
- ржавчина
- Жертвенные покрытия
- источник@http://www.chem1.com/acad/webtext/virtualtextbook.html
Защита от коррозии, электрохимическая защита от коррозии
Защита от коррозии
Коррозия составила почти 1/3 вновь введенного металла. Часть его переплавляется и возвращается в промышленность. Но все равно 10% от общего веса — теряются навсегда.
Разрушение отдельных металлических деталей может повлечь за собой разрушение целых механизмов, создание аварийной ситуации.
В связи с этим при создании металлических предметов, устройств, механизмов большее внимание следует уделять защита от коррозии . Радикальный метод защиты от коррозии от поиска коррозионно-стойких материалов для агрессивных сред. Полностью заменить металлы на неметаллические предметы — невозможно.
Радикальный метод защиты от коррозии от поиска коррозионно-стойких материалов для агрессивных сред. Полностью заменить металлы на неметаллические предметы — невозможно.
Защита от коррозии позволяет своевременно и надежно изолировать металл от агрессивных сред. Для защиты металла от разрушения с созданием на его поверхности защитной пленки — покрытия. Способы создания защитных пленок различны. Например, коррозионный металл, покрытый слоем другого металла, который не разрушается в тех же условиях. В качестве покрытий используются неметаллические покрытия, органические материалы — пленочные высокополимерные вещества, краски, льняное масло, а также композиции высокополимерных и неорганических пигментов.
Особое значение имеют пленки оксидов металлов, полученные при действии кислорода или подходящих окислителей (азотная кислота HNO 3 , дихромат калия К 2 Cr 2 O 7 и др. ) на поверхности металлов. Часто эти оксидные пленки образуются на поверхности металлов даже при простом контакте с воздухом, что делает химически активные металлы (алюминий, цинк) устойчивыми к коррозии.
Такова роль защитных нитридных покрытий, образующихся при воздействии азота или аммиака на поверхность некоторых металлов. Искусственное оксидирование, азотирование, фосфатирование являются хорошей защитой металлов от коррозии.
) на поверхности металлов. Часто эти оксидные пленки образуются на поверхности металлов даже при простом контакте с воздухом, что делает химически активные металлы (алюминий, цинк) устойчивыми к коррозии.
Такова роль защитных нитридных покрытий, образующихся при воздействии азота или аммиака на поверхность некоторых металлов. Искусственное оксидирование, азотирование, фосфатирование являются хорошей защитой металлов от коррозии.
Электрохимическая защита от коррозии
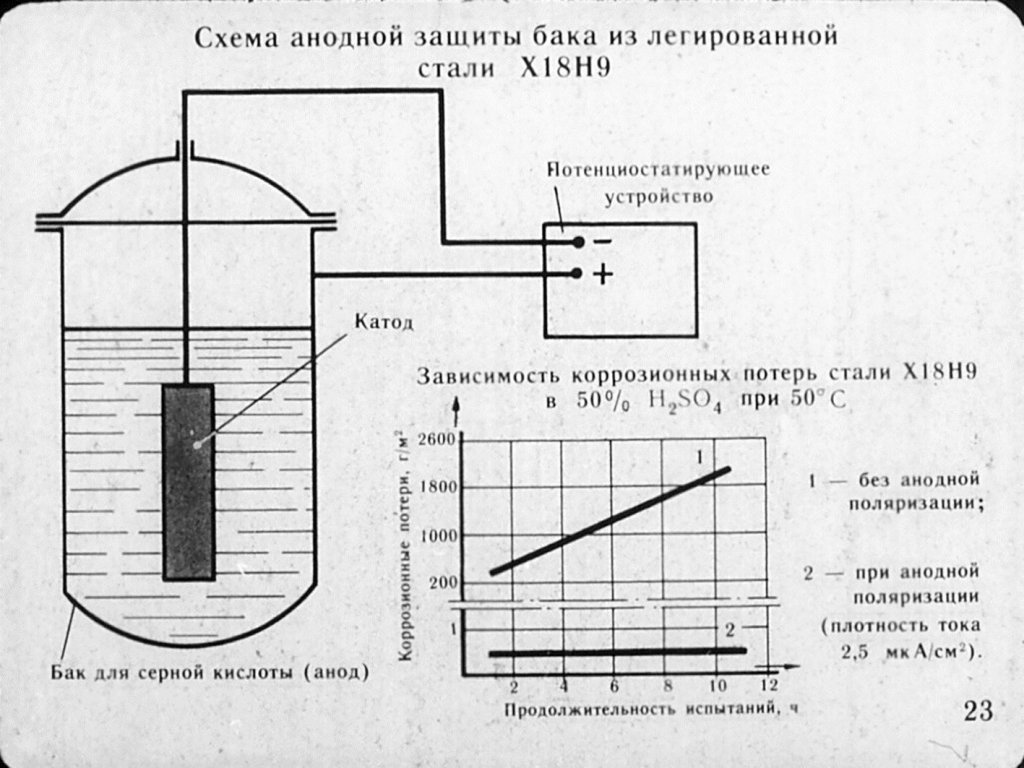
Электрохимическая защита от коррозии металлических объектов основана на изменении потенциала защищаемого металла и не связана с изоляцией металла от агрессивной среды. Это катодная защита . Его еще называют анодной защитой .
Катодная защита от коррозии Катодная защита — заключается в том, что защищаемая конструкция «А» в электролитной среде (например, грунтовой воде) присоединяется к катоду (отрицательно заряженному электроду) источника электроэнергии. Конструкция защищаемого становится катодом. В эту же агрессивную среду помещают кусок старого металла (рейку или балку) для присоединения к аноду внешнего источника электричества. В процессе коррозии этот кусок старого металла становится анодом и разрушается.
В эту же агрессивную среду помещают кусок старого металла (рейку или балку) для присоединения к аноду внешнего источника электричества. В процессе коррозии этот кусок старого металла становится анодом и разрушается.
Протектор защиты от коррозии отличается от катодной защиты тем, что для него используется специальный анод — протектор , используемый металл более активен, чем защищаемый металл (алюминий, цинк). Протектор соединен с защищаемой конструкцией проводником электрического тока. В процессе защиты от коррозии протектор представляет собой анод (положительно заряженный электрод) и разрушается, тем самым предохраняя от разрушения нашу защищаемую конструкцию.
Учитывать процесс коррозии, повреждение металлического защитного покрытия.
1. Если металл покрыт менее активным металлом. Например, олово (Sn) покрывает железо (Fe) и довольно устойчиво к действию разбавленных кислот. При повреждении такого покрытия возникает гальванический элемент, при котором электрон переходит от железа к олову, то есть анодом является железо (оно растворяется и ломается), а катодом — олово (остается неизменным).
2. Если металлическое покрытие с более активным металлом. Например, покрытия железа (Fe) цинком (Zn). После механического повреждения цинкового покрытия возникает гальванический элемент, в котором железо служит катодом (не растворяется), а цинк — анодом. В этом случае железо не будет разрушено до тех пор, пока не разрушится цинк.
Из этих случаев можно сделать вывод, что надежное защитное покрытие этого металла более активно, чем защищаемый металл.
Защита от коррозии
Ингибиторы коррозии
Для замедления коррозии металлических предметов в агрессивной среде добавляют вещества (часто органические), называемые >ингибиторы коррозии (замедлители окисления металла). Этот метод успешно применяется, когда необходимо защитить металл от кислотной коррозии. Ингибиторы широко применяются при очистке паровых котлов от накипи, для удаления накипи с отработанных частей и последующего хранения и транспортировки соляной кислоты в стальной таре.
В качестве органических ингибиторов используют тиомочевину (химическое название сульфид-диамид углерода C(NH 2 ) 2 S ), диэтиламин, уротропин (CH 2 ) 6 N 4 ) другие производные аминов.
В качестве неорганических ингибиторов используют силикаты (соединения металлов с кремнием Si), нитриты (соединения азота N), дихроматы щелочных металлов и др. Иногда удалением кислорода из воды также можно добиться снижения коррозионных свойств воды. И сделать это с помощью фильтрации воды через слой железных опилок!
Очистка стальных изделий
Удалить ржавчину механическими средствами невозможно. Поэтому часто применяют растворы, содержащие сильные химические реагенты — кислоты, основания и т. д. С ликвидация ржавчины дает эффект защиты поверхности от внешних воздействий.
Слабозагрязненные и ржавые детали на несколько часов замачивают в бензине, после чего грязь и ржавчину удаляют тряпкой, смоченной в бензине, или проволочной щеткой для глубокой ржавчины.