советы по подготовке, правила эксплуатации
Электрическая батарея автомобиля представляет собой перезаряжаемый аккумулятор, который обеспечивает электрической энергией двигатель при его запуске и позволяет функционировать всем системам транспортного средства. Работоспособность батареи определяется его выходным напряжением, которое в большей степени зависит от состава электролита для аккумуляторов.
Содержание
- Общая информация
- Концентрация кислоты
- Правила эксплуатации
- Измерение плотности
- Уровень жидкости
- Подготовка электролита и батареи
Аккумуляторная батарея получила такое название потому, что она состоит из нескольких ячеек, которые располагаются одна за другой в ряд. Такое устройство является последовательным соединением электрических элементов в цепи, что позволяет увеличить выходное напряжение. Каждая ячейка батареи представляет собой закрытый сосуд, в котором расположены два электрода, погруженные в специальную жидкость — электролит, представляющий собой смесь серной кислоты и дистиллированной воды. Он выступает в качестве среды, обеспечивающей ионный обмен между электродами.
Он выступает в качестве среды, обеспечивающей ионный обмен между электродами.
Положительные электроды — пластины, которые состоят из пентоксида свинца, а отрицательные электроды — пластины из активного свинца. Они объединяются и группируются с помощью контактных прослоек горизонтального и вертикального типа. Такая структура обеспечивает равномерное распределение электрического тока. Объединение положительных и отрицательных свинцовых пластин называется элементом. Как правило, отрицательные пластины имеют большую толщину.
Каждый элемент батареи отделяется тонкой прослойкой из пластика. Эта прослойка предотвращает возникновение короткого замыкания между рядом находящимися плюсом и минусом соседних элементов.
Между электродами и электролитом происходят электрохимические реакции, в результате которых поглощаются или выделяются электроны. Такие реакции создают разницу напряжений между электродами элемента.
На внешнюю часть корпуса аккумулятора выводятся две клеммы, с помощью которых он подсоединяется к электрической цепи. Эти клеммы расположены на верху корпуса, однако в некоторых батареях они делаются сбоку. В последнем случае возникает множество проблем, связанных с их расположением, в частности, боковые клеммы облегчают скопление паров электролита внутри батареи, что приводит к быстрому выходу из строя его рабочих элементов.
Клемма аккумулятора является либо положительной, либо отрицательной. Положительная клемма имеет больший размер, поэтому выполнить правильную установку батареи не составит никакого труда даже новичку. Если подсоединить неправильно аккумулятор, то есть перепутать плюс и минус, тогда можно повредить всю электрическую цепь.
Происходящие электрохимические реакции приводят к медленному износу активных элементов батареи, в частности, отрицательные электроды окисляются и становятся толще, а положительные электроды восстанавливаются и утончаются. По этой причине при покупке аккумулятора для автомобиля всегда следует обращать внимание на гарантийный срок службы устройства.
По этой причине при покупке аккумулятора для автомобиля всегда следует обращать внимание на гарантийный срок службы устройства.
Аккумулятор может работать в ограниченном температурном диапазоне и плохо переносит низкие температуры, поэтому уход за ним состоит в периодических проверках напряжения на его клеммах и его механической целостности. Важно следить за наличием в батареи электролита для кислотных аккумуляторов и составом его.
Концентрация кислоты
Основным компонентом электролита автомобильной аккумуляторной батареи (АКБ) является концентрированная серная кислота. Но на чистой серной кислоте устройство работать не может, поэтому в составе автомобильного электролита также присутствует дистиллированная вода. Государственный стандарт ГОСТ 667–73 регулирует качество серной кислоты, поставляемой для АКБ. Важность соблюдения этого ГОСТа связаны с резким снижением срока службы устройства в случае использования грязной серной кислоты.
Плотность серной кислоты равна 1,84 г/мл, рабочее же значение плотности электролита составляет 1,3 г/мл. Следует знать, что при приготовлении электролита выделяется большое количество теплоты, поэтому не нужно забывать правило, что следует всегда лить кислоту в воду, и ни в коем случае наоборот.
Следует знать, что при приготовлении электролита выделяется большое количество теплоты, поэтому не нужно забывать правило, что следует всегда лить кислоту в воду, и ни в коем случае наоборот.
Электролит, плотность которого лежит в пределе 1,07 — 1,30 г/мл, считается пригодным для работы. Этому пределу плотности соответствует концентрация h3SO4 27−40%.
Правила эксплуатации
Свойства электролита достаточно чувствительны к смене температурного режима окружающей среды, поэтому в зонах с умеренным климатом рекомендуется проверять его состояние два раза в год: в конце осени и в конце весны.
Измерение плотности
Плотность является важной характеристикой кислотного электролита, состав которого определяет ее величину. Прибор, которым измеряется плотность электролита, называется ареометром, который можно купить в любом автомагазине. При его использовании следует учитывать температуру окружающей среды и связанный с ней поправочный коэффициент.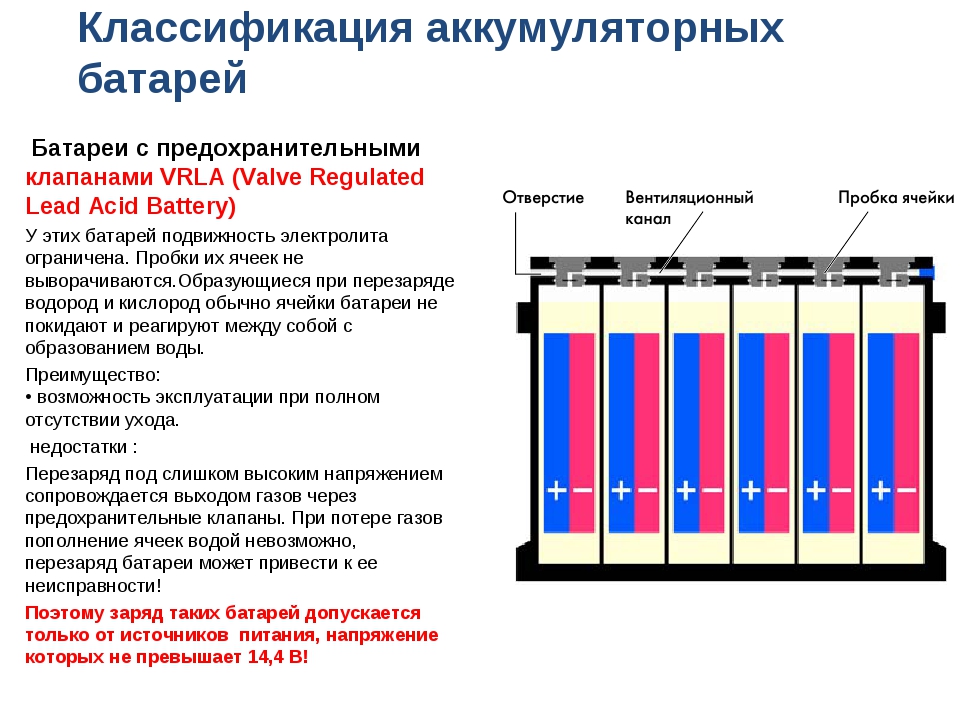
Следующая таблица демонстрирует поправочные коэффициенты к полученным показаниям ареометра в зависимости от температуры (градусы Цельсия):
- от -40 до -26: -0,04;
- от -25 до -11: -0,03;
- от -10 до +4: -0,02;
- от +5 до +19: -0,01;
- от +20 до +30: 0,00;
- от +31 до +45: +0,01.
Помимо ареометра, для записи измеренных результатов рекомендуется заранее приготовить чистый лист бумаги и карандаш. Проверку необходимо проводить в каждом элементе батареи отдельно.
- Первым делом следует открыть каждую емкость в батарее, плотность электролита в которой должна быть измерена.
- Предназначенную для измерения часть ареометра нужно поместить в электролит.
- Грушей прибора следует забрать некоторую порцию электролита так, чтобы поплавок ареометра начал плавать.
- В месте соприкосновения специального стержня и жидкости следует смотреть настоящие показания измеряемой величины.

- Полученный результат записать, а затем провести аналогичные действия для оставшихся емкостей батареи.
Плотность является физической величиной, размерность которой определяется как г/см3. В случае электролита после проведенных измерений следует удостовериться, что ее колебания во всех элементах АКБ не превышают 0,2−0,3 г/см3. Если средняя величина плотности по всем емкостям АКБ лежит ниже установленного значения в паспорте, тогда необходимо зарядить аккумулятор.
При уходе за аккумулятором и контроле плотности электролита необходимо иметь в виду температурный режим. Так, в холодное время года следует поддерживать более высокие значения этой величины (1,30 г/см3), так как она обеспечивает более низкую температуру замерзания жидкости. Например, если значение плотности лежит ниже 1,1 г/см3, то в электролите могут появляться кристаллики льда уже при температуре -6 °C. Летом же лучше снижать плотность заряженной батареи до уровня 1,23 г/см3, поскольку чем она ниже, тем дольше прослужит устройство.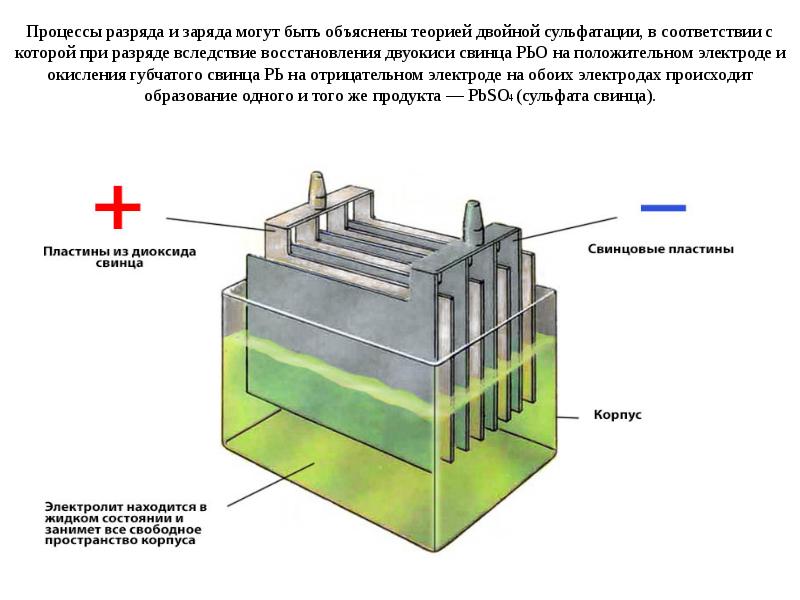
Зимой при низких температурах воздуха рекомендуется снимать аккумулятор с автомобиля и заносить его в помещение, в котором следует проводить все контролирующие замеры электролитических параметров. Кроме того, для эксплуатации электроприбора в северных районах страны следует приобрести специальный контейнер-рубашку, который позволяет сохранять тепло корпуса АКБ.
Уровень жидкости
Еще одной ключевой характеристикой аккумуляторной батареи, за которой необходимо следить регулярно, является уровень электролита в каждом элементе. Согласно общим рекомендациям, он не должен быть ниже 1−1,5 см верхнего края пластин.
Перед измерением уровня электролита в каждой секции батареи следует поставить электроприбор на горизонтальную поверхность. После этого рекомендуется взять стеклянную трубку длиной 25−30 см и диаметром 5−6 мм, опустить ее на дно измеряемой банки, закрыть свободный конец трубочки большим пальцем, чтобы предотвратить спад жидкости в ней при вытягивании из банки, а затем вытянуть ее из электролита и любой линейкой измерить уровень.
Эту операцию можно провести с помощью обычного листа бумаги, который следует свернуть в трубочку и опустить на дно измеряемой емкости. При последующем измерении линейкой мокрого отпечатка на листе следует учесть величину погрешности, возникающую из-за капиллярного эффекта.
Если при измерениях обнаружен недостаток жидкости в какой-либо емкости батареи, тогда следует в нее добавить нужное количество дистиллированной воды.
Делать это следует осторожно, небольшими порциями, поскольку вода, попадая в кислоту, вызывает большое выделение теплоты и вскипание. Добавлять следует именно воду, а не электролит, в противном случае можно серьезно повредить электроприбор.
Подготовка электролита и батареи
Если старый аккумулятор вышел из строя и пришло время купить новый, то можно поступить двумя способами: во-первых, можно купить уже готовый залитый в АКБ электролит, во-вторых, можно приобрести сухозаправленную батарею и самостоятельно выполнить ее заливку. Первый способ рекомендуется для новичков, ко второму же методу следует прибегать, если прибор будет эксплуатироваться в каких-либо экстремальных условиях.
Первый способ рекомендуется для новичков, ко второму же методу следует прибегать, если прибор будет эксплуатироваться в каких-либо экстремальных условиях.
При подготовке раствора самостоятельно необходимо следующее:
- Канистра с дистиллятом, которая продается в каждом автомагазине, приобрести эту воду можно и в аптеке.
- Серная кислота h3SO4. Рекомендуется приобретать ее в разбавленном виде, то есть с плотностью 1,40 г/см3. Реже используется концентрированная кислота с плотностью 1,84 г/см3.
- Градуированная емкость, которую можно использовать, чтобы отмерять нужные порции жидкости.
- При приготовлении электролита его нужно будет мешать, поэтому следует запастись трубкой из химически инертного материала, например, из стекла или керамики.
- Резиновые перчатки, прозрачные очки, защитный фартук, старая одежда — основные средства индивидуальной защиты.
Во время приготовления раствора следует соблюдать элементарные правила химической безопасности, которые заключаются в добавлении воды в электролит не большими порциями, что может привести к вскипанию и разбрызгиванию во все стороны жидкости, а тонкой струей.
Аккумуляторный электролит нужного состава готовится согласно инструкции на упаковке путем смешивания кислоты и дистиллята. В ряде случаев их объемы смешиваются в равных количествах. После завершения процедуры надо будет замерить плотность ареометром.
В различных моделях автомобилей используют АКБ разного объема, вариации которого составляют от 2,6 до 3,7 л. В любом случае электролит можно приготовить с запасом, а оставшийся раствор необходимо нейтрализовать, бросив в него несколько ложек пищевой соды.
Как только рабочий раствор подготовлен, его нужно залить во все емкости батареи. Использовать для этого нужно либо стеклянную воронку, либо стеклянную кружку с удобным носиком. Процесс заполнения банок прибора следует проводить аккуратно и не спеша.
Заполнение производят до уровня, когда свинцовые пластины поднимаются над поверхностью электролита на 1−1,5 см.
Затем прибор оставляют на 3−4 часа, при этом плотность раствора может незначительно уменьшиться.
Через несколько часов после заправки АКБ заряжают. Выполняется это так: на корпусе батареи проверяется значение емкости в Ампер-часах, это число делится на 10, и полученную величину уже используют для установления тока зарядки. Например, если емкость батареи составляет 80 А*ч, тогда ток для ее зарядки равен 8 А. Заряжать следует в течение 4 часов, после чего замеряются значения плотности и уровня электролита, и если они соответствуют рабочим величинам, тогда аккумуляторная батарея готова к использованию.
состав и свойства — Информация
Пластиковый корпус и два контакта для подключения проводов. Именно так представляется автомобильный аккумулятор большинству из современных владельцев авто. Однако чтобы эксплуатировать его максимально эффективно, безопасно и без неожиданных сюрпризов, о батарее стоит знать немного больше.
Сегодня речь пойдет о столь важной составляющей конструкции авто и мото аккумуляторов, как электролит. Он представляет собой раствор серной кислоты, которая считается, пожалуй, одним из ключевых химических соединений в мире. Это обусловлено широким спектром ее применения. Раствор серной кислоты продается под различными наименованиями, которые зависят от степени крепости, а также уровня чистоты. Приведем несколько распространенных примеров:
- Камерная кислота – раствор серной кислоты с водой в пропорции от 60:40 до 70:30.
- Башенная кислота – раствор с соотношением от 75:25 до 82:18.
- Купоросное масло с содержанием серной кислоты до 97%.
- 100% серная кислота – моногидрат.
Если говорить о максимальной крепости, получаемой способом выпаривания, то этот параметр может достигать 98,5%. Однако для заправки аккумуляторных батарей ключевое значение приобретает чистота растворов купоросного масла с химической точки зрения.
Отметим также, что концентрированной серной кислотой называется совершенно прозрачная жидкость, не имеющая ни цвета, ни запаха. Она обладает консистенцию легкого масла. Ее удельный вес составляет 1б84 при температуре 15°С. В ней содержится примерно 95% серной кислоты. Концентрат может смешиваться с водой в любой пропорции. Изготавливая электролит в бытовых условиях, следует помнить, что смешивание воды и кислоты вызывает выделение значительного количества тепла. Температура кипения концентрированной серной кислоты составляет 338 градусов Цельсия.
Интересным фактом из курса химии является сокращение объема раствора. Примечательно то, что при смешении двух объемов серной кислоты и воды, соответственно, их итоговый объем будет меньше, чем суммарный.
Также обратите внимание на то, что удельный вес или плотность электролита авто или мото аккумулятора имеет непосредственную зависимость от тех температур, при которых работают аккумуляторы. Так, при эксплуатации в условиях низких температур нужен более плотный электролит. А в жарких странах – напротив – плотность электролита сознательно снижается. Это объясняется тем, что при таких температурах существенно повышается химическая активность раствора.
А в жарких странах – напротив – плотность электролита сознательно снижается. Это объясняется тем, что при таких температурах существенно повышается химическая активность раствора.
В заключение отметим, что плотность электролита также зависит от того, в каких режимах эксплуатируется батарея. Так, данный параметр для тяговых аккумуляторов обычно составляет 1.26 кг\с м³ , пусковые и осветительные источники питания имеют плотность до 1.3 кг\с м³ и т.д. Для автомобильных аккумуляторных батарей эта характеристика читается нормой, когда составляет 1.28 кг\с м³ .
23.08.2013, 76698 просмотров.
Достижения в составе батарей
Хотя термин «батарея» не использовался до экспериментов Бенджамина Франклина в 1749 году, то, что сейчас называется «багдадскими батареями», было первым известным составом батареи, использовавшимся в Месопотамии около 200 г. до н.э. Они состояли из кувшина, содержащего железный стержень, покрытый медью, и кислотный агент, такой как уксус. Их точное назначение неизвестно, но, возможно, они носили религиозный или медицинский характер.
Их точное назначение неизвестно, но, возможно, они носили религиозный или медицинский характер.
Первая современная батарея, ныне известная как гальванический столб, была изобретена в 179 г.9. Эта батарея состояла из чередующихся слоев меди и цинка, разделенных пропитанной рассолом тканью или бумагой. В 1836 году он был усовершенствован как ячейка Даниэля, в которой был стеклянный сосуд, содержащий медный диск, раствор сульфата меди, цинковый диск и раствор сульфата цинка. Ячейка Даниэля работала достаточно хорошо, и ее использовали для питания телефонов и дверных звонков до того, как электричество стало обычным явлением.
Аккумуляторы промышленного производства появились на рынке в 1898 году и производились компанией National Carbon Company. Эта компания в конечном итоге стала Eveready Battery Company, которая существует до сих пор. Технологии аккумуляторов продолжают развиваться, и на горизонте нас ждут новые захватывающие прорывы.
Современные батареи и состав батарей
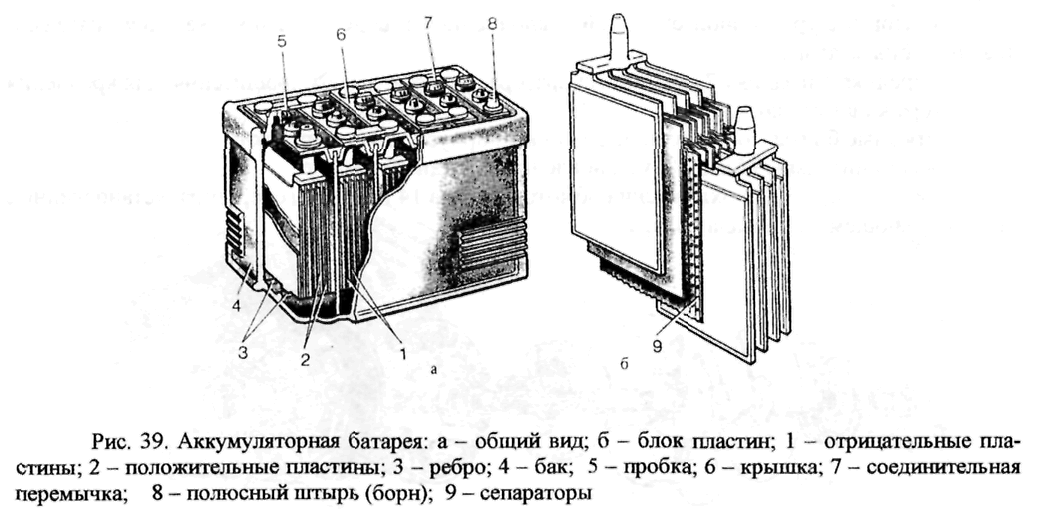
Все батареи имеют две клеммы, положительную и отрицательную. Внутри корпуса батареи анод подключается к отрицательной клемме, а катод подключается к положительной клемме. Разделитель находится между ними, чтобы предотвратить их соприкосновение, а электролит позволяет электрическому заряду течь между ними. Коллектор направляет заряд наружу батареи и через «нагрузку», которой питается батарея.
Внутри корпуса батареи анод подключается к отрицательной клемме, а катод подключается к положительной клемме. Разделитель находится между ними, чтобы предотвратить их соприкосновение, а электролит позволяет электрическому заряду течь между ними. Коллектор направляет заряд наружу батареи и через «нагрузку», которой питается батарея.
Внутри батареи происходит ряд химических реакций, когда нагрузка замыкает цепь: окисление на аноде высвобождает электроны, а восстановление на катоде поглощает эти электроны. Какие химические вещества используются, зависит от типа состава батареи:
- Дешевые сухие батареи: Батареи низкого уровня AAA, AA, C и D часто являются углеродно-цинковыми. Анод изготовлен из цинка, а катод из диоксида магния. Раствор электролита может представлять собой хлорид цинка или хлорид аммония.
- Сухие батареи более высокого класса: Более дорогие батареи AA, C и D обычно называют щелочными батареями, поскольку раствор электролита имеет щелочную природу (pH больше 7).
 Анод изготовлен из порошка цинка, катод — из диоксида магния, электролит — из раствора гидроксида калия. Эти батареи имеют более высокую емкость, чем угольно-цинковые батареи, а также более длительный срок хранения. Они также менее склонны к утечке.
Анод изготовлен из порошка цинка, катод — из диоксида магния, электролит — из раствора гидроксида калия. Эти батареи имеют более высокую емкость, чем угольно-цинковые батареи, а также более длительный срок хранения. Они также менее склонны к утечке. - Перезаряжаемые свинцово-кислотные батареи: 9 шт.0011 Аккумуляторные свинцово-кислотные батареи имеют анод из свинца и катод из диоксида свинца. Раствор электролита состоит из разбавленной серной кислоты. Как первые коммерчески жизнеспособные перезаряжаемые батареи, свинцово-кислотные батареи используются в различных приложениях, в том числе в автомобилях, жилых автофургонах, инвалидных креслах с электроприводом и даже в системах хранения солнечной энергии. Однако их все чаще заменяют перезаряжаемыми литий-ионными батареями из-за их превосходных свойств.
- Перезаряжаемые литий-ионные батареи: 9 шт.0011 Анод литий-ионной батареи изготовлен из углерода (обычно, хотя и не всегда, из графита), а катод — из оксида лития.
 Раствор электролита представляет собой соль лития в органическом растворителе. Литий-ионные аккумуляторы в настоящее время являются самыми передовыми аккумуляторами, используемыми в коммерческих целях. Они имеют значительно более высокую емкость, чем свинцово-кислотные батареи, гораздо более эффективны и имеют гораздо более длительный срок службы.
Раствор электролита представляет собой соль лития в органическом растворителе. Литий-ионные аккумуляторы в настоящее время являются самыми передовыми аккумуляторами, используемыми в коммерческих целях. Они имеют значительно более высокую емкость, чем свинцово-кислотные батареи, гораздо более эффективны и имеют гораздо более длительный срок службы.
Поскольку технологии продолжают быстро развиваться, батареи должны идти в ногу со временем. Некоторые из наиболее многообещающих достижений будут связаны с технологией литий-ионных аккумуляторов. Исследователи экспериментируют с различными соединениями, которые могут хранить больше лития, а также с различными типами углерода, чтобы оптимизировать работу анода.
Еще одной перспективной технологией является литий-серный аккумуляторный состав. С серой в качестве катода и металлическим литием в качестве анода эти батареи только сейчас разрабатывают прототипы, но их теоретическая плотность энергии выглядит невероятно высокой.
Твердотельные батареи заменят раствор электролита в традиционных батареях твердым электролитным соединением с высокой проводимостью. Новые негорючие полимеры с высокой емкостью могут революционизировать безопасность, вес и даже срок годности. Вполне возможно, что твердотельные технологии могут появиться одновременно с литий-серными технологиями, создав совершенно новый класс батарей, предназначенных для электромобилей, аэрокосмической и других отраслей промышленности с тяжелыми нагрузками.
Noah Chemicals предлагает клиентам самые чистые химические вещества. Чтобы поговорить с квалифицированным химиком о нестандартных химикатах и оптовом заказе, свяжитесь с нами сегодня!
Химический состав первичных и перезаряжаемых батарей с плотностью энергии
Химический состав первичных и перезаряжаемых батарей с плотностью энергии Старые батареи в основном были основаны на перезаряжаемых свинцово-кислотных или неперезаряжаемых щелочных химических элементах с номинальным напряжением с шагом 2,10–2,13 и 1,5 В соответственно, каждый из которых представлял собой отдельный гальванический элемент.
Новые специальные химические составы батарей изменили старые соглашения об именах. Перезаряжаемые NiCd (никель-кадмиевые) и NiMH (никель-металлогидридные) обычно выдают 1,25 В на элемент. Некоторые устройства могут неправильно работать с этими элементами из-за снижения напряжения на 16%, но большинство современных устройств справляются с ними хорошо. И наоборот, литий-ионные перезаряжаемые батареи выдают 3,7 В на элемент, что на 23% выше, чем у пары щелочных элементов (3 В), для замены которых они часто предназначены. Неперезаряжаемые литий-химические батареи, которые обеспечивают исключительно высокую плотность энергии, производят около 1,5 В на элемент и, таким образом, аналогичны щелочным батареям.
Многие новые размеры батарей относятся как к размеру, так и к химическому составу батарей, в то время как старые названия — нет. Эта сводка относится только к типам, относящимся к «размерам» батарей.
Химический состав первичных аккумуляторов
| Цинк-углерод | 1,5 | 0,13 | Недорого. |
| Цинк хлорид | 1,5 | Также известен как «сверхмощный», недорогой. | |
| щелочной (двуокись цинка-марганца) | 1,5 | 0,4-0,59 | Умеренная плотность энергии. Хорошо подходит для использования с высоким и низким уровнем стока. |
| оксигидроксид никеля (двуокись цинка-марганца/оксигидроксид никеля) | 1,7 | Умеренная плотность энергии. Хорошо подходит для использования с высоким уровнем стока. | |
| Литий (литий-оксид меди) Li-CuO | 1,7 | Больше не производится.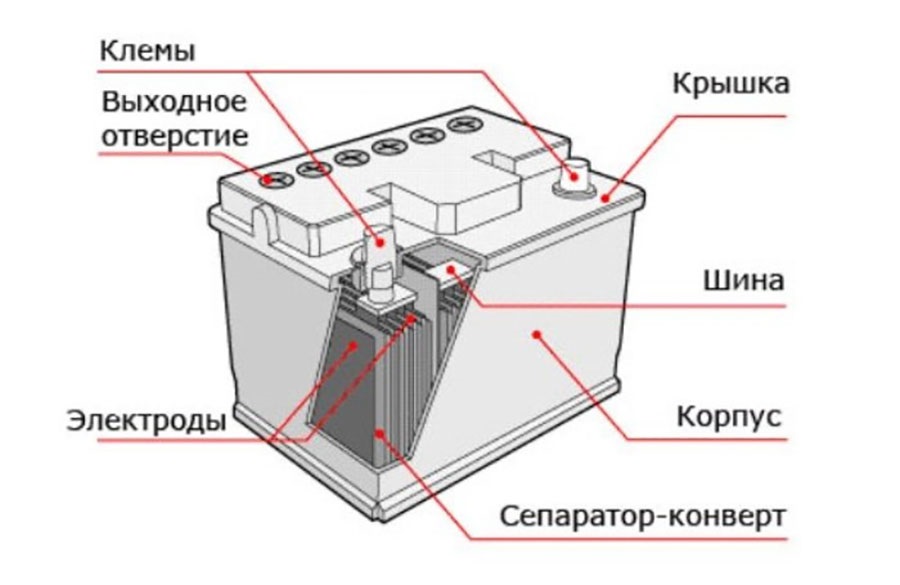 Заменены аккумуляторами на основе оксида серебра (IEC-типа «SR»). | |
| Литий (литий–дисульфид железа) LiFeS2 | 1,5 | Дорого. Используется в «плюсовых» или «экстра» батареях. | |
| Литий (литий-диоксид марганца) LiMnO2 | 3,0 | 0,83 – 1,01 | Дорого. Используется только в устройствах с высоким энергопотреблением или для длительного хранения из-за очень низкой скорости саморазряда. Один только «литий» обычно относится к этому типу химии. |
| Оксид ртути | 1,35 | Высокий расход и постоянное напряжение. Запрещен в большинстве стран из-за проблем со здоровьем. | |
| Цинк-воздушный | 1,35–1,65 | 1,59 [1] | В основном используется в слуховых аппаратах. |
| Оксид серебра (серебро-цинк) | 1,55 | 0,47 | Очень дорого. Коммерчески используется только в кнопочных ячейках. |
Химический состав аккумуляторных батарей
| NiCd | 1,2 | >0,14 | Недорого.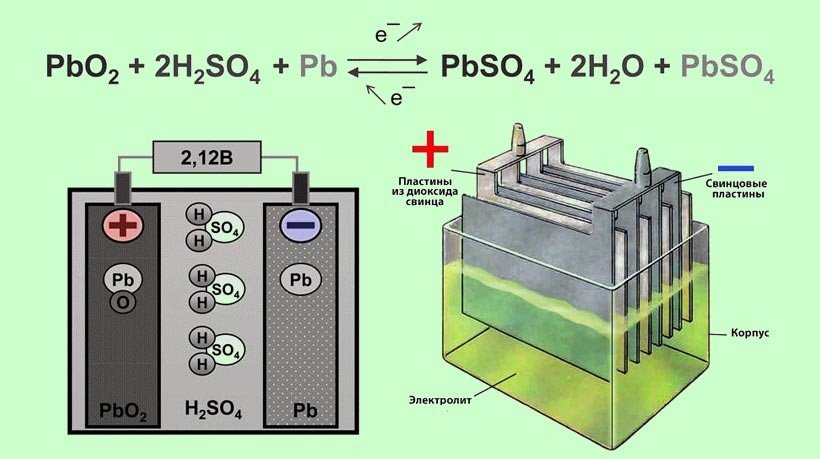 Высокий/низкий расход, умеренная плотность энергии. Может выдерживать очень высокие скорости разряда практически без потери емкости. Умеренная скорость саморазряда. Считается, что он страдает от эффекта памяти (который, как утверждается, вызывает преждевременный отказ). Опасность для окружающей среды из-за кадмия — использование в настоящее время практически запрещено в Европе. |
| Свинцово-кислотный | 2,2 | >0,14 | Умеренно дорого. Умеренная плотность энергии. Умеренная скорость саморазряда. Более высокая скорость разряда приводит к значительной потере емкости. Не подвержен эффекту памяти. Опасность для окружающей среды из-за свинца. Общего назначения — Автомобильные аккумуляторы |
| NiMH | 1,2 | >0,36 | Дешево. Не используется в устройствах с большим расходом. Традиционная химия имеет высокую плотность энергии, но также и высокую скорость саморазряда. Более новая химия имеет низкую скорость саморазряда, но также и плотность энергии на ~25% ниже. Очень тяжелый. Используется в некоторых автомобилях. |
| Литий-ионный | 3,6 | >0,46 | Очень дорого. Очень высокая плотность энергии. Обычно не поставляется с батареями «обычного» размера (но см. RCR-V3 для контрпримера). Очень часто встречается в портативных компьютерах, цифровых фотоаппаратах и видеокамерах среднего и высокого класса, а также в мобильных телефонах. Очень низкий уровень саморазряда. Летучее: возможен взрыв при коротком замыкании, перегреве или несоблюдении строгих стандартов качества. |
| Оксид лития-кобальта (LiCoO2) | 3,6 | >0,72 | Высокая удельная энергия.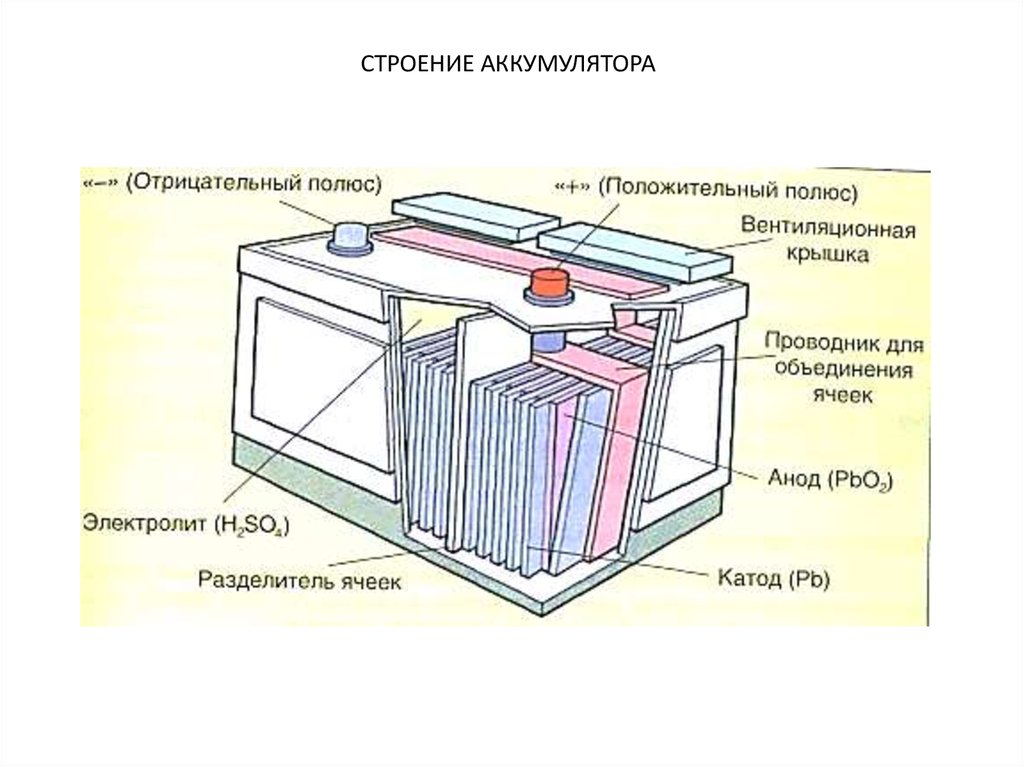 Относительно короткий срок службы, Низкая термическая стабильность и ограниченные возможности нагрузки (удельная мощность). Не следует заряжать и разряжать током выше его C-рейтинга |
| Литий-железо-фосфат (LiFePO4) | 3,3 | >0,32 | Хорошие электрохимические характеристики при низком сопротивлении. Высокий ток разряда. Низкая температура снижает производительность, а повышенная температура хранения сокращает срок службы. Ограниченный «C-рейтинг» около 1C, что означает, что они долго заряжаются. Отличная безопасность и долгий срок службы. Умеренная удельная энергия и повышенный саморазряд. |
| Литий Никель Марганец Оксид кобальта (LiNiMnCoO2) | 3,7 | >0,54 | C-rate» этой химии может варьироваться от 1 до 5C. Более высокая плотность энергии при меньших затратах, длительный срок службы. Могут иметь либо высокую удельную энергию, либо высокую удельную мощность, однако не могут обладать обоими свойствами. Очень низкая скорость самонагрева. |
| Литий-оксид марганца (LiMn2O4) | 3,8 | >0,36 | Высокая термическая стабильность и повышенная безопасность, но циклический и календарный срок службы ограничены. Низкое внутреннее сопротивление элемента обеспечивает быструю зарядку и сильноточный разряд. Можно разряжать токами 20-30А с умеренным тепловыделением. |
| Титанат лития (Li2TiO3) | 2,4 | >0,23 | Дорого. Отличается безопасностью и низкотемпературными характеристиками. Длительный срок службы: > 3000-7000 циклов. Может быть быстро заряжен и обеспечивает высокий разрядный ток 10C. Говорят, что количество циклов выше, чем у обычного литий-ионного аккумулятора. Термическая стабильность при высоких температурах также лучше, чем у других литий-ионных систем. |
Типичная удельная энергия аккумуляторов на основе свинца, никеля и лития
LFP — литий-фосфат железа
LCO — литий-кобальт-оксид
LMO — литий-оксид магния
NMC — литий-никель-марганец-окись кобальта
LTO — титанат лития
Празднование 70-летия совершенствования производства
Подробнее →Старейший в Америке.



