Принцип работы автомобильного катализатора, для чего нужен
Содержание
- Принцип работы катализатора и схема устройства
- Краткая справка по применяемым в катализаторах драгметаллов
- Практическое применение катализатора на автомобиле
Из курса химии известно о существовании веществ, ускоряющих или вызывающих процесс химической реакции, при этом не участвующие в составе веществ этой реакции. Медь, никель, золото, палладий, родий, хром – это еще не самый полный перечень веществ, ускоряющих процесс химической реакции, но именно они применяются при производстве катализаторов для автомобилей. Катализаторы автомобильные основаны на способности веществ-катализаторов к ускорению реакции горения бензина, который поступает из цилиндров двигателя из-за неполной его реализации.
Принцип работы катализатора и схема устройства
Работа автомобильного катализатора основана на применении веществ, ускоряющих горение нереализованного топлива в цилиндрах, тем самым, снижая до минимума выделение вредных веществ в атмосферу.
Огромное количество машин использует двигатель внутреннего сгорания, выхлоп которых представляет токсичные газы: оксид азота, монооксид углерода и несгорающие компоненты топлива. В целях сохранения экологически чистого воздуха в окружающей среде ученые разработали устройство, способное за 0,1 секунды выделить в токсичном газе вредные вещества и нейтрализовать их, не создавая при этом разрушительных воздействий двигателю. Катализатор (или каталитический конвертор, или нейтрализатор) переработав токсичные газы выделяет пары воды и кислород, углекислый газ.
Чтобы понять, как работает катализатор, необходимо увидеть его структуру внутри корпуса. Если разрезать верхнюю часть корпуса катализатора, то под нержавеющей крышкой конструкция представит собой два керамических блока, каждая из которых состоит из большого количества каналов (от 1000 до 3000).
С торцов блоки покрыты драгоценным металлом. Платина и родий на первом блоке, платина и палладий на втором, при этом первый является восстанавливающим, уменьшающим выбросы оксида азота, а второй окислительный. Окислительный катализатор (блок) уменьшает количество несгоревшего топлива и окиси углерода. Процесс происходит при высоких температурах, достигающих 750 градусов по шкале Цельсия.
Окислительный катализатор (блок) уменьшает количество несгоревшего топлива и окиси углерода. Процесс происходит при высоких температурах, достигающих 750 градусов по шкале Цельсия.
Совместное использование драгметаллов обеспечивают реагирование с токсичными газами и производить на выходе из глушителя автомобиля безопасные продукты горения. Используемые драгметаллы (платина, родий, палладий) не подаются коррозии, но по ценовой политике – это самые дорогие материалы, используемые в катализаторах. В среднем, производителям катализаторов драгметаллы обходятся за 1 кг в 50000 долларов, но цена окупается прежде всего получением экологически чистых газов на выхлопе.
Чтобы максимально увеличить поверхность контакта металла с газами и была разработана система микроканалов, которые обеспечивают общую площадь металлов примерно равную площади футбольного поля.
Отработанный газ из цилиндров устремляется с огромной скоростью в каталитический нейтрализатор и в первую очередь проходит через соты (каналы) первого блока (восстанавливающий) платиново-родиевым покрытием. Молекулы платины, родия и оксида азота вступают в химическую реакцию. Эти металлы притягивают к себе молекулы кислорода, а свободные атомы азота взаимодействуют между собой. Результат – оксид азота превращается в кислород и азот, которые вместе составляют 99% того газа чем мы дышим.
Молекулы платины, родия и оксида азота вступают в химическую реакцию. Эти металлы притягивают к себе молекулы кислорода, а свободные атомы азота взаимодействуют между собой. Результат – оксид азота превращается в кислород и азот, которые вместе составляют 99% того газа чем мы дышим.
Далее газы поступают во второй блок (окислительный), через тысячи микроканалов, покрытых платиной и палладием. Эти драгметаллы притягивают кислород. Высокие температуры заставляют объединяться монооксиду углерода с еще одной молекулой кислорода и, в результате наступает преобразование токсичного газа в углекислый газ – газ, из которого состоит обычная питьевая газировка.
Помимо этого, еще есть молекулы негорючих веществ. Экстремально высокие температуры заставляют их рекомбинировать с молекулами кислорода. В результате, еще вырабатывается больше углекислого газа и вода.
Схема химических реакций, протекающих в блоках выглядят следующим образом:
- CH+O2 -> CO2+H2O;
- NO+CO -> N2+CO2;
- CO+O2 -> CO2;
- NO+H2 -> N2+H2O.
Таким образом, реализация в катализаторах ускорителей в виде драгметаллов позволяет получить химические реакции, нейтрализующие токсичные, вредные вещества CO, CH x и NOx с получением на выходе безвредной воды H2O, азота N2 и углекислого газа CO2.
Краткая справка по применяемым в катализаторах драгметаллов
Платина – благородный металл серебристо-белого цвета. Название платине дали испанские завоеватели Южной Америки. В связи со сходством этого металла с серебром, но очень сильной тугоплавкостью им пренебрегали и даже топили в море, отделяя от россыпи золото, вследствие этого платина с испанского языка в буквальном смысле означает пренебрежительное к серебру слово «серебришко».
Началом применения платины в катализаторах послужило открытие в 1821 немецким химиком И.В. Деберейнером способности платиновой руды протеканию и ускорению ряда химических реакций, при этом сам драгметалл не претерпевал никаких изменений.
Родий – благородный драгоценный металл группы платиноидов с ярко изумительным холодным блеском серебристо-белого цвета, дорогой по цене, очень твердый, но хрупкий.
Металл с такими характеристиками является королем бриллиантов и самоцветов, находится в одном ряду по ценности с такими металлами как серебро, золото и платина.
Родий – металл, получаемый путём переработки платины, при этом для получения 1 кг родия необходимо ее несколько тонн.
Применение родия в массовом количестве направлено в основном в автомобильной отрасли. Около 97% материала-сырья уходит на производство катализаторов — узлов выхлопной системы. Именно родий, являющийся катализатором по своей природе, способен перерабатывать выходящие из цилиндров двигателя токсичные газы.
Палладий – переходный металл серебристо-белого цвета с гранецентрированной кубической решёткой, в чистом виде довольно мягкий металл.
Палладий часто применяется как катализатор, в основном, в процессе гидрогенизации жиров и крекинге нефти и в настоящее время активно используется в производстве автомобильных катализаторов.
Практическое применение катализатора на автомобиле
Любой современный автомобиль с бензиновым и дизельным двигателем оснащается системой очистки токсичных газов — катализаторами.
Устанавливается катализатор непосредственно после приемной трубы или соединяется через разветвленные трубы к головке блока цилиндров и называется такая конструкция катколлектором. Второй способ наиболее чаще стал применяться на автомобилях, так как происходит ускоренный нагрев элементов катализатора. После катализатора на автомобилях, принадлежащих к экологическим нормам Евро-3, Евро-4 и Евро-5 устанавливается датчик кислорода, который выполняет функции диагностические. Иными словами, диагностируемый датчик кислорода выполняет контроль эффективности работы катализатора и в случае превышения норм выхлопа загорается на панели приборов ошибка, сообщающая о критической работе катализатора. В этом случае необходимо проверить параметры работы двигателя и установить причину превышения норм допустимого выхлопа токсичных газов.
Ресурс катализатора составляет ориентировочно от 100000 до 200000 километров пробега, но если двигатель на этом этапе работал без пропусков воспламенения в цилиндрах или их было незначительное число раз, то функционирование достигает и до 500000 км.
Как уберечь катализатор от повреждений и раннего износа?
Для этого необходимо знать причины, вызывающие ранний износ или его повреждение. Прежде всего необходимо обращать внимание к качеству заливаемого в бензобак топлива. В случае некачественного топлива, насыщенного искусственно ферритами, марганцем и другими инородными веществами, включая водяной конденсат, происходит засорение микроканалов, что приводит к противодавлению в выхлопной системе. Обратный отскок выхлопных газов значительно нарушает работу газораспределительного механизма и в силу поступления в впускной тракт горячих отработанных газов усиливает износ поршневой группы и клапанов. Такое явление на некоторых типах автомобилей учитывается и устанавливается специальное устройство, называемое рециркулятором.
В бензиновых двигателях может быть внутренняя система рециркуляции и внешняя. Внутренняя система проектируется таким образом, чтобы выпускной клапан оставался некоторое время открытым в то время, когда уже открылся впускной клапан. Такое положение клапанов называют «перекрытием», обеспечивающей внутреннюю рециркуляцию газов и не требующей дополнительных компонентов. Внешняя работает с дополнительным компонентом, называемым клапан рециркуляции (EGR).
Благодаря системе рециркуляции отработанные газы, попадающие обратно во впускную систему, охлаждаются, что снижает расход топлива и количество вредных веществ, выбрасываемых в атмосферу.
Следующим фактором, влияющим на износ катализатора, является неисправность двигателя. Несбалансированная работа двигателя влечет к изменению топливоподачи. Топливо в значительном количестве начинает поступать в катализатор, забивая микроканалы и эффективность его резко падает. И, наоборот, если в систему поступает слишком мало топлива, бедная смесь, то катализатор начинает сильно греться, вызывая очень высокую температуру (выше 800 градусов), вследствие чего элементы с драгметаллом начинают плавиться. И в том, и в другом случае дорогостоящий катализатор подлежит замене, так как ремонту он не пригоден.
И в том, и в другом случае дорогостоящий катализатор подлежит замене, так как ремонту он не пригоден.
Механические удары также могут быть причиной раннего износа катализатора, так как в образовавшуюся трещину начинает поступать воздух вызывая перегрев и проникновение инородных частиц, забивающих микроканалы, препятствующих прохождению отработанных газов.
Катализатор является частью выхлопной системы двигателя и соответственно его неисправность отражается на работе мотора. В основном неисправность катализатора выражается в его разрушении (на основе керамики) или оплавлении (на металлической основе), а также в засорении микроканалов. Если катализатор начал плохо пропускать отработанные газы, то это отразится на работе двигателя:
- трудный продолжительный запуск;
- заводится и глохнет;
- падает тяговая характеристика;
- увеличивается расход топлива;
- возникает неприятный запах, напоминающий сероводород;
- при разгоне возникают провалы;
- горит аварийная лампа неисправности двигателя.

Принцип работы катализатора в автомобиле
Выпускная система
На чтение 3 мин. Просмотров 1.4k.
Большинство автолюбителей даже не имеют представление о том, что такое автомобильный катализатор и в чем заключается принцип его работы. Именно поэтому сегодня мы попытаемся рассказать что это такое катализатор автомобильный.
Машины являются одним из самых крупных источников загрязнений атмосферы, так как они выбрасывают в атмосферу около 15 000 химических соединений, к которым относится газ и пыль. Компании по производству автомобилей постоянно стараются уменьшить количество вредных выбросов, именно это и привело к созданию автомобильного каталитического нейтрализатора системы выхлопа или как его еще называют катализатор.
Катализатор входит в состав выхлопной системы автомобиля и предназначается для понижения уровня выбросов вредоносных веществ вместе с продуктами горения.
Катализатор автомобильныйВ представленной статье мы более подробно поговорим о катализаторе, а именно обсудим такие вопросы:
- Что такое автомобильный катализатор?
- Конструкция автомобильного катализатора;
- В чем заключается принцип работы?
- Распространенные поломки каталитического нейтрализатора, при которых необходима его полная замена;
- Признаки неисправности, указывающие на то, что необходима замена;
- Как правильно проводится замена каталитического нейтрализатора выхлопной системы?
Большинство автолюбителей даже не имеют представления о том, что такое автомобильный катализатор и в чем заключается принцип его работы. Именно поэтому сегодня мы попытаемся рассказать основную информацию о каталитическом нейтрализаторе. Итак, автомобильный нейтрализатор это элемент выхлопной системы транспортного средства, снижающий температуру выхлопных газов, очищающий выхлопные газы и обеспечивающий догорание топливной смеси.
Именно поэтому сегодня мы попытаемся рассказать основную информацию о каталитическом нейтрализаторе. Итак, автомобильный нейтрализатор это элемент выхлопной системы транспортного средства, снижающий температуру выхлопных газов, очищающий выхлопные газы и обеспечивающий догорание топливной смеси.
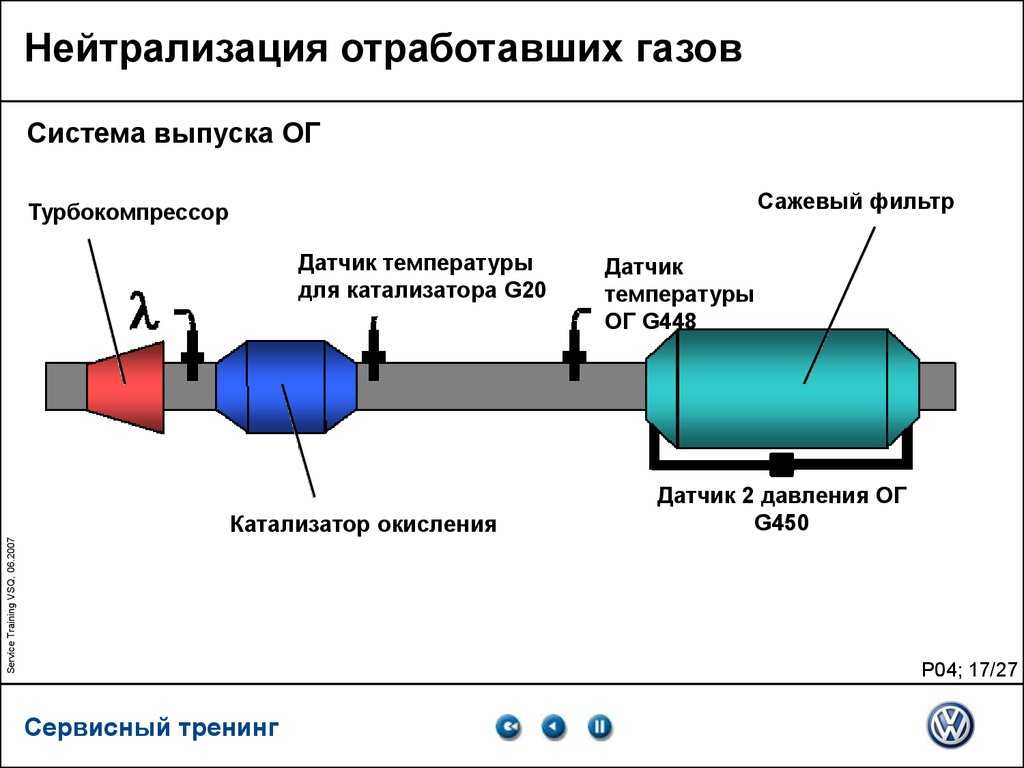
Схема катализатора автомобильногоКаталитический нейтрализатор используется на бензиновых и дизельных двигателях автомобиля. Представленное устройство чаще всего располагается за коллектором выпускной системы или же перед глушителями.
Основными элементами катализатора являются: теплоизоляция, корпус и блок-носитель. На сегодняшний момент существует несколько видов нейтрализаторов, которые соответствуют разному содержанию выхлопных газов в автомобильном двигателе.
К основным типам автомобильного катализатора выхлопной системы относятся: восстановительный, окислительный и окислительно-восстановительный.
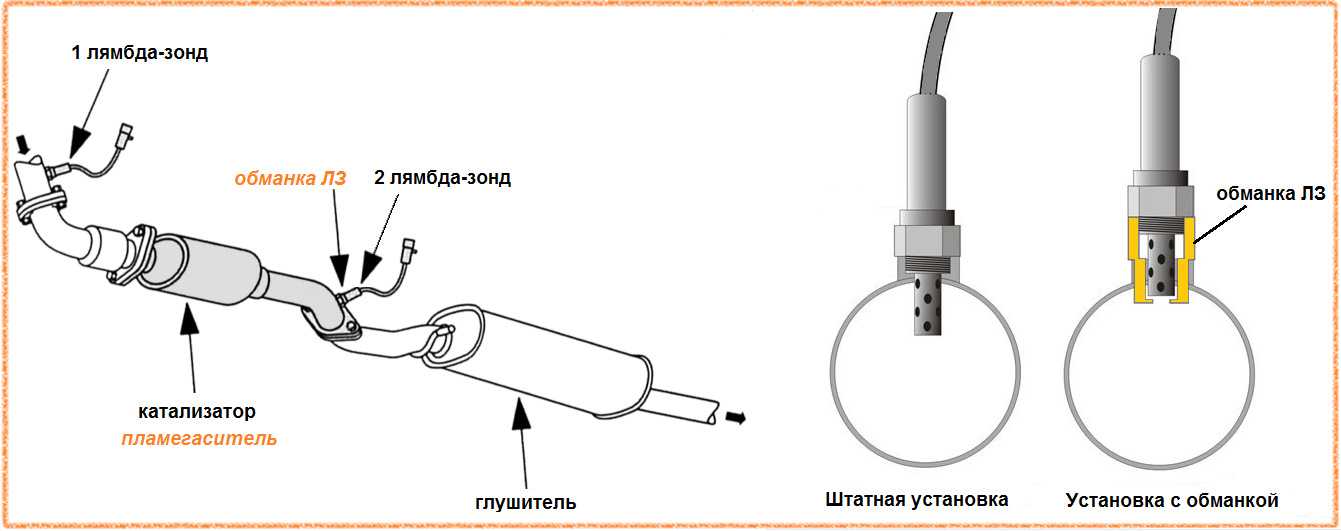
Для правильной замены каталитического нейтрализатора должны соблюдаться некие условия, для соблюдения этих условий применяется лямбда-зонд. Благодаря данному устройству посылается обновленная информация и регулируется состав топливной смеси.
Благодаря данному устройству посылается обновленная информация и регулируется состав топливной смеси.
Признаки неисправности, указывающие на то, что необходима замена
При нормальном функционировании катализатор ломается только после полного сгорания каталитического слоя. Такое формулирование даже не совсем правильно, так как он не ломается, а просто из-за уменьшения каталитического слоя он не может полностью сжигать выхлопные газы. То есть эффективность работы уменьшается, а токсичность продуктов горения повышается. Автомобильный катализатор достаточно редко выходит из строя, но все же каждый автолюбитель должен знать, как поступать в таком случае. Поэтому давайте рассмотрим, как проводится самостоятельная замена каталитического нейтрализатора.
Для начала давайте рассмотрим основные признаки неисправности каталитического нейтрализатора выхлопной системы:
- Снизилась мощность автомобиля, это свидетельствует о том, что нейтрализатор забит.

- Во время передвижения транспортного средства на холостых оборотах двигателя заметно плаванье стрелочки тахометра.
- И выхлопной трубки чувствуется запах аммиака.
Итак, как же правильно проводится замена катализатора?
- Открутите болтики, закрепляющие устройство на дополнительном глушителе;
- Снимите болтики вместе с шайбой;
- Открутите болтики, которые закрепляют устройство на приемной трубке;
- Достаньте болтики вместе с пружинными шайбами;
- Достаньте устройство под днищем автомобиля;
- ПРоведите замену и соберите все в обратном порядке.
Как видите, замена катализатора системы выхлопа довольно проста и с ней сможет справиться даже не очень опытный автолюбитель. Обратите внимание на то, что в момент функционирования он может нагреваться до температуры около 600 градусов. Поэтому прежде чем перейти к замене катализатора дождитесь полного его охлаждения.
Что такое катализ?
от azoHAaccnt | 26 февраля 2018 г. | Блог
| Блог
Катализ — это процесс модификации химической реакции с использованием катализатора. Этот процесс работает только с химическими веществами, у которых уже есть реакция, и используется для ускорения реакции в коммерческих целях. Катализ происходит быстрее, чем стандартная химическая реакция, потому что катализаторы требуют меньше энергии активации, которая представляет собой минимальный уровень энергии, необходимый для инициирования химической реакции.
В этом сообщении в блоге будут изложены принципы катализа и его различные типы.
Принцип работы катализатора
Когда химическое вещество помещается с совместимым катализатором, уменьшается свободная энергия, необходимая химическому веществу для достижения переходного состояния для данной конкретной реакции. Катализаторы могут влиять на реакционную среду в зависимости от конкретных требований реакции.
Например, катализаторы могут выделять больше тепла, образовывать специфические промежуточные соединения, которые не образуются естественным путем, связывать реагенты для поляризации связей или вызывать диссоциацию реакций обратно в их реактивные формы.
Типы катализаторов
Существует два основных типа катализаторов, используемых для катализа; гетерогенный или гомогенный. Гетерогенный катализатор имеет молекулы, которые не находятся в той же фазе, что и реагенты, тогда как молекулы гомогенного катализатора находятся в той же фазе, что и реагенты.
Если вы хотите узнать больше о процессах, связанных с исследованиями катализа, прочитайте нашу статью: Что такое TPR?
Обычно гетерогенный катализатор является твердым, тогда как реагенты являются газообразными или жидкими. Реагенты адсорбируются на активных центрах поверхности гетерогенного катализатора, и происходит взаимодействие. Это взаимодействие заставляет молекулы становиться более реактивными.
Электрокатализатор представляет собой гетерогенный катализатор, который используется специально в разработке топливных элементов для улучшения свойств и работы топливных элементов.
Гомогенные катализаторы находятся в той же фазе, что и реагент, обычно газ или жидкость. К этому типу катализаторов обычно применяются принципы гетерогенного катализатора.
К этому типу катализаторов обычно применяются принципы гетерогенного катализатора.
Органокатализ — это форма катализа, которая может осуществляться с использованием гомогенного катализатора. Органокатализ — это изучение органических катализаторов, представляющих собой небольшие органические молекулы.
Подробнее: Инструменты для исследования катализа
Катализ в Hiden Analytical
Компания Hiden Analytical имеет более чем 30-летний опыт проектирования, разработки и производства масс-спектрометров для специализированного мониторинга технологических процессов и передовых исследовательских приложений.
У нас есть ряд продуктов, подходящих для анализа катализа, в том числе наш CATLAB-PCS, который обеспечивает полностью автоматизированные и точные исследования химии активной поверхности, возможность оптимизировать каталитическую активность и быстрый динамический скрининг.
Метод дифференциальной электрохимической масс-спектрометрии DEMS идеально подходит для анализа активности электрокатализаторов. Система Hiden HPR-40 DEMS предназначена для дифференциальной электрохимической масс-спектрометрии. Система включает ячейки DEMS, разработанные в сотрудничестве с Национальной лабораторией Лоуренса в Беркли, Калифорния, США.
Система Hiden HPR-40 DEMS предназначена для дифференциальной электрохимической масс-спектрометрии. Система включает ячейки DEMS, разработанные в сотрудничестве с Национальной лабораторией Лоуренса в Беркли, Калифорния, США.
Если вам нужна дополнительная информация о продуктах Hiden Analytical для исследования и анализа катализа, отправьте нам сообщение.
3.1: Общие принципы катализа
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 20281
Как видно из уравнения Аррениуса, величина энергии активации \(E_a\) определяет значение константы скорости \(k\) при данной температуре и, таким образом, общую скорость реакции. Катализаторы позволяют снизить \(E_a\) и увеличить скорость реакции. Катализаторы определяются как вещества, которые участвуют в химической реакции, но не изменяются и не расходуются. Вместо этого они обеспечивают новый механизм протекания реакции, который имеет более низкую энергию активации, чем реакция без катализатора. Гомогенный катализ относится к реакциям, в которых катализатор находится в растворе по крайней мере с одним из реагентов, тогда как гетерогенный катализ относится к реакциям, в которых катализатор присутствует в другой фазе, обычно в виде твердого вещества, чем реагенты. На рисунке \(\PageIndex{1}\) показано сравнение энергетических профилей реакции в отсутствие и в присутствии катализатора.
Катализаторы определяются как вещества, которые участвуют в химической реакции, но не изменяются и не расходуются. Вместо этого они обеспечивают новый механизм протекания реакции, который имеет более низкую энергию активации, чем реакция без катализатора. Гомогенный катализ относится к реакциям, в которых катализатор находится в растворе по крайней мере с одним из реагентов, тогда как гетерогенный катализ относится к реакциям, в которых катализатор присутствует в другой фазе, обычно в виде твердого вещества, чем реагенты. На рисунке \(\PageIndex{1}\) показано сравнение энергетических профилей реакции в отсутствие и в присутствии катализатора.
Рассмотрим некатализируемую элементарную реакцию
\[\text{A} \overset{k}{\longrightarrow} \text{P}\]
, которая протекает со скоростью \(k\) при определенной температуре. Скорость реакции может быть выражена как
\[\dfrac{d \left[ \text{A} \right]}{dt} = -k \left[ \text{A} \right] \label{Eq1}\ ]
В присутствии катализатора \(\text{C}\) мы можем записать реакцию как
\[\text{A} + \text{C} \overset{k_\text{cat}} {\longrightarrow} \text{P} + \text{C}\]
и скорость реакции как
\[\dfrac{d \left[ \text{A} \right]}{dt} = -k \left[ \text{A} \right] — k_\text{cat } \left[ \text{A} \right] \left[ \text{C} \right] \label{Eq2}\]
где первый член представляет собой некатализируемую реакцию, а второй член представляет собой каталитическую реакцию. — &\overset{k_3}{\underset{k_{-3}}{\rightleftharpoons}} \text{A}H + H_2 O \end{align}\ ] 9+ \right]}{\left[ \text{A} H \right]} \label{Eq9}\]
— &\overset{k_3}{\underset{k_{-3}}{\rightleftharpoons}} \text{A}H + H_2 O \end{align}\ ] 9+ \right]}{\left[ \text{A} H \right]} \label{Eq9}\]
В этом случае реакция катализируется ионами водорода.
Ферментный катализ
Чтобы жить, расти и размножаться, микроорганизмы претерпевают ряд химических изменений. Они изменяют питательные вещества, чтобы они могли попасть в клетку, и они меняют их, как только они входят, чтобы синтезировать части клетки и получать энергию.
Метаболизм относится ко всем организованным химическим реакциям в клетке. Реакции, в которых происходит расщепление химических соединений, называются 9.0011 катаболические реакции , тогда как реакции, в которых синтезируются химические соединения, называются анаболическими реакциями . Все эти реакции находятся под контролем ферментов.
Ферменты представляют собой вещества, присутствующие в клетке в небольших количествах и функционирующие для ускорения или катализа химических реакций . На поверхности фермента обычно имеется небольшая щель, которая функционирует как активный центр или каталитический центр, с которым могут связываться один или два специфических субстрата. (Все, с чем обычно соединяется фермент, называется субстрат .) Связывание субстрата с ферментом приводит к тому, что гибкий фермент слегка меняет свою форму в результате процесса, называемого индуцированной подгонкой , с образованием временного промежуточного продукта, называемого фермент-субстратный комплекс (рис. 1).
На поверхности фермента обычно имеется небольшая щель, которая функционирует как активный центр или каталитический центр, с которым могут связываться один или два специфических субстрата. (Все, с чем обычно соединяется фермент, называется субстрат .) Связывание субстрата с ферментом приводит к тому, что гибкий фермент слегка меняет свою форму в результате процесса, называемого индуцированной подгонкой , с образованием временного промежуточного продукта, называемого фермент-субстратный комплекс (рис. 1).

Ферменты ускоряют скорость химических реакций, потому что они снижают энергию активации, энергию, которая должна быть предоставлена для того, чтобы молекулы реагировали друг с другом (рис. \(\PageIndex{3}\)). Подобно рассмотренным выше гомогенным катализаторам, ферменты снижают энергию активации за счет образования комплекса фермент-субстрат, что позволяет образовываться и высвобождаться продуктам ферментативной реакции (рис. \(\PageIndex{2}\)).
Рисунок \(\PageIndex{3}\) : Фермент ускоряет химическую реакцию, снижая свою энергию активации, энергию, которая должна быть предоставлена для того, чтобы молекулы реагировали друг с другом.Ферментно-субстратные реакции
Ферменты – это вещества, присутствующие в клетке в небольших количествах, которые ускоряют или катализируют химические реакции. Ферменты ускоряют скорость химических реакций, потому что они снижают энергию активации, энергию, которая должна быть выделена для того, чтобы молекулы реагировали друг с другом. Ферменты снижают энергию активации, образуя фермент-субстратный комплекс.
Ферменты снижают энергию активации, образуя фермент-субстратный комплекс.
Многим ферментам требуется небелковый кофактор , чтобы помочь им в их реакции. В этом случае белковая часть фермента, называемая апофермент , соединяется с кофактором с образованием цельного фермента или галофермента (рис. \(\PageIndex{4}\)). Некоторые кофакторы представляют собой ионы, такие как Ca ++, Mg ++ и K+; другие кофакторы представляют собой органические молекулы, называемые коферментами , которые служат переносчиками химических групп или электронов. НАД + , НАДФ + , ФАД и кофермент А (КоА) являются примерами коферментов.
Рисунок \(\PageIndex{4}\) : Апофермент и кофактор объединяются, образуя галофермент. Если кофактор представляет собой органическую молекулу, он называется коферментом. Ферменты обычно представляют собой глобулярные белки. (Некоторые молекулы РНК, называемые рибозимами, также могут быть ферментами. Обычно они находятся в ядерной области клеток и катализируют расщепление молекул РНК). Ферменты — это катализаторы, которые расщепляют или синтезируют более сложные химические соединения. Они позволяют химическим реакциям происходить достаточно быстро, чтобы поддерживать жизнь. Ферменты ускоряют скорость химических реакций, потому что они снижают энергию активации, энергию, которая должна быть выделена для того, чтобы молекулы реагировали друг с другом. Все, с чем обычно связывается фермент, называется субстратом. Ферменты очень эффективны: обычно ферменты способны катализировать от 1 до 10 000 молекул субстрата в секунду. Это означает, что ферменты должны присутствовать в клетке только в небольших количествах. Они не изменяются во время своей реакции и очень специфичны для своего субстрата, причем обычно для каждой конкретной химической реакции предназначен один конкретный фермент.
Обычно они находятся в ядерной области клеток и катализируют расщепление молекул РНК). Ферменты — это катализаторы, которые расщепляют или синтезируют более сложные химические соединения. Они позволяют химическим реакциям происходить достаточно быстро, чтобы поддерживать жизнь. Ферменты ускоряют скорость химических реакций, потому что они снижают энергию активации, энергию, которая должна быть выделена для того, чтобы молекулы реагировали друг с другом. Все, с чем обычно связывается фермент, называется субстратом. Ферменты очень эффективны: обычно ферменты способны катализировать от 1 до 10 000 молекул субстрата в секунду. Это означает, что ферменты должны присутствовать в клетке только в небольших количествах. Они не изменяются во время своей реакции и очень специфичны для своего субстрата, причем обычно для каждой конкретной химической реакции предназначен один конкретный фермент.
Факторы, влияющие на скорость ферментативных реакций
На активность фермента влияет ряд факторов, включая:
- Концентрация фермента скорость реакции.
- Концентрация субстрата : При постоянной концентрации фермента и более низких концентрациях субстрата концентрация субстрата является ограничивающим фактором. С увеличением концентрации субстрата скорость ферментативной реакции увеличивается. Однако при очень высоких концентрациях субстрата ферменты насыщаются субстратом, и более высокая концентрация субстрата не увеличивает скорость реакции.
- Ингибиторы : Ингибиторы подавляют активность фермента и снижают скорость реакции. Ингибиторы ферментов будут связываться с активными центрами ферментов и могут изменять химический состав активного центра, что может препятствовать проникновению субстрата.
- Температура : Каждый фермент имеет оптимальную температуру, при которой он работает лучше всего. Более высокая температура обычно приводит к увеличению активности фермента (кинетика Аррениуса). По мере повышения температуры молекулярное движение увеличивается, что приводит к большему количеству молекулярных столкновений.
 Однако, если температура поднимается выше определенной точки, тепло денатурирует фермент, заставляя его терять свою трехмерную функциональную форму из-за денатурации его водородных связей. Холодная температура, с другой стороны, замедляет активность ферментов за счет уменьшения молекулярного движения.
Однако, если температура поднимается выше определенной точки, тепло денатурирует фермент, заставляя его терять свою трехмерную функциональную форму из-за денатурации его водородных связей. Холодная температура, с другой стороны, замедляет активность ферментов за счет уменьшения молекулярного движения. - pH : Каждый фермент имеет оптимальный pH, который помогает поддерживать его трехмерную форму. Изменения pH могут денатурировать ферменты, изменяя заряд фермента. Это изменяет ионные связи фермента, которые способствуют его функциональной форме.
- Концентрация соли : Каждый фермент имеет оптимальную концентрацию соли. Изменения концентрации соли также могут денатурировать ферменты.
Применение ферментов
Ферменты необходимы для поддержания гомеостаза, поскольку любой сбой фермента может привести к заболеванию. Поэтому фармацевтические компании изучают ферменты для управления и синтеза новых лекарств.
