Как разбавить спирт водой в домашних условиях
Часто возникают споры как правильно разбавлять спирт, что и куда правильнее добавлять спирт в воду или воду в спирт? Ответ очень простой – без разницы, что с чем смешивать, если речь идет о 3-х литровой банке, а перемешивают ложкой или встряхиванием, при условии, что и спирт и вода чистые, т.е. в спирте нет голов/хвостов, а в воде низкое содержание минералов (менее 500мг/л). НО есть и нюансы, о которых речь пойдет дальше.
По химическим правилам, лить нужно более тяжелую жидкость в более лёгкую, особенно актуально при работе с кислотами. Получается воду надо лить в спирт. На ликеро-водочных заводах так и смешивают. К тому же не происходит падения концентрации спирта ниже допустимой.
При добавлении спирта в воду, если спирт или вода недостаточно чистые, возможно, но не обязательно, выпадение нерастворимого осадка в большем количестве, раствор может стать слегка мутноватый.
При смешивании холодного спирта с холодной водой (комнатной температуры и ниже), первое время раствор будет жесткий на вкус. Потребуется пару дней (в идеале неделю) выдержки при комнатной температуре, чтобы раствор стал более питкий. Чтобы ускорить этот процесс можно холодный спирт разбавить кипятком и добавить кусочек сахара для ускорения контракции. Имейте в виду, что спирт из горячего раствора испаряется. В идеале нагреть холодный раствор до 70°С и дать ему постоять пару дней в закрытом виде.
Часто рекомендуют разбавлять спирт кипяченой водой, но это исключительно дело вкуса. Если вы замечаете разницу между кипяченой и сырой водой, используйте ту, которая больше нравится, в разбавленном спирте вкус воды так же будет чувствоваться. Я лично предпочитаю родниковую воду.
При разбавлении раствор немного нагревается, не зависимо от того будете вы добавлять спирт в воду или наоборот. Поэтому спиртометр может показать большее содержание спирта. Мерить надо при 20°С, как в инструкции!
Поэтому спиртометр может показать большее содержание спирта. Мерить надо при 20°С, как в инструкции!
Существует альтернативный вариант – поочередное употребление воды и спирта из разных стаканов. Последовательность и количество подбирается индивидуально, исходя из вкусовых предпочтений.
Как разбавить спирт до 40% или градусов
В домашних условиях самое простое — это воспользоваться пропорцией 2:3, например на 1л 96% спирта добавить 1,5л воды. Смешайте в той очередности, которая вам больше нравится. Если трубы не горят дайте постоять раствору пару дней или же воспользуйтесь рекомендациями выше.
После разбавления спирта водой получается так называемая сортировка, это не водка, а спирт с водой, без характерного водочного вкуса и запаха! Чтобы сделать из сортировки водку нужна уксусная кислота и эфир. Сортировку пропускают через активированный уголь, в процессе окисления образуется уксусный альдегид, который в свою очередь окисляется до уксусной кислоты, которая с этанолом образует уксусно-этиловый эфир.
В простонародье еще говорят разбавить сприт до 40 оборотов. Что такое обороты в спиртовом растворе? Это не те обороты которые нужны для перемешивания раствора ложкой, а заблуждение взятое из неверного толкования обозначения содержания спирта, например «40%об.». Сокращение «об.» обозначает не обороты, а объем, то есть при разбавлении учитывался объем, а не масса жидкости.
Калькулятор разбавления спирта водой
Загрузка…Или воспользуйтесь таблицей Фертмана ниже, она точнее на некоторых значениях, промежуточные значения проще и точнее посчитать на онлайн калькуляторе выше.
| Было | Стало / Количество воды на 1000мл | ||||||||||||
| 90% | 85% | 80% | 75% | 70% | 65% | 60% | 55% | 50% | 45% | 40% | 35% | 30% | |
| 95% | 64 | 133 | 209 | 295 | 391 | 501 | 629 | 779 | 957 | 1174 | 1443 | 1785 | 2239 |
| 90% | – | 65 | 138 | 218 | 310 | 414 | 535 | 677 | 847 | 1052 | 1306 | 1630 | 2061 |
| 85% | – | – | 68 | 144 | 231 | 329 | 443 | 578 | 738 | 932 | 1172 | 1478 | 1884 |
| 80% | – | – | – | 72 | 153 | 246 | 353 | 480 | 630 | 812 | 1039 | 1327 | 1709 |
| 75% | – | – | – | – | 76 | 163 | 264 | 382 | 523 | 694 | 906 | 1177 | 1535 |
| 70% | – | – | – | – | – | 81 | 175 | 285 | 417 | 577 | 774 | 1027 | 1360 |
| 65% | – | – | – | – | – | – | 88 | 190 | 311 | 460 | 644 | 878 | 1189 |
| 60% | – | – | – | – | – | – | – | 95 | 207 | 344 | 514 | 730 | 1017 |
| 55% | – | – | – | – | – | – | – | 103 | 229 | 384 | 583 | 845 | |
| 50% | – | – | – | – | – | – | – | – | – | 114 | 255 | 436 | 674 |
| 45% | – | – | – | – | – | – | – | – | – | – | 127 | 290 | 505 |
| 40% | – | – | – | – | – | – | – | – | – | – | – | 144 | 335 |
| 35% | – | – | – | – | – | – | – | – | – | – | – | – | 167 |
Таблица Фертмана
Какое отношение имеет Менделеев к водке?
Никакого. Менделеев изучал механизм образования гидратов этанола, выяснял почему при смешивании двух одинаковых объемов воды и спирта, общий объем получался меньше. Т.е. при смешивании 1л воды и 1л спирта общий объем был меньше 2л. Этому он посвятил свою диссертацию и никаких указаний что куда лить он не оставил. Ни какой водкой, как самостоятельным напитком, он не занимался. Миф о водке Менделеева это заслуга Похлебкина.
Менделеев изучал механизм образования гидратов этанола, выяснял почему при смешивании двух одинаковых объемов воды и спирта, общий объем получался меньше. Т.е. при смешивании 1л воды и 1л спирта общий объем был меньше 2л. Этому он посвятил свою диссертацию и никаких указаний что куда лить он не оставил. Ни какой водкой, как самостоятельным напитком, он не занимался. Миф о водке Менделеева это заслуга Похлебкина.
Как развести спирт, чтобы получить водку
Казалось бы, что может быть проще, чем из спирта сделать жидкость, пригодную для питья. То есть разбавить до рекомендованных Минздравом 40 градусов.
Не забываем, что из этилового спирта можно также сделать антисептик для рук, что сейчас крайне актуально.
Как же правильно развести спирт с водой, чтобы получился напиток, готовый к употреблению?
Для начала нам нужен:
- Пищевой или медицинский спирт, крепостью 96%.
 Берем, естественно, этиловый спирт, который пригоден для употребления внутрь. Как вы знаете, есть еще метиловый (технический) спирт, который является ядом. У него совсем другие задачи и его брать не надо. Даже даром.
Берем, естественно, этиловый спирт, который пригоден для употребления внутрь. Как вы знаете, есть еще метиловый (технический) спирт, который является ядом. У него совсем другие задачи и его брать не надо. Даже даром.
Есть, конечно, методики, позволяющие отличить этиловый спирт от технического (метилового), но все они не дают 100% гарантии, поэтому самое надежное — покупать (брать) спирт в надежном месте. - Очищенная вода , можно бутилированная, а лучше дистиллированная. Вода из под крана, так же как и кипяченая не подходит, так как она жесткая, то есть имеет много растворенных солей. Это будет отражаться на вкусе нашего напитка и, к тому же, такая вода может помутнеть в процессе приготовления водки.
- Мерная емкость
Приготовление чистой водки крепостью 40 градусов без добавок.
Возьмем для примера 500 мл 96% спирта. На это количество необходимо 700 мл. воды. Если у вас другое количество спирта, то и воды берем соответственно меньше или больше, что была бы соблюдена пропорция.
При желании получить водку другой крепости или, если у вас спирт не стандартный 96% -й, то необходимо воспользоваться специальными калькуляторами онлайн или соответствующими таблицами для вычисления необходимых пропорций.
Количество воды указано на 100 частей спирта. Например, для приготовления 40 градусного напитка из 95% спирта необходимо взять 144,4 мл воды и 100 мл спирта.
Наливаем сначала воду в емкость, в которой будем разводить наш волшебный раствор. Вода не должна быть теплой. Лучше всего, если она будет не просто комнатной температуры, а охлажденной.
Важно: необходимо спирт лить в воду, а не наоборот. Иначе вы рискуете получить мутный раствор, мало похожий на настоящую водку.
Затем перемешиваем или взбалтываем.
Наливаем в емкость для хранения и плотно закрываем.
Даем отстояться несколько дней. (ну или, хотя бы, несколько часов).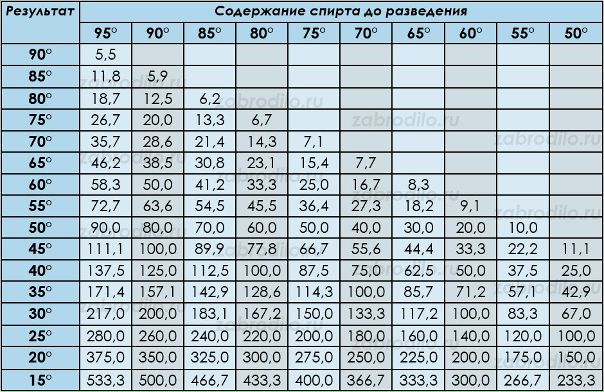
Все чистая водка без добавок готова. Но чтобы пить было приятней и вкусней, используются определенные ингредиенты, которые добавляются на этапе смешивания.
Поэтому, второй рецепт:
Приготовление водки, как в магазине и даже лучше крепостью 40 градусов
В этом случае нам понадобятся:
- Спирт и вода, как в предыдущем случае
- Глюкоза (можно купить в аптеке)
- Мед, лимонную кислоту, лимонный или апельсиновый сок – по желанию и на выбор
- Активированный уголь, 10 таблеток.
Опять будем исходить из того, что у нас в наличии для этого дела есть 500 мл 96% спирта
Порядок приготовления следующий.
- Наливаем в емкость 700 мл. воды и добавляем примерно 20 мл. глюкозы, мед, апельсиновый сок, как говориться «по вкусу». Да и с количеством глюкозы можно экспериментировать.
- Все тщательно перемешиваем и после этого добавляем спирт. Не забывайте, что вода и остальные составляющие должны быть охлаждены хотя бы до комнатной температуры.

- Добавляем активированный уголь (таблетки лучше растолочь в порошок), перемешиваем и даем постоять от несколько часов до суток (чем больше, тем лучше).
- После этого фильтруем через марлю с ватой или вату, вставленную в лейку. Любым способом, чтобы на выходе была чистая прозрачная жидкость.
- Разливаем в емкость для хранения под самое горлышко и плотно закрываем.
- Даем отстояться несколько дней.
Все! После этого можно употреблять, соблюдая меру и приличия.
загрузка…
А также…
с водой в домашних условиях
Привет друзья! В сегодняшней статье будем говорить о том, как разводить спирт с водой в домашних условиях. И не только до 40 градусов, а до любой необходимой крепости. Я расскажу вам, как правильно подобрать пропорции и какую воду выбрать. Также покажу, как приготовить водку. На первый взгляд всё просто, но если не соблюдать технологию смешивания можно получить мутную, некрасивую жидкость.
Идея написания этой статьи зрела уже давно. Я ведь постоянно в своих рецептах пишу, что вместо водки можно использовать разбавленный спирт, но как правильно его развести например до 70 градусов знают не все. Если вы являетесь счастливцем, у которого есть доступ к качественному спирту, то эта статья для вас. Кстати, где вы его берете? Расскажите в комментариях.
Я ведь постоянно в своих рецептах пишу, что вместо водки можно использовать разбавленный спирт, но как правильно его развести например до 70 градусов знают не все. Если вы являетесь счастливцем, у которого есть доступ к качественному спирту, то эта статья для вас. Кстати, где вы его берете? Расскажите в комментариях.
Какой должен быть спирт
О том, какие бывают спирты рассказано в отдельной статье. Здесь же не будем на этом заострять внимание. Я просто скажу, что он должен быть естественно питьевым, качественным и из проверенных источников. А также абсолютно прозрачным и без посторонних запахов.
Какую воду использовать
Качество применяемой воды не менее важно, чем качество спирта. Ну ладно, загнул. Скажем чуть менее, но тоже очень и очень важно. Думаю излишне говорить, что вода должна быть питьевой, чистой и прозрачной, поэтому перейдем к менее очевидным вещам.
Основным показателем воды для нас является жесткость. Жесткость это количество в воде кальция (Ca) и магния (Mg). Измеряется она в мг-экв/л. Для разбавления необходимо использовать воду с наименьшими показателями жесткости, иными словами мягкую воду. Иначе раствор помутнеет, да и потеряет во вкусовом качестве.
Измеряется она в мг-экв/л. Для разбавления необходимо использовать воду с наименьшими показателями жесткости, иными словами мягкую воду. Иначе раствор помутнеет, да и потеряет во вкусовом качестве.
Итак, какой должна быть жесткость? Согласно изданию “Технология спиртового и ликеро-водочного производства” (М. “Пищевая промышленность”, 1973г.) для приготовления ликеро-водочных изделий должна использоваться вода с жесткостью менее 1 мг-экв/л для естественной воды и менее 0,36 мг-экв/л для умягченной воды. Мы будем использовать естественную воду, поэтому ориентируемся на 1 мг-экв/л.
Как же узнать, какая жесткость у вашей воды, спросите вы? Сейчас расскажу, но давайте сперва рассмотрим варианты, какой водой мы можем воспользоваться.
Водопроводная вода
Самый худший вариант. Жесткость такой может достигать 7 мг-экв/л. К тому же в ней содержится хлорка, которая имеет свой ярко выраженный запах. Такой водой я не рекомендую пользоваться, но если вы все же решитесь, то над ней необходимо произвести кое-какие манипуляции.
Для начала дайте воде отстояться 3-4 часа, чтобы испарилась хлорка. Затем воду прокипятите и дайте ей остыть. После кипячения пропустите через бытовой фильтр-кувшин для воды. Сейчас их в продаже полно и они хорошо справляются с очисткой воды. После этих процедур вода готова к применению.
Родниковая вода
На большинстве сайтов в Интернете рекомендуют именно такую воду, но я бы не был столь категоричен. Тут не все так просто. Как правило, родниковая вода очень вкусна, но нельзя определить ее состав и жесткость без специального анализа. К тому же ее показатели могут сильно меняться от времени года, обильных дождей или засухи.
Поэтому рекомендовать такую воду я не могу. Если у вас есть рядом родник или колодец, то можете попробовать использовать эту воду для приготовления небольшого количества смеси и посмотреть что получится. Если она не помутнеет и ее вкус вас устроит, то вода из этого родника пригодна для использования.
Покупная бутилированная вода
Это, на мой взгляд, самый лучший из вариантов. На покупных бутылка пишут химический состав и жесткость, поэтому нам остается только подобрать подходящую для наших целей воду.
На покупных бутылка пишут химический состав и жесткость, поэтому нам остается только подобрать подходящую для наших целей воду.
Это, как я уже говорил, вода с жесткостью 1 мг-экв/л и ниже. Такой в продаже полно. Я даже видел воду с жесткостью 0,05 мг-экв/л. Бывает так, что на бутылке не указана общая жесткость. Тогда следует ориентироваться на содержание Ca и Mg. Желательно, что бы кальция было меньше 10 мг/л, а магния – меньше 8 мг/л. По крайней мере у моей воды такие показатели.
Дистиллированная вода
Казалось бы, что может быть лучше очищенной от всех примесей воды для разбавления спирта? Такая вода точно не помутнеет. Но и тут не все так просто. Всё будет зависеть от того, для чего вы собираетесь использовать полученную смесь.
Если для дальнейшего приготовления какой-нибудь настойки, например Перцовки или Кедровки, вкус которой определяют в первую очередь входящие в нее ингредиенты, то дистиллированная вода подойдет отлично. Ведь она не имеет вкуса.
По той же причине она плохо подходит для приготовления водки, вкус которой во многом зависит от вкуса воды. Приготовленная на дистиллированной воде водка значительно уступает по вкусовым качествам водке на родниковой или бутилированной воде.
Приготовленная на дистиллированной воде водка значительно уступает по вкусовым качествам водке на родниковой или бутилированной воде.
Подведем итог: для разбавления применяйте мягкую бутилированную воду с жесткостью 1 мг-экв/л и ниже.
Пропорции смешивания
При смешивании спирта с водой происходит уменьшение объема получаемого раствора. То есть при добавлении в 1 литр спирта 1 литра воды на выходе мы не получим 2 литра жидкости. Объем будет чуть меньше. Этот эффект называется контракция и заметно усложняет нам расчеты.
Для правильного выбора пропорций необходимо воспользоваться специальной таблицей – таблицей Фертмана. В ней указано, сколько мл воды необходимо добавить в 1000 мл спирта, что бы получить раствор желаемой концентрации.
Привожу ее ниже (нажмите на картинку для увеличения).
Например, чтобы разбавить 90% спирт до 60% необходимо к 1000 мл спирта добавить 535 мл воды.
Стоит заметить, что все эти пропорции верны при температуре смешиваемых жидкостей 20 ºС.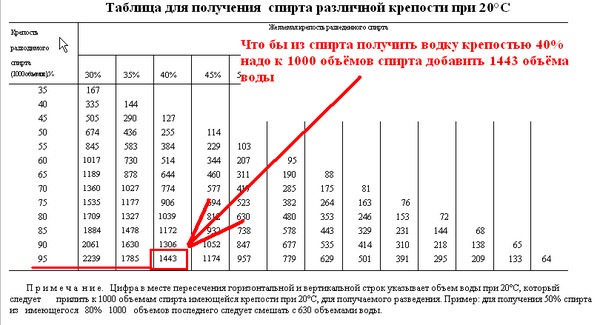 Если вы измеряете концентрацию алкоголя спиртометром, то должны знать, что при изменении температуры его показания меняются. Отклонение на 5 градусов по температуре приводит к отклонению примерно в 1 градус по алкоголю. Вот вам табличка для 96% спирта.
Если вы измеряете концентрацию алкоголя спиртометром, то должны знать, что при изменении температуры его показания меняются. Отклонение на 5 градусов по температуре приводит к отклонению примерно в 1 градус по алкоголю. Вот вам табличка для 96% спирта.
Вы наверное обратили внимание, что в таблице Фертмана есть данные только по спирту крепостью 95% и ниже. Но что делать, если он у вас более крепкий?
В таких случаях можно воспользоваться приведенной ниже формулой. Она рассчитывает, какой объем должна иметь смесь после разбавления.
Формула
Х= S/K*V (мл),
Где
X – конечный объем разбавленной жидкости (мл)
S – начальная крепость спирта (%)
K – требуемая крепость раствора (%)
V – начальный объем спирта (мл)
Например, нам надо разбавит 500 мл 96% спирта до крепости 40%. Считаем: Х=96/40*500=1200 мл. Получается нам надо добавлять в 500 мл спирта воду до тех пор, пока его объем не увеличится до 1200 мл.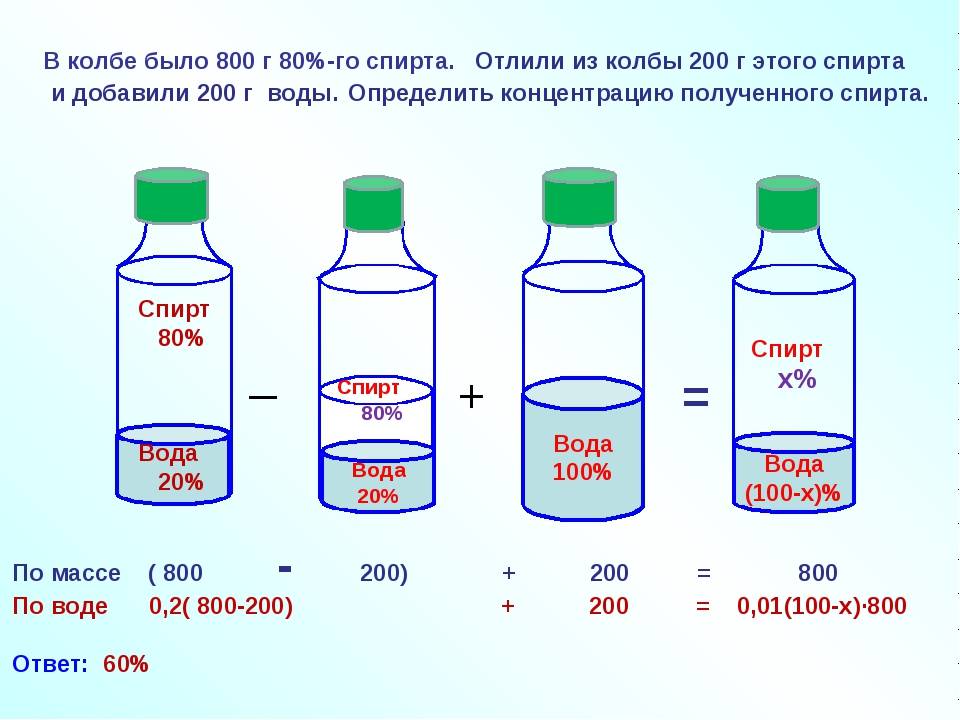
Сложно? Тогда есть вот такой вариант. Это довольно приблизительный расчет, но для домашних условий вполне подходит.
M= SV/K-V (мл),
Где
M – количество воды, необходимое для разбавления (мл)
S – начальная крепость спирта (%)
K – требуемая крепость раствора (%)
V – начальный объем спирта (мл)
Пример: Опять разводим 500 мл спирта 96% до крепости 40%. M = 96*500/40-500 =700 мл. Получается, что в 500 мл спирта надо добавить 700 мл воды. Но итоговый объем жидкости будет меньше 1200 мл. Помните почему? Правильно – контракция.
Технология смешивания
Со смешиванием спирта и воды тоже не всё так просто. В различной литературе, да и на многих сайтах и форумах пишут, что правильно лить спирт в воду. Дескать, необходимо более тяжелую жидкость (плотность воды 1г/мл) лить в более легкую (плотность спирта 0,8 г/л), так они быстрее смешиваются, и проходит правильно химическая реакция.
Но в то же время, не раз слышал, что на ликеро-водочных заводах льют, как спирт в воду, так и наоборот. И в некоторой литературе также приводят технологию, по которой воду добавляют в спирт. Привожу пример:
И в некоторой литературе также приводят технологию, по которой воду добавляют в спирт. Привожу пример:
В книге «Технологическая инструкции по ликеро-водочному производству», 1971г. на стр. 65 говорится:
«В подготовленный сортировочный чан наливают через мерник рассчитанное количество спирта, затем воды»
В справочнике «Рецептуры ликеро-водочных изделий», 1981г издания, на странице 9 о приготовлении водки указано следующее:
«Воду добавляют в купаж и доводят объем заданного по мерному стеклу купажного чана»
Из личного опыта скажу, что я смешивал и так и эдак, разницы особой не заметил. Главное придерживаться следующих правил:
- Перед смешиванием спирт и воду необходимо охладить. Спирт можно положить в морозилку, а воду в холодильник.
- Вливать можно как спирт в воду, так и наоборот, главное влить как можно быстрее и сразу же хорошенько перемешать.
Разбавленный водой спирт называется сортировкой. Только что приготовленная сортировка к употреблению не годится. Ей нужно некоторое время, чтобы завершились все проходящие химические реакции. Поэтому перед употреблением ее нужно отстоять хотя бы пару дней, а лучше неделю. Плотно закройте бутылку пробкой и спрячьте в холодильник.
Ей нужно некоторое время, чтобы завершились все проходящие химические реакции. Поэтому перед употреблением ее нужно отстоять хотя бы пару дней, а лучше неделю. Плотно закройте бутылку пробкой и спрячьте в холодильник.
Как правильно приготовить водку из спирта
Как я уже говорил выше – смесь спирта с водой это еще не водка, а всего лишь полуфабрикат под названием сортировка. А вот привычный вкус водки сортировка приобретает только после очистки ее углем. Во время углевания происходит очистка смеси от вредных примесей и окислительно-восстановительные реакции, после которых сортировка и превращается в водку.
Для очистки можно использовать уголь, продающийся в специализированных магазинах для виноделов, активированный уголь из аптеки, либо бытовой фильтр-кувшин для очистки воды, который продается в супермаркетах.
Пропорции на 1 литр сортировки примерно следующие – 1 столовая ложка угля из магазина для самогонщиков, либо 30 таблеток активированного угля из аптеки, либо двойная фильтрация через кувшин.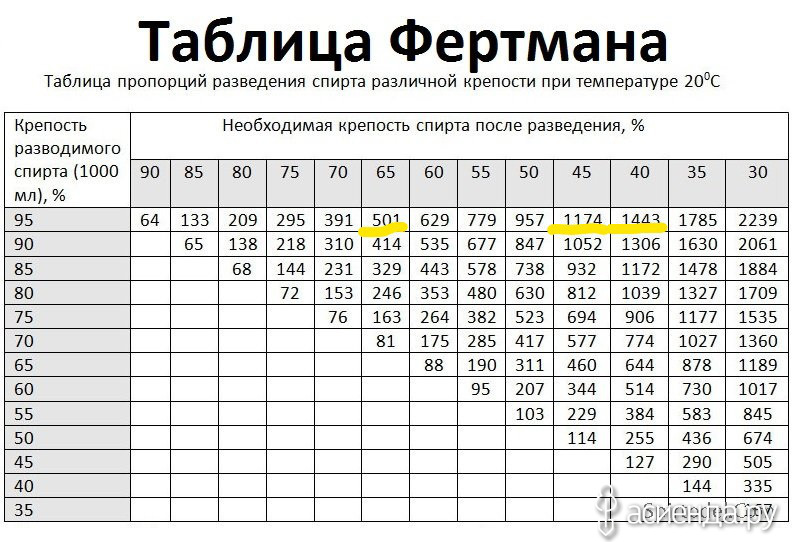 Сортировка должна быть 42%, т.к. после углевания 2 градуса потеряются.
Сортировка должна быть 42%, т.к. после углевания 2 градуса потеряются.
После фильтрации для умягчения вкуса в водку добавляют сахар (1 ч.л на 1л), либо глюкозу (20 мл 40% раствора на 1 л) или фруктозу. Также иногда добавляют гашеный уксус, глицерин и т.д.
Сегодня я не привожу подробный технологический процесс приготовления водки из спирта, так как это тема для отдельной статьи. Очень скоро я ее напишу. Подпишитесь на обновления и она придет к вам на почту.
А у меня, пожалуй, все на сегодня. Готовьте правильные напитки и будьте счастливы.
До новых встреч. Дорофеев Павел.
Как правильно разводить спирт в домашних условиях
Современные технологии позволяют получать этиловый спирт высокой степени очистки, не выходя из дома. Бытовые мини-спиртзаводы и ректификационные колонны выдают спирт-ректификат концентрацией вплоть до 93-95% (например, аппарат Люкссталь 7m). Но и достать спирт пищевого сорта промышленного производства тоже не так сложно, как в былые времена. О пищевых сортах мы подробно писали в нашей статье.
О пищевых сортах мы подробно писали в нашей статье.
Итак, неважно, откуда, но у Вас имеется этанол крепостью около 93-96 градусов. Как правильно разводить спирт для питья? Питьевой концентрацией обычно считается показатель от 15 до 50%. И как быстро развести спирт до водки? Рассмотрим все по порядку.
В каком соотношении разводят спирт
“Золотая пропорция” была выведена еще знаменитым химиком Д.И. Менделеевым и составляет 2:3 (этанол:вода). Но эта пропорция относится к этиловому спирту концентрацией 96% при его разведении до концентрации 40%. Иными словами, она показывает, как развести спирт, чтобы получилась водка.
Мы не говорим здесь о том, как развести 100% спирт. Дело в том, что при нормальных условиях и влажности получить 100% спирт нельзя. Максимальная его крепость — 96,6%. 100% спирт получают в лабораториях, и он крайне быстро улавливает пары воды из воздуха, а также крайне токсичен.
Как нужно разводить спирт, чтобы не навредить напитку
Чтобы развести чистый спирт,
нужно знать правило разбавления спиртов и кислот: растворяемое вещество
наливают в растворитель. Не наоборот. То есть, спирт понемногу наливают в воду.
Это тот случай, когда от перемены мест слагаемых сумма меняется, и виной тому
межмолекулярные взаимодействия. Если воду лить в концентрированный спирт, то
молекулы этанола начнут “разрывать” молекулы воды. При этом образуется перекись
водорода, повышается температура раствора, он может помутнеть (обратимо, если в
воде не было избытка солей и необратимо, если вода была “жесткая”). Соотношение
2:3 позволяет нам быстро развести спирт,
однако крепость исходного раствора может отличаться от 96 градусов. Обычно в домашних
условиях получается концентрат крепостью 85-93 градуса. В каких пропорциях разводить спирт, если у нас имеется раствор с
крепостью ниже 96%?
Не наоборот. То есть, спирт понемногу наливают в воду.
Это тот случай, когда от перемены мест слагаемых сумма меняется, и виной тому
межмолекулярные взаимодействия. Если воду лить в концентрированный спирт, то
молекулы этанола начнут “разрывать” молекулы воды. При этом образуется перекись
водорода, повышается температура раствора, он может помутнеть (обратимо, если в
воде не было избытка солей и необратимо, если вода была “жесткая”). Соотношение
2:3 позволяет нам быстро развести спирт,
однако крепость исходного раствора может отличаться от 96 градусов. Обычно в домашних
условиях получается концентрат крепостью 85-93 градуса. В каких пропорциях разводить спирт, если у нас имеется раствор с
крепостью ниже 96%?
Разведение разных концентраций этанола
Быстро и просто развести спирт
поможет таблица русского химика
Г.И. Фертмана, составленная им еще в начале 20 века. На ее основе составляются
и онлайн-калькуляторы,
позволяющие развести спирт любой
крепости до нужного значения.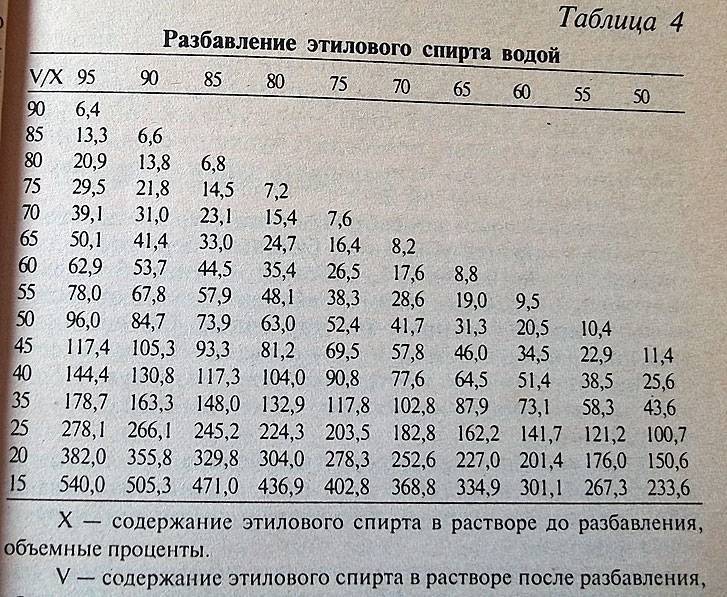
Как пользоваться таблицей
В теле таблицы показано, сколько воды нужно, чтобы развести спирт имеющейся концентрации (левый столбец) до нужной концентрации (верхняя строка). Количество воды показано в мл, которые нужно добавить к 1000 мл спирта исходной концентрации.
Таблица пропорций разведения спирта различной крепости при температуре 20С
В таблице приведены значения, позволяющие без перерасчета развести 1 литр спирта различной крепости. Однако их несложно пересчитать на имеющийся в наличии объем.
После разведения спирта водой напиток убирают в холодильник “отстояться” и гармонизироваться на 2-3 суток. За это время смягчается вкус и аромат.
Чем лучше разводить спирт для питья
Больше всего подходит для этих целей умягченная или дистиллированная вода.
Меньше всего — жесткая родниковая или нефильтрованная водопроводная. Однако
есть еще, чем разводить спирт для питья.
Поговорим о способах ниже.
Как развести спирт кипятком
И такой метод тоже есть. И хотя он даст незначительные потери по этанолу (часть молекул испарится), зато в отличие от “холодного” метода разведения, напиток можно употреблять, не выжидая 2-3 суток. Водка, полученная разведением пищевого сорта этанола с кипятком, готова к употреблению уже через пару часов (как охладится). Вкус ее сразу становится более мягким. Охлаждать такой напиток можно в холодильнике.
Как развести этиловый спирт для настойки
Все зависит от того, какая будет настойка. Лекарственные настойки на спирту можно готовить без разведения (крепость 80-96 градусов). Концентрированный этанол позволяет лучше “вытянуть” все полезные вещества из настаиваемого компонента. Десертные настойки лучше готовить на “водочной” концентрации (40-45%).
Чем развести спирт кроме воды
Разведения можно делать не только с водой. Хорошо подходят для напитков
сок, сахарный или глюкозный сироп, медовый сироп. Все эти компоненты позволяют
дополнительно смягчить разведенный
спирт в домашних условиях, если вкус кажется Вам слишком жестким, а
аромат — резким. Пропорции для сиропов те же, что и для воды, а вот с соком
нужно делать более слабое разведение (до 15-25 градусов). Полученный крепкий
коктейль может оказаться “коварным”, и Вы не заметите, как опьянеете. Сок очень
хорошо маскирует спирт. Также хорошо нивелируется резкий “дух” в разведенном спирте с лимоном. На литр
напитка достаточно 1-2 долек цитруса.
Все эти компоненты позволяют
дополнительно смягчить разведенный
спирт в домашних условиях, если вкус кажется Вам слишком жестким, а
аромат — резким. Пропорции для сиропов те же, что и для воды, а вот с соком
нужно делать более слабое разведение (до 15-25 градусов). Полученный крепкий
коктейль может оказаться “коварным”, и Вы не заметите, как опьянеете. Сок очень
хорошо маскирует спирт. Также хорошо нивелируется резкий “дух” в разведенном спирте с лимоном. На литр
напитка достаточно 1-2 долек цитруса.
Как развести спирт сырец для второй перегонки
Необходимо измерить крепость сырца при помощи спиртометра. Для второй перегонки его разводят, как правило, до концентрации 18-20%. Именно такой показатель связан опять же с молекулярными взаимодействиями: в такой концентрации этанол легче всего отделяется от примесей и воды.
Пример, как можно развести спирт-сырец:
Пусть мы хотим развести сырец до крепости 20 градусов. Тогда объем воды,
который нужно добавить, будет равен (X/20)*Y-Y, где X — крепость сырца, Y —
объем сырца. Если у нас 10 л сырца крепостью 80 градусов, то получаем:
Если у нас 10 л сырца крепостью 80 градусов, то получаем:
(80/20)*10-10=30 (л) — объем воды, который нужно добавить к 10 л спирта-сырца с концентрацией 80%, чтобы получить концентрацию 20%.
Как развести спирт без спиртометра
К сожалению, никак. Проверить спиртуозность “на глаз” не представляется возможным. Можно лишь определить порог в 40% путем поджигания спирта: горит синим — крепость 40 градусов и выше. Не горит — ниже 40 градусов. А вот точные разведения делать без спиртометра уже не получится.
Как развести коньячный спирт
Коньячный спирт — это тот же этанол, но получают его двойной перегонкой браги из виноградного сырья. Спирт этот после настаивания в бочках становится коньяком. Промышленные сорта этанола для водки обычно получают из зерна или смеси картофеля и зерна. Принципы разведения коньячного спирта не отличаются от обычного этанола. Главное — это качество воды (она должна быть мягкой, лучше — дистиллированной).
Вот, пожалуй, все основные моменты того, как правильно развести спирт в домашних условиях. Пусть Ваши
напитки получаются вкусными и приятными. Главное — помните меру и берегите свое
здоровье.
Пусть Ваши
напитки получаются вкусными и приятными. Главное — помните меру и берегите свое
здоровье.
Чем и как разводить концентрат антифриза: таблица рекомендуемых значений
Антифриз является неотъемлемой частью любого автомобиля, в котором установлен двигатель внутреннего сгорания. Без охлаждающей жидкости детали мотора долго не проработают, и важно правильно выбрать антифриз, а также вовремя заменить его в автомобиле.
В продаже можно найти разведенный вариант антифриза и концентрированный. Ряд водителей не видят в них разницу и допускают серьезную ошибку, заливая концентрат охлаждающей жидкости в двигатель автомобиля. Это может привести к серьезным последствиям, особенно в холодное время года.
Зачем разводить концентрат антифриза
Чтобы понять необходимость разведения концентрата антифриза перед заливом в бак для охлаждающей жидкости, нужно разобраться в его химическом составе и функциях, которые он должен выполнять. Как известно, главная задача антифриза в системе – это поддержка рабочей температуры двигателя на уровне около 90-110 градусов по Цельсию. Если температура будет выше, двигатель перегреется.
Если температура будет выше, двигатель перегреется.
Исходя из этого, можно сделать вывод, что антифриз должен находиться в жидком состоянии в любое время года, чтобы «бегать» по системе охлаждения и снижать температуру элементов двигателя. С этой задачей не может справиться как обычная вода, так и концентрированный антифриз. Дело в том, что концентрат антифриза – это этиленгликоль, то есть двухатомный спирт. Он способен держать высокий порог закипания на уровне около 200 градусов, но порог охлаждения у него не годится для условий российской зимы. Уже при минус 13 градусах чистый этиленгликоль замерзнет, что недопустимо для жидкости, залитой в систему охлаждения.
Этиленгликоль хорошо смешивается с водой и спиртами, после чего он приобретает новые свойства. Разбавляя концентрат антифриза, можно понизить температуру, при которой он замерзает, до необходимых значений, вплоть до минус 70 градусов по Цельсию. Само собой, при разбавлении антифриза водой снижается порог его жаростойкости, то есть закипание жидкости происходит при меньших температурах, чем когда он находится в концентрированном виде.
Чем разбавить концентрат антифриза
Не стоит забывать, что антифриз – это жидкость, которая должна не только охлаждать двигатель, но и поддерживать его в работоспособном состоянии, очищая от элементов коррозии и защищая от ржавчины при помощи имеющихся в составе присадок. Если разбавить концентрат антифриза водой из-под крана, велик риск не только снизить эффективность присадок, но занести в антифриз микроэлементы, которые негативно скажутся на работе двигателя и приведут к быстрой коррозии или другим неприятностям. Более того, магний, кальций, хлор и другие элементы, содержащиеся в обычной водопроводной воде, забьют мелкие каналы в двигателе, что снизит эффективность охлаждения.
Соответственно, для разведения концентрата антифриза необходимо использовать чистую дистиллированную воду, которую можно купить в автомобильном или хозяйственном магазине. В такой воде нет никаких вредных примесей.
Как разводить антифриз концентрат: таблица значений
Если антифриз концентрат сертифицирован и выпущен на рынок, на упаковке с ним будет написана подробная инструкция, как его разводить с дистиллированной водой. В данном случае ориентироваться нужно на климатическую зону, в которой эксплуатируется машина. Если температура в холодное время года редко понижается ниже минуса 20 градусов по Цельсию, не имеет смысл разводить антифриз на работу при температуре меньше минуса 40 градусов по Цельсию.
В данном случае ориентироваться нужно на климатическую зону, в которой эксплуатируется машина. Если температура в холодное время года редко понижается ниже минуса 20 градусов по Цельсию, не имеет смысл разводить антифриз на работу при температуре меньше минуса 40 градусов по Цельсию.
Приведем некоторые стандартные значения приготовления антифриза из концентрата:
- — 25 градусов по Цельсию: концентрат смешивается с водой в пропорции 2 к 3, то есть 2 мерных объема концентрата к 3 мерным объемам вода. Важно отметить, что порог закипания в таком случае снизится примерно до +130 градусов по Цельсию;
- — 45 градусов по Цельсию: концентрат смешивается с водой в пропорции 1 к 1, например, 1 литр воды на 1 литр концентрата антифриза.
Ориентироваться при смешивании охлаждающей жидкости можно на следующие значения:
Обратите внимание, что в данном случае не работает принцип «чем больше воды, тем ниже температура замерзания». Разбавлять концентрат антифриза необходимо в пропорциях, приведенных в таблице. Если налить слишком много воды, охлаждающая жидкость потеряет свойства противостояния низким температурам.
Разбавлять концентрат антифриза необходимо в пропорциях, приведенных в таблице. Если налить слишком много воды, охлаждающая жидкость потеряет свойства противостояния низким температурам.
Как развести сухое молоко для каши, блинов и сделать из него творог, сыр, сгущенку?
Отличной альтернативой цельному коровьему молоку является порошкообразная смесь из него, полученная при помощи предварительного сгущения и сушки сырья. Но многие не покупают сухое молоко из-за того, что не знают, как правильно развести его в домашних условиях. А ведь это продукт, который после соединения с водой не просто напоминает по вкусу пастеризованное молоко, но и имеет те же полезные свойства, легче усваивается и дольше сохраняется без потери потребительских качеств.
Хранить сухое молоко разрешается при комнатной температуре без охлаждения в закрытой емкости:
- обезжиренное – до 36 месяцев,
- цельное – только до 6 месяцев за счет большего содержания жира.

Распечатанную упаковку лучше поместить в герметичную тару и хранить в холодильнике. Длительный срок годности обусловлен тем, что свежее сырье подвергается нескольким стадиям термической обработки, что исключает наличие любых бактерий и микроорганизмов. Перед тем, как пить или употреблять для приготовления крема, каши, сгущенки, сухое молоко нужно разбавить водой до получения жидкого состояния.
Разводим суое молоко для ребенка
Узнать, как разводить сухое молоко для ребенка, можно у семейного доктора, педиатра или диетолога. Если нет индивидуальных показаний врача, то для использования в детской практике можно разбавлять 20-30 г порошкообразного концентрата на 200 мл воды. Такой продукт содержит минимальное количество аллергенов, поэтому включен в состав питания для малышей, у которых организм «не принимает» цельное коровье молоко.
Как грамотно разводить сухое молоко в домашних условиях?
Белый молочный порошок со слегка кремовым оттенком нужно аккуратно смешать с небольшим количеством теплой перекипяченной воды, которую лучше вливать тонкой струйкой. Чтобы не образовались комочки, смесь нужно хорошо размешивать. После получения однородной массы можно добавить остальную воду и дать настояться примерно 15 минут, чтобы набухли белки и исчез привкус «водянистости».
Чтобы не образовались комочки, смесь нужно хорошо размешивать. После получения однородной массы можно добавить остальную воду и дать настояться примерно 15 минут, чтобы набухли белки и исчез привкус «водянистости».
Для приготовления молока 2,5% жирности понадобится 25 грамм (5 чайных ложек) порошкообразного продукта на 200 мл воды. Для получения молока с разным содержанием жира можно варьировать количество воды и концентрата. Как и цельное, так и обезжиренное сухое молоко следует разводить правильно, учитывая следующие факторы:
- Не использовать холодную, ледяную воду: мельчайшие частицы не все растворятся, могут частично кристаллизироваться, что будет ощущаться при употреблении;
- Нельзя заливать смесь кипятком: продукт свернется;
- Не рекомендуется применять миксер: получится ненужная пена.
Если соблюдать пропорции и технологический процесс, то можно быстро и правильно разбавить сухое молоко. Вы легко получите приятный и полезный напиток!
Особенности применения сухого молока
Когда требуется развести сухое молоко для каши из риса, манной, овсяной или гречневой крупы, то пропорции остаются неизменными: 5 чайных ложек на 1 стакан воды.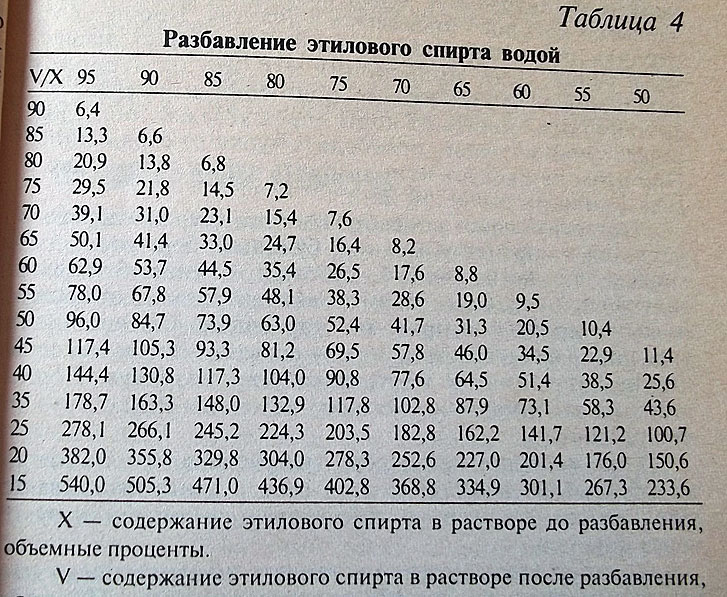 Изменять соотношение сухого продукта и воды можно по личному вкусу. Из восстановленного молока хозяйки делают крем, кисель, даже кисломолочные продукты.
Изменять соотношение сухого продукта и воды можно по личному вкусу. Из восстановленного молока хозяйки делают крем, кисель, даже кисломолочные продукты.
Творог из сухого молока
Молоко, приготовленное из 400-500 г сухого концентрата и 3 л теплой воды, нужно довести до кипения, а затем добавить 5,5-6 ложек уксуса. Прокипятив 2-3 минуты на маленьком огне, смесь можно процедить через сито (дуршлаг) и отжать до полного отделения сыворотки. Вкусный и необычный творог готов!
Готовим сыр из сухого молока
Из сухого молока, которое в процессе производства подвергается обработке при температуре не выше 70С°, можно делать качественные мягкие сыры при добавлении липазы и хлорида кальция. Но маркировку Low heat можно встретить только на упаковке сухого молока, произведенного в Европе, российские производители о такой информации умалчивают. В домашних условиях из сухого молока можно сделать брынзу – такой сыр получается намного вкуснее, чем в магазине, и количество соли можно регулировать по своему вкусу.
Для изготовления рассольного сыра нужно взять:
- 1 кг сухого молока;
- 1500 мл воды;
- 150 грамм сметаны;
- 6 шт таблеток абомина;
- 0,5 ч.л. уксуса;
- соль по вкусу.
Разбавленное сухое молоко смешать со сметаной и соединить с растворенными в теплой воде сычужными таблетками и уксусом. Укутать, оставить в тепле на 12 часов. Выложить брынзу на 7-8 часов под гнет, придавая ей любую форму. Рассольный сыр готов!
Сгущенка из сухого молока
Любителям сладенького придется по вкусу рецепт, как из сухого молока сделать сгущенку. Каждая хозяйка делает сгущенку разными способами, но за основу берется сухое молоко, сахар и вода обычно в равных пропорциях. Желательно варить смесь на водяной бане или маленьком огне не менее 1 часа, постоянно помешивая и не доводя до кипения.
Прочее применение
Не менее востребовано сухое молоко для использования в приготовлении блинов, оладий и любой выпечки.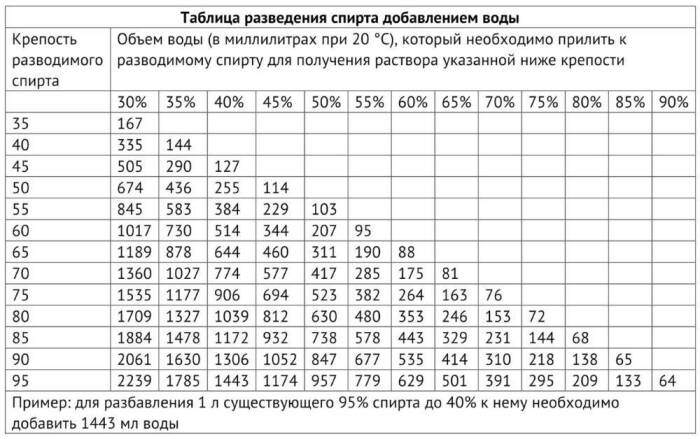 Чтобы развести сухое молоко для блинов, можно брать больше жидкости – около 1 л на 100 г порошка.
Чтобы развести сухое молоко для блинов, можно брать больше жидкости – около 1 л на 100 г порошка.
Даже спортсмены считают сухое молоко отличной заменой протеиновым коктейлям за счет богатого белкового и витаминного состава. От употребления вкусного, антиаллергенного сухого молока вы получите не только пользу, но и удовольствие!
Как разбавлять масло для бензопилы
В данной публикации мы подробно объясним как правильно разбавлять масло для бензопилы, триммера или любого двухтактного двигателя. С каким маслом лучше разбавить бензин, какую пропорцию соблюдать, а также к чему может привести неправильная дозировка — на все эти вопросы вы узнаете ответы здесь.
Масло, или как его еще называют присадка, является важнейшим компонентом топливной смеси для бензопилы. В процессе работы двухтактного механизма, молекулы масла оседают на ДВС (стенки цилиндра, коленвал, шатун) и создают скользящую защитную пленку. Таким образом значительно уменьшается физический контакт трущихся деталей.
| Пропорция масла с бензином для бензопилы |
Многие пользователи попросту забывают в какой пропорции требуется разбавлять масло с бензином для современной бензопилы или триммера. Здесь нет ничего зазорного, ведь большинство задается этим вопросом буквально несколько раз в год. Данную информацию можно легко найти в инструкции к технике, но тут не все так просто. К примеру, китайские производители часто путают нас и прописывают в паспорте соотношение 1:20 или 1:25. Такая пропорция является опасной для механизма, о чем мы расскажем чуть дальше.
Правильная пропорция: для наших условий (существующее на рынке марки масла и качество бензина) это только 1:50 (редко 1:40). Иначе говоря, 1 гр масла на 50 мл бензина.
количество бензина АИ-92, л количество 2Т масла, мл пропорция 1:50 пропорция 1:40 0,5 10 мл 12,5 мл 1 20 мл 25 мл 1,5 30 мл 37,5 мл 2 40 мл 50 мл 5 100 мл 125 мл 10 200 мл 250 мл
Используется бензин только марки АИ-92.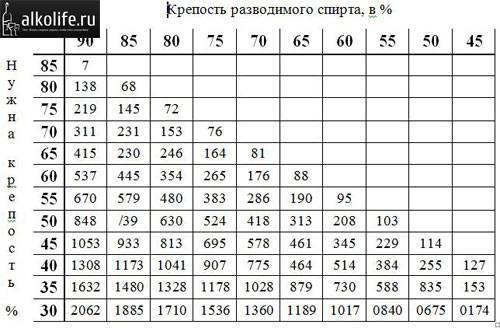 Никакого 95-го, который по факту тот же 92-ой, только с кучей присадок, крайне вредных для двухтактного мотора (так как эти присадки гасят правильную детонацию механизма).
Никакого 95-го, который по факту тот же 92-ой, только с кучей присадок, крайне вредных для двухтактного мотора (так как эти присадки гасят правильную детонацию механизма).
Важно: В некоторых случаях допускается добавить двухтактного масла чуть больше обычного (не 20 грамм на литр, а 22-25 грамм). К примеру, во время обкатки бензопилы после ремонта поршневой группы или в случае использования китайского дешевого масла.
| С каким маслом лучше разбавлять бензин для бензопилы |
Ни для кого не секрет, что каждый производитель бензопил рекомендует применять двухтактную присадку собственного производства. Но тут не все так однозначно. Если вы покупаете недорогую китайскую бензопилу, то конечно будет не лишним разбавлять для нее масло именитых проверенных марок. Так с каким маслом разбавлять бензин лучше? — одного правильного ответа нет и на это влияет ряд факторов:
- Во время гарантии.
 Большинство именитых производителей рекомендует применять только собственное масло. В случае возникновения гарантийного случая, если сервис обнаружит что вы заправляли другую марку масла, он имеет полное право отказать в бесплатном обслуживании.
Большинство именитых производителей рекомендует применять только собственное масло. В случае возникновения гарантийного случая, если сервис обнаружит что вы заправляли другую марку масла, он имеет полное право отказать в бесплатном обслуживании. - Проверенные марки. Stihl, Echo, Husqvarna — известные и проверенные бренды. Это самое лучшее, что есть на рынке. Используя фирменное двухтактное масло можно совершенно не беспокоиться за свою технику.
- Дешевое масло (российское или китайское). Это Champion, Rezer, Krotof, Patriot и многие другие. Пользоваться им вполне можно, в каких-то случаях слегка увеличив пропорцию масла в смеси. Стоит внимательно отнестись к выбору — почитать отзывы, поспрашивать у людей. К примеру, двухтактное масло “Газпром” совершенно не впечатлило наш сервис — уже через 2-3 дня после разведения с бензином оно начинает терять свое свойство.
- Остерегайтесь контрафакта. В основном подделывают масло Stihl. Подобные варианты можно встретить на колхозных рынках или у цыган.
 Старайтесь покупать 2Т масло в специализированных магазинах у официальных дилеров.
Старайтесь покупать 2Т масло в специализированных магазинах у официальных дилеров. - Никакого 2-тактного масла для лодочных моторов. Для бензопил и триммеров оно не подходит, т.к. рассчитано на систему с водяным охлаждением, а не воздушным.
| Как легко разбавить присадку с бензином |
Разбавлять двухтактное масло с бензином “на глаз” можно разве что матерым пользователям, которые смогут точно определить пропорцию опытным глазом. Но даже они нередко ошибаются в таком случае. Приведем несколько вариантов по правильному и быстрому наведению бензиновой смеси:
Приведем несколько вариантов по правильному и быстрому наведению бензиновой смеси:
Во время смешивания бензина и масла будьте осторожны. Это горючие вещества, и в неумелых руках представляют опасность для здоровья и даже жизни. Соблюдайте технику безопасности! Сам процесс смешивания довольно прост и примитивен:
- Найдите чистую тару, желательно темного цвета (пищевой пластик не подходит).
- Сначала заливаете бензин марки АИ-92
- После добавляете выверенную дозу двухтактного масла.
- Тщательно все взбалтываете — это важно (в том числе после некоторого простоя уже разбавленной смеси).
| Как хранить масло для бензопилы |
Как правило, срок годности двухтактного масла составляет не менее 3-ех лет. Это касается именно чистого масла (присадки), при условии полной герметичности упаковки (бутылки). Совсем другое дело уже разбавленная смесь масла с бензином. Многие смешивают ее сразу на все лето, на год и т.д. Это является очень грубой ошибкой!
Многие смешивают ее сразу на все лето, на год и т.д. Это является очень грубой ошибкой!
Рекомендуемый срок хранения разбавленного бензина с маслом — 2 недели. В случае использования недорого китайского или российского масла лучше сократить этот срок до одной недели. Например, даже дорогое качественное синтетическое масло Stihl, после 3-ех недельного хранения сохраняет свои свойства на 80%. Об остальных марках и говорить не приходится.
Так почему нельзя разбавлять масло с бензином “про запас”.
Во-первых, бензин со временем теряет октановое число. Во-вторых, масло в бензине постепенно теряет свое свойство. Присадки в нем растворяются в агрессивной среде и в итоге от него остается только цвет. Последствия здесь печальные — перегрев двигателя и дорогостоящий ремонт двигателя (ЦПГ).
Итог: разбавляйте такое количество бензосмеси, сколько планируете использовать, исходя из намеченного объема работ.
Если остался старый излишек, его следует утилизировать, даже тот который остался в баке бензопилы или бензотриммера.
| Последствия и признаки неправильной пропорции |
Масло добавляется в бензин для снижения силы трения механизма, мы уже говорили об этом в начале статьи. Поэтому, неправильно разбавленная или просроченная бензосмесь обязательно обернется печальными последствиями.
Если залить недостаточно двухтактного масла.
Двигатель будет работать без должной смазки и быстро перегреется. Это приводит к задирам/деформации деталей поршневой группы. Особенно подвержена этому китайская техника. Зачастую ремонт поршневой экономически нецелесообразен и глупая экономия масла является обычной “смертью” бензопилы.
Признак: Главным образом, агрегат начинает греться быстрее обычного. Может появиться вибрация, увеличивающаяся в процессе набора оборотов. В каких-то случаях бензопила или триммер просто не заведется — но это даже хорошо, так как у вас будет время на исправление критической ошибки.
В каких-то случаях бензопила или триммер просто не заведется — но это даже хорошо, так как у вас будет время на исправление критической ошибки.
Переизбыток масла в топливной смеси также вредно как и его недостаточное количество. Тут совершенно неуместно выражение “заправку маслом не испортишь”. Это лишь проявляется не сразу а по истечении некоторого времени. Если совсем просто: во время работы двигателя, лишнее количество присадок попросту не прогорает и постепенно отлагается на стенки ЦПГ. К чему это приводит:
- Образование нагара на стенках цилиндра/поршня — он коксуется и выпадает — на поршневой образуются задиры. Потребуется серьезный ремонт двигателя.
- Излишек топлива может выплюнуть на воздушный фильтр — спасет прочистка системы и покупка нового фильтра.
- Забивается глушитель — отработанным газам просто некуда деваться и бензопила или триммер буквально начинают захлебываться под нагрузкой.
 Плюс, закоксованная окалина из глушителя может вылететь в цилиндр — опять ремонт поршневой.
Плюс, закоксованная окалина из глушителя может вылететь в цилиндр — опять ремонт поршневой. - Нагар скапливается на свече, она чернеет и приходит в негодность.
Признак: Тут все довольно просто. Если добавить в бензин слишком много двухтактного масла, то при работе бензопила или триммер будет буквально коптить/дымить. Причем, чем больше его перелито, тем больше будет дыма.
| Можно ли смешивать двухтактное масло разных цветов |
Для того, чтобы ответить на этот вопрос, следует разобраться в 2-ух основных видах масла. По своей основе двухтактное масло разделяется на минеральное и синтетическое.
Минеральное 2Т масло для бензопилы или триммера более распространено (так как дешевле) и имеет обычно красный окрас. Также встречаются синие и даже желтые расцветки. Мешать их можно, ничего критичного не произойдет, но именно в ситуации “остался в баке красный бензин, а надо заправить синий”.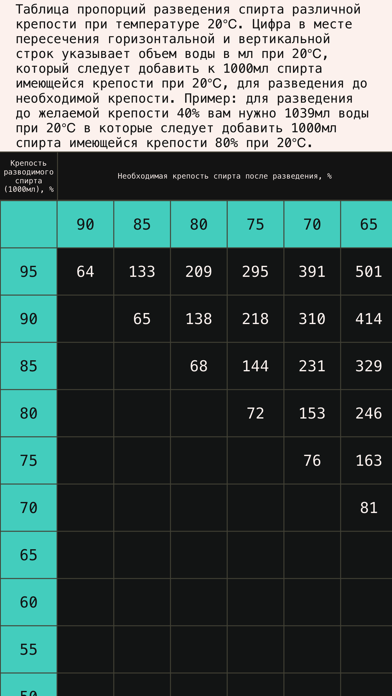
Синтетическое двухтактное масло для бензопилы (как правило, зеленое) обладает высоким чистящим эффектом и гораздо эффективнее прогорает в процессе работы двигателя. Плюс, лучше его смазочные свойства. Проще говоря, оно лучше минерального, но и стоит дороже.
Полусинтетика это смесь выше перечисленных. Не будем заострять внимание на этом виде двухтактного масла (обычно синий окрас), так как относиться к нему надо так же как к синтетическому варианту.
А вот как нельзя размешивать двухтактное масло:
- Нельзя использовать синтетическое масло после минерального. Минеральное масло все-таки оставляет со временем небольшой нагар в ЦПГ, который начнет активно “смываться” синтетикой. Вся грязь начнет летать в поршневой и исцарапает ее. Итог — дорогой и сложный ремонт. А вот после синтетики на минералку перейти вполне можно.
- Если вы хотите смешать минеральное масло разного цвета литрами/канистрами — так делать не рекомендуется.
 Это относится и к смешиванию синтетических присадок между собой.
Это относится и к смешиванию синтетических присадок между собой.
Правильно разбавленная бензосмесь для бензопилы (триммера) является важнейшим фактором ее сохранности и стабильной работы. Самое главное что нужно уяснить из данной статьи — соблюдайте четкую пропорцию масла и бензина. Двухтактному механизму вредит как его переизбыток, так и недостаток в бензосмеси. Да, некоторая погрешность допустима, но лишь совсем небольшая.
Особенное внимание уделите марке масла, выбрать лучше фирменное пусть и дорогое. Это не тот случай, где можно сэкономить. Согласитесь, что ремонт поршневой обойдется на порядок дороже.
Соблюдайте технику безопасности и хорошей вам работы!
4 6 голоса
Рейтинг статьи
13.7: Разбавление раствора — Chemistry LibreTexts
Цели обучения
- Объясните, как можно изменить концентрацию в лаборатории.

- Узнайте, как стандартные растворы используются в лаборатории.
Нас часто беспокоит, сколько растворенного вещества растворено в данном количестве раствора. Мы начнем обсуждение концентрации раствора с двух связанных и относительных терминов: разбавленный и концентрированный .
- Разбавленный раствор — это раствор, в котором растворено относительно небольшое количество растворенного вещества.
- Концентрированный раствор содержит относительно большое количество растворенного вещества.
Эти два термина не предоставляют никакой количественной информации (фактические числа), но они часто полезны при сравнении решений в более общем смысле. Эти термины также не говорят нам, является ли раствор насыщенным или ненасыщенным, или является ли раствор «сильным» или «слабым». Эти два последних термина будут иметь особое значение при обсуждении кислот и оснований, поэтому будьте осторожны, чтобы не путать их.
Стандартные решения
Часто бывает необходимо иметь раствор с очень точно известной концентрацией. Растворы, содержащие точную массу растворенного вещества в точном объеме раствора, называются стандартными (или стандартными) растворами . Для приготовления стандартного раствора необходимо использовать лабораторное оборудование, называемое мерной колбой. Эти колбы имеют размер от 10 мл до 2000 мл и тщательно откалиброваны до единичного объема. На узком штоке нанесена калибровочная отметка .Точная масса растворенного вещества растворяется в небольшом количестве растворителя и добавляется в колбу. Затем в колбу добавляют достаточное количество растворителя, пока уровень не достигнет калибровочной отметки.
Часто удобно приготовить серию растворов с известными концентрациями, сначала приготовив один исходный раствор , как описано в предыдущем разделе. Аликвоты (тщательно отмеренные объемы) исходного раствора затем можно разбавить до любого желаемого объема. В других случаях может быть неудобно достаточно точно взвесить небольшую массу образца, чтобы приготовить небольшой объем разбавленного раствора.Каждая из этих ситуаций требует разбавления раствора для получения желаемой концентрации.
В других случаях может быть неудобно достаточно точно взвесить небольшую массу образца, чтобы приготовить небольшой объем разбавленного раствора.Каждая из этих ситуаций требует разбавления раствора для получения желаемой концентрации.
Разведения стандартных (или стандартных) растворов
Представьте, что у нас есть раствор соленой воды с определенной концентрацией. Это означает, что у нас есть определенное количество соли (определенная масса или определенное количество молей), растворенное в определенном объеме раствора. Далее мы разбавим этот раствор. Для этого нужно добавить больше воды, а не соли:
\ (\ rightarrow \)
До разбавления и после разбавления
Молярность раствора 1
\ [M_1 = \ dfrac {\ text {moles} _1} {\ text {litre} _1} \]
, а молярность раствора 2 —
.\ [M_2 = \ dfrac {\ text {моль} _2} {\ text {litre} _2} \]
переставьте уравнения, чтобы найти родинок:
\ [\ text {moles} _1 = M_1 \ text {litre} _1 \]
и
\ [\ text {moles} _2 = M_2 \ text {litre} _2 \]
Что осталось прежним и что изменилось в двух решениях? Добавив еще воды, мы изменили объем раствора. Это также изменило его концентрацию. Однако количество молей растворенного вещества не изменилось. Итак,
Это также изменило его концентрацию. Однако количество молей растворенного вещества не изменилось. Итак,
\ [моль_1 = моль_2 \]
Следовательно,
\ [\ в коробке {M_1V_1 = M_2V_2} \ label {diluteEq} \]
где
- \ (M_1 \) и \ (M_2 \) — концентрации исходного и разбавленного растворов
- \ (V_1 \) и \ (V_2 \) — объемы двух решений
Приготовление разведений — обычное дело в химической лаборатории и в других местах.Как только вы поймете вышеупомянутую взаимосвязь, вычисления станут простыми.
Предположим, что у вас есть \ (100. \: \ Text {mL} \) раствора \ (2.0 \: \ text {M} \) \ (\ ce {HCl} \). Вы разбавляете раствор, добавляя столько воды, чтобы объем раствора составлял \ (500. \: \ Text {mL} \). Новую молярность можно легко вычислить, используя приведенное выше уравнение и решив для \ (M_2 \).
\ [M_2 = \ frac {M_1 \ times V_1} {V_2} = \ frac {2.0 \: \ text {M} \ times 100. \: \ text {mL}} {500. \: \ text {mL}} = 0.40 \: \ text {M} \: \ ce {HCl} \]
\: \ text {mL}} {500. \: \ text {mL}} = 0.40 \: \ text {M} \: \ ce {HCl} \]
Раствор разбавлен на одну пятую, так как новый объем в пять раз больше исходного.Следовательно, молярность составляет одну пятую от первоначального значения.
Другая распространенная проблема разбавления заключается в вычислении количества высококонцентрированного раствора, необходимого для получения желаемого количества раствора меньшей концентрации. Высококонцентрированный раствор обычно называют исходным раствором.
Пример \ (\ PageIndex {1} \): разведение азотной кислоты
Азотная кислота \ (\ left (\ ce {HNO_3} \ right) \) — сильнодействующая и едкая кислота. При заказе от компании-поставщика химикатов его молярность равна \ (16 \: \ text {M} \).Сколько основного раствора азотной кислоты нужно использовать для приготовления \ (8.00 \: \ text {L} \) раствора \ (0.50 \: \ text {M} \)?
Решение
Этапы решения проблем | |
|---|---|
Определите «данную» информацию и то, что проблема просит вас «найти». | Дано: M 1 , Шток \ (\ ce {HNO_3} = 16 \: \ text {M} \) \ (V_2 = 8.00 \: \ text {L} \) \ (M_2 = 0,50 \: \ text {M} \) Находка: объемный запас \ (\ ce {HNO_3} \ left (V_1 \ right) =? \: \ Text {L} \) |
| Перечислите другие известные количества. | нет |
Спланируйте проблему. | Сначала измените уравнение алгебраически, чтобы найти \ (V_1 \). \ [V_1 = \ frac {M_2 \ times V_2} {M_1} \] |
Расчет и отмена единиц. | Теперь подставьте известные величины в уравнение и решите. \ [V_1 = \ frac {0.50 \: \ text {M} \ times 8.00 \: \ text {L}} {16 \: \ text {M}} = 0.25 \: \ text {L} = 250 \: \ text {mL} \] |
| Подумайте о своем результате. | \ (250 \: \ text {mL} \) запаса \ (\ ce {HNO_3} \) необходимо разбавить водой до конечного объема \ (8.00 \: \ text {L} \). Разбавление происходит в 32 раза, чтобы перейти от \ (16 \: \ text {M} \) к \ (0,5 \: \ text {M} \). |
Упражнение \ (\ PageIndex {1} \)
В 0,885 М раствор KBr с начальным объемом 76,5 мл добавляется еще воды до тех пор, пока его концентрация не станет 0,500 М. Каков новый объем раствора?
Ответ
135.4 мл
Обратите внимание, что вычисленный объем будет иметь те же размеры, что и входной объем, и анализ размеров говорит нам, что в этом случае нам не нужно преобразовывать в литры, поскольку L отменяется, когда мы делим M (моль / л) на M (Молл).
Растворы для разбавления и смешивания
Как разбавить раствор от CarolinaBiological |
Материалы и авторство
Эта страница была создана на основе содержимого следующими участниками и отредактирована (тематически или широко) командой разработчиков LibreTexts в соответствии со стилем, представлением и качеством платформы:
Принятие простых решений и разбавлений
| просто разбавление | серийное разведение | VC = VC метод | молярные растворы | процентов решения || молярный -% конверсии | концентрированные исходные растворы (X единиц) | нормальность — преобразование молярности
Рабочая Расчет концентрации
1.Простое разбавление (метод коэффициента разбавления на основе соотношений)
A простое разведение — это раствор, в котором единиц объема интересующего жидкого материала объединяется
с соответствующим объемом растворителя жидкости для достижения
желаемая концентрация. Фактор разбавления — это
общее количество единичных объемов, в которых будет растворен ваш материал.
Затем разбавленный материал необходимо тщательно перемешать, чтобы добиться
истинное разбавление.Например, разбавление 1: 5 (вербализуйте как
Разбавление «от 1 до 5») влечет за собой объединение 1 единицы объема
из растворенное вещество (разбавляемый материал) + 4 шт.
объемы растворителя среды (следовательно, 1 + 4 = 5
= коэффициент разбавления). Фактор разбавления часто выражается
используя экспоненты: 1: 5 будет 5e-1; 1: 100 будет 10e-2, а
скоро.
Фактор разбавления — это
общее количество единичных объемов, в которых будет растворен ваш материал.
Затем разбавленный материал необходимо тщательно перемешать, чтобы добиться
истинное разбавление.Например, разбавление 1: 5 (вербализуйте как
Разбавление «от 1 до 5») влечет за собой объединение 1 единицы объема
из растворенное вещество (разбавляемый материал) + 4 шт.
объемы растворителя среды (следовательно, 1 + 4 = 5
= коэффициент разбавления). Фактор разбавления часто выражается
используя экспоненты: 1: 5 будет 5e-1; 1: 100 будет 10e-2, а
скоро.
Пример 1: Замороженный концентрат апельсинового сока обычно разбавляют с 4 дополнительными банками холодной воды (разбавляющий растворитель), давая коэффициент разбавления 5, т.е.е., оранжевый концентрат представляет собой одна единица объема, к которой вы добавили еще 4 банки (та же единица объемы) воды.
Итак, апельсиновый концентрат теперь распределяется через 5 единичных объемов. Это будет называться разбавлением 1: 5, и OJ сейчас на 1/5 меньше, чем было изначально. Так, при простом разбавлении добавить на одну единицу объема растворителя меньше чем желаемое значение коэффициента разбавления.
Пример 2: Предположим, вы должны приготовить 400 мл дезинфицирующего средства, требующего разведения 1: 8 из концентрированного маточный раствор с водой. Разделите необходимый объем на разведение коэффициент (400 мл / 8 = 50 мл) для определения объема единицы. В затем выполняется разведение в виде 50 мл концентрированного дезинфицирующего средства + 350 мл воды.
Верх стр.
2.Серийное разбавление
A серийное разведение — это просто серия
простых разведений, которые быстро увеличивают коэффициент разбавления
начиная с небольшого исходного количества материала (т. е. бактериального
культура, химикат, апельсиновый сок и др.). Источник разведения
материал (растворенное вещество) на каждом этапе происходит из разбавленного материала
предыдущего этапа разбавления. При серийном разведении всего коэффициент разбавления в любой момент равен произведению индивидуальные коэффициенты разбавления на каждом этапе, предшествующем этому.
е. бактериального
культура, химикат, апельсиновый сок и др.). Источник разведения
материал (растворенное вещество) на каждом этапе происходит из разбавленного материала
предыдущего этапа разбавления. При серийном разведении всего коэффициент разбавления в любой момент равен произведению индивидуальные коэффициенты разбавления на каждом этапе, предшествующем этому.
Пример: В типичном упражнении по микробиологии студенты выполнить трехэтапное серийное разведение 1: 100 бактериального культуры (см. рисунок ниже) в процессе количественной оценки количество жизнеспособных бактерий в культуре (см. рисунок ниже).Каждый шаг в этом примере использует общий объем 1 мл. Первый шаг объединяет 1 единицу объема бактериальной культуры (10 мкл) с 99 единицами объемы бульона (990 мкл) = разведение 1: 100.
На втором этапе одна единица объема разведения 1: 100 сочетается с 99 единиц объема бульона, что дает общее разведение 1: 100×100. = 1: 10 000 разведение. Снова повторил (третий шаг) сумма разбавление будет 1: 100×10 000 = 1: 1000000 общего разбавления.Концентрация бактерий теперь в миллион раз на меньше , чем в исходном образце.
Верх стр.
3. Изготовление фиксированных объемов определенных концентраций из жидких реагентов:
V1C1 = V2C2 Метод
Очень часто вам нужно будет сделать особый
объем известной концентрации из исходных растворов, или, возможно,
из-за ограниченной доступности жидких материалов (некоторые химические вещества
очень дороги и продаются и используются в небольших количествах,
е.г., микрограммы), или ограничить количество химических отходов.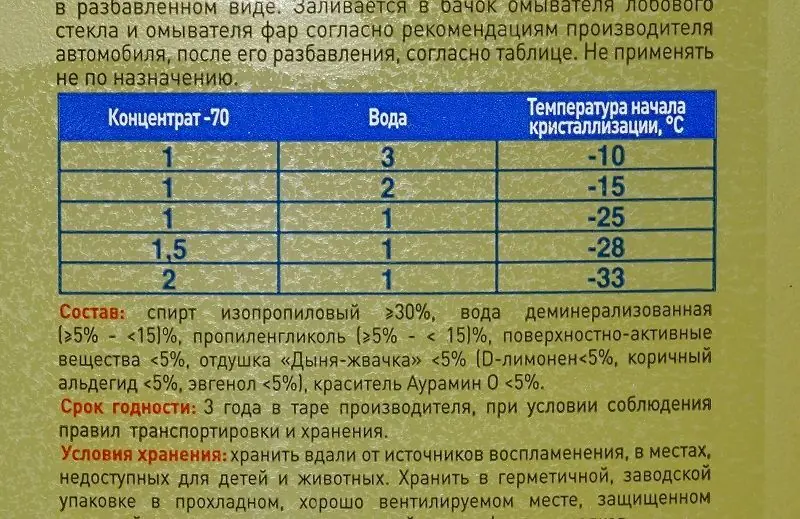 Приведенная ниже формула представляет собой быстрый подход к расчету таких разбавлений.
где:
Приведенная ниже формула представляет собой быстрый подход к расчету таких разбавлений.
где:
Пример: Предположим, у вас есть 3 мл основного раствора ампициллина 100 мг / мл. (= C 1 ), и вы хотите сделать 200 ul (= V 2 ) из раствор, имеющий 25 мг / мл (= C 2 ).Тебе следует знать какой объем ( V1 ) запаса для использования как часть необходимого общего объема 200 мкл.
V1 = объем запасов, с которого вы начнете. Это твое неизвестное.
C 1 = 100 мг / мл в исходном растворе
V 2 = общий объем, необходимый при новой концентрации = 200 мкл = 0,2 мл
C 2 = новая концентрация = 25 мг / мл
В алгебраической перестановке:
V1 = (V2 x C2) / C1
V1 = (0.
2 мл x 25 мг / мл) / 100 мг / мл
и после отмены ед.,
V1 = 0,05 мл, или 50 мкл
Итак, вы бы взяли 0,05 мл = 50 мкл. основного раствора и разбавьте его 150 мкл растворителя до получить 200 ул
Необходим раствор 25 мг / мл. Помните, что количество растворителя используется зависит от окончательного необходимого объема, поэтому вам нужно вычесть начальный объем формируют окончательный для его расчета.
Верх стр.
4. Моли и молярные растворы (единица = M = моль / л)
Иногда может быть более эффективным использовать молярность при выражении химических концентраций. моль определяется как точно 6,023 x 1023 атомов или молекул вещества (это называется Avagadro’s number , N). Масса одного моля элемента равна его атомной массе (г) и указывается для каждого элемента в периодической таблице. Молекулярная масса — это масса (г) вещества, основанная на суммированных атомных массах элементов в химической формуле. Вес формулы относится к химическим веществам, для которых не существует отдельных молекул; например, NaCl в твердой форме состоит из ионов Na + и Cl-, но настоящих молекул NaCl не существует. Формула вес 1 моля NaCl, следовательно, будет суммой 1 атомной массы каждого иона. Молекулярная масса (или FW) указывается на этикетке флакона с химическим веществом.Количество молей в произвольной массе элемента или соединения можно рассчитать как:
Масса одного моля элемента равна его атомной массе (г) и указывается для каждого элемента в периодической таблице. Молекулярная масса — это масса (г) вещества, основанная на суммированных атомных массах элементов в химической формуле. Вес формулы относится к химическим веществам, для которых не существует отдельных молекул; например, NaCl в твердой форме состоит из ионов Na + и Cl-, но настоящих молекул NaCl не существует. Формула вес 1 моля NaCl, следовательно, будет суммой 1 атомной массы каждого иона. Молекулярная масса (или FW) указывается на этикетке флакона с химическим веществом.Количество молей в произвольной массе элемента или соединения можно рассчитать как:
число молей = вес (г) / атомный (или молекулярный) вес (г)
Молярность (М) — это единица, используемая для описания количества молей элемента или соединения в одном литре (л) раствора (M = моль / л), и, следовательно, это единица измерения концентрации. Согласно этому определению 1,0 М раствор эквивалентен одной молекулярной массе (г / моль) соединения, доведенной до 1 литра (1.0 л) объема с растворителем (например, водой) при фиксированной температуре (жидкости расширяются и сжимаются с температурой и, таким образом, могут изменять молярность).
Согласно этому определению 1,0 М раствор эквивалентен одной молекулярной массе (г / моль) соединения, доведенной до 1 литра (1.0 л) объема с растворителем (например, водой) при фиксированной температуре (жидкости расширяются и сжимаются с температурой и, таким образом, могут изменять молярность).
Пример 1: Для приготовления литра молярного раствора из сухого реагента
Умножьте молекулярную массу (или FW) на желаемую молярность, чтобы определить, сколько граммов реагента использовать:
Предположим, что молекулярная масса соединения = 194,3 г / моль;
, чтобы получилось 0.15 М раствор использовать 194,3 г / моль * 0,15 моль / л = 29,145 г / л
Вы растворите указанную массу реагента во фракции общего объема растворителя (в стандартном режиме), а затем увеличите объем ровно до одного литра, добавив дополнительный растворитель и тщательно перемешав.
Пример 2 : Для приготовления определенного объема определенного молярного раствора из сухого реагента
Химическая масса имеет FW 180 г / моль, а вам нужно 25 мл (0.025 л) 0,15 М (М = моль / л) раствора. Сколько граммов химического вещества нужно для приготовления этого раствора?
# грамм / желаемый объем (л) = желаемая молярность (моль / л) * FW (г / моль)
путем алгебраической перестановки,
# граммы = желаемый объем (л) * желаемая молярность (моль / л) * FW (г / моль) # граммы = 0,025 л * 0,15 моль / л * 180 г / моль
после списания единиц,
#grams = 0.675 г
Итак, вам нужно 0,675 г / 25 мл
Растворы, содержащие несколько реагентов
Сложные растворы, такие как буферы, физиологические растворы, фиксаторы и т. Д., Могут состоять из нескольких химических реагентов. При приготовлении этих растворов каждый реагент рассматривается отдельно, чтобы определить, сколько использовать для приготовления окончательного раствора. Для каждого из них объем, использованный в расчетах, является окончательным необходимым объемом раствора.
Д., Могут состоять из нескольких химических реагентов. При приготовлении этих растворов каждый реагент рассматривается отдельно, чтобы определить, сколько использовать для приготовления окончательного раствора. Для каждого из них объем, использованный в расчетах, является окончательным необходимым объемом раствора.
Еще примеры решенных проблем: About.com: Химия
Верх
страницы
5. Процентные растворы (% = доли на сто или грамм / 100 мл)
Многие реагенты смешиваются в виде -процентных растворов либо по массе на объем (мас. / Об.) При запуске с сухими реагентами ИЛИ объема на объем (об. / Об.) При запуске с жидкими реагентами . При приготовлении растворов из сухих реагентов для получения заданной процентной концентрации используется одна и та же масса любого реагента, хотя молярные концентрации будут разными.
В целом
Массовый процент (мас. / Об.) = [масса растворенного вещества (г) / объем раствора (мл)] x 100, и,
Объемный процент (об. / Об.) = [объем растворенного вещества (мл) / объем раствора (мл)] x 100
Например, 100 мл 10% раствора любого сухого реагента будет содержать 10 г сухого реагента в конечном объеме 100 мл.10% (об. / Об.) Раствор должен содержать 10 мл растворенного вещества на 100 мл объема раствора.
Пример 1: Если вы хотите получить 200 мл 3% NaCl, вы должны необходимо 0,03 г / мл x 200 мл = 6,0 г NaCl в 200 мл воды.
При использовании жидких реагентов процентная концентрация основана на объема на объем , и рассчитывается аналогично как концентрация % x необходимый объем = используемый объем реагента .
Пример 2: Если вы хотите сделать 2 л 70% этанола из 100% этанола, вы должны смешать 0,70 мл / мл x 2000 мл = 1400 мл этанола с 600 мл воды.
Чтобы преобразовать% раствора в молярность , умножьте% раствора на 10, чтобы выразить процент раствора, грамм / л, затем разделите на вес формулы.
Молярность = (граммы реагента / 100 мл) * 10xxxxxxxxxx FW
Пример 1: преобразование 6.5% раствор химического вещества с FW = 325,6 к молярности,
[(6,5 г / 100 мл) * 10] / 325,6 г / моль = [65 г / л] / 325,6 г / моль = 0,1996 M
Преобразовать из молярности к процентному раствору , умножьте молярность на FW и разделите на 10:
% раствор = молярность * FWxxxxxxxxxx10
Пример 2: Преобразование 0.
[0,0045 моль / л * 178,7 г / моль] / 10 = 0,08 % раствор0045 М раствор химическое вещество, имеющее FW 178,7 к процентному раствору:
Верх стр.
6. Концентрированный стоковые растворы — в единицах «Х»
Стандартные растворы стабильной соединения обычно поддерживаются в лабораториях как более концентрированные растворы, которые могут быть разбавлены до рабочей прочности при использовании в Типичные области применения.Обычная рабочая концентрация обозначается как 1x. Раствор в 20 раз более концентрированный будет обозначен как 20x и потребует разбавления 1:20 для восстановления типичного рабочая концентрация.
Пример: 1x раствор соединения имеет молярную концентрацию 0,05 M для его типичного использования в лабораторных условиях.
Приклад 20x будет приготовлен в концентрации 20 * 0,05 М = 1.0 М. А Приклад 30X составит 30 * 0,05 M = 1,5 млн.
7. Нормальность (N): преобразование в молярность
Нормальность = n * M, где n = количество протонов (H +) в молекуле кислоты.
Пример: В формуле концентрированной серной кислоты (36 N h3SO4) протонов два, поэтому его молярность = N / 2. Итак, 36N h3SO4 = 36/2 = 18 М.
Модифицированный 9-27-12 га
Кафедра биологии, Колледж Бейтса, Льюистон, ME 04240
Расчеты разбавления исходных растворов в химии
Если вы работаете в химической лаборатории, важно знать, как рассчитать разведение.
Обзор растворов для разбавления, концентрирования и исходных растворов
Разбавление — это раствор, полученный путем добавления большего количества растворителя в более концентрированный раствор (основной раствор), что снижает концентрацию растворенного вещества.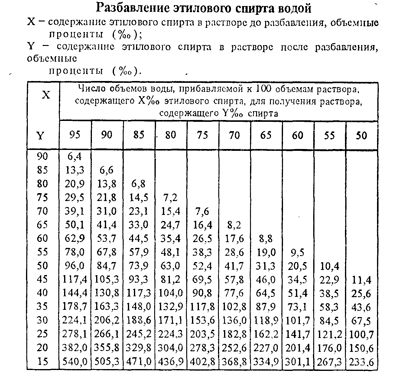 Примером разбавленного раствора является водопроводная вода, которая в основном состоит из воды (растворителя) с небольшим количеством растворенных минералов и газов (растворенных веществ).
Примером разбавленного раствора является водопроводная вода, которая в основном состоит из воды (растворителя) с небольшим количеством растворенных минералов и газов (растворенных веществ).
Пример концентрированного раствора — 98-процентная серная кислота (~ 18 М). Основная причина, по которой вы начинаете с концентрированного раствора, а затем разбавляете его, чтобы сделать разбавление, заключается в том, что очень сложно — а иногда и невозможно — точно измерить растворенное вещество для приготовления разбавленного раствора, поэтому будет большая степень ошибки в значении концентрации. .
Используйте закон сохранения массы, чтобы выполнить расчет разбавления:
Разведение M V разбавление = M запас V запас
Пример разбавления
Например, предположим, что вам нужно приготовить 50 миллилитров 1,0 М раствора из 2,0 М исходного раствора. Ваш первый шаг — рассчитать необходимый объем основного раствора.
Разведение M V разбавление = M запас V запас
(1.0 M) (50 мл) = (2,0 M) (x мл)
x = [(1,0 M) (50 мл)] / 2,0 M
x = 25 мл исходного раствора
Для приготовления раствора налейте 25 мл основного раствора в мерную колбу на 50 мл. Разбавьте его растворителем до линии 50 мл.
Избегайте этой распространенной ошибки при разбавлении
Распространенной ошибкой является добавление слишком большого количества растворителя при разбавлении. Убедитесь, что вы налили концентрированный раствор в колбу, а затем разбавили его до метки объема. Например, не смешивайте 250 мл концентрированного раствора с 1 литром растворителя, чтобы получить 1-литровый раствор.
мл раствора имеют концентрацию 3,0 М. Сколько воды нужно добавить, чтобы разбавить раствор до 1,9 М?
Как известно, разведение используется для уменьшения на концентрации данного раствора. (цвет (красный) («количество молей растворенного вещества в разбавленном решение »)) #
(цвет (красный) («количество молей растворенного вещества в разбавленном решение »)) #
Здесь
# c_1 #, # V_1 # — молярность и объем концентрированного раствора
# c_2 #, # V_2 # — молярность и объем разбавленного раствора
Теперь вы можете изменить это уравнение, чтобы найти
# c_1V_1 = c_2V_2 подразумевает c_1 / c_2 = V_2 / V_1 #
Это дает вам коэффициент разбавления раствора , # «D.F. «#, Который сообщает вам, насколько концентрированный основной раствор был по сравнению с разбавленным раствором
# цвет (синий) (| bar (ul (цвет (белый) (a / a) «D.F.» = C_1 / c_2 = V_2 / V_1color (белый) (a / a) |))) #
В вашем случае концентрация раствора уменьшается с # «3,0 M» # до # ‘1,9 M «#, что означает, что коэффициент разбавления равен
# «Д.Ф.» = (3.0 цвет (красный) (отмена (цвет (черный) («M»)))) / (1.
9color (красный) (отмена (цвет (черный) («M»)))) = 1.58 #
Итак, если исходный раствор был в 1.58 # раз более концентрированным , чем разбавленный раствор, из этого следует, что объем разбавленного раствора должен был увеличиться на в # 1.58 #
раз.# «Д.Ф.» = V_2 / V_1 подразумевает цвет (фиолетовый) (| bar (ul (цвет (белый) (a / a) цвет (черный) (V_2 = «DF» xx V_1) цвет (белый) (a / a) |))) #
Следовательно, общий объем разбавленного раствора должен быть равен
# V_2 = 1.58 * «800. mL» = «1264 мл» #
Таким образом, необходимый объем воды составит
.# V_2 = V_1 + V_ «вода» #
#V_ «вода» = «1264 мл» — «800. мл» = «464 мл» #
Я оставлю ответ округленным до трех sig figs , несмотря на то, что у вас есть только два sig fig для концентрации двух растворов
#V_ «вода» = цвет (зеленый) (| bar (ul (цвет (белый) (a / a) «464 мл» цвет (белый) (a / a) |))) #
Разведений растворов | Введение в химию
Цель обучения
- Рассчитайте концентрацию разбавленного раствора.

Ключевые моменты
- Чаще всего концентрация раствора выражается в процентах по массе, мольной доле, молярности, моляльности и нормальности. При расчете коэффициентов разбавления важно, чтобы единицы объема и концентрации оставались согласованными.
- Расчеты разбавления могут быть выполнены по формуле M 1 V 1 = M 2 V 2 .
- Серийное разведение — это серия пошаговых разведений, где коэффициент разбавления поддерживается постоянным на каждом этапе.
Условия
- разбавленный раствор, в который был добавлен дополнительный растворитель, например вода, чтобы сделать его менее концентрированным .
- серийные разведения: пошаговое разведение вещества в растворе
Разбавление относится к процессу добавления дополнительного растворителя к раствору для уменьшения его концентрации. Этот процесс поддерживает постоянное количество растворенного вещества, но увеличивает общее количество раствора, тем самым уменьшая его конечную концентрацию.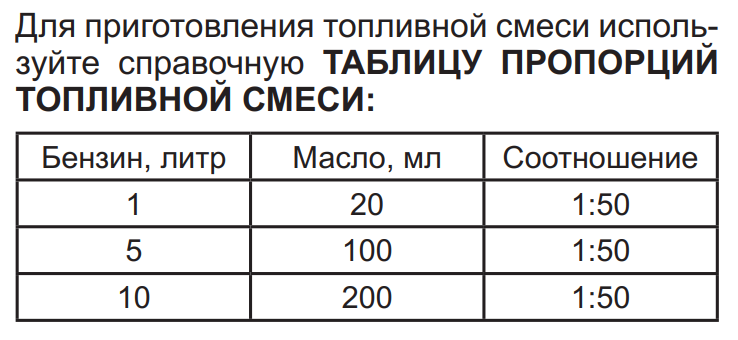 Разбавление также может быть достигнуто путем смешивания раствора более высокой концентрации с идентичным раствором меньшей концентрации. Разбавление растворов — необходимый процесс в лаборатории, так как исходные растворы часто покупаются и хранятся в очень концентрированных формах. Чтобы растворы можно было использовать в лаборатории (например, для титрования), они должны быть точно разбавлены до известной, меньшей концентрации.
Разбавление также может быть достигнуто путем смешивания раствора более высокой концентрации с идентичным раствором меньшей концентрации. Разбавление растворов — необходимый процесс в лаборатории, так как исходные растворы часто покупаются и хранятся в очень концентрированных формах. Чтобы растворы можно было использовать в лаборатории (например, для титрования), они должны быть точно разбавлены до известной, меньшей концентрации.
Объем растворителя, необходимый для приготовления нового разбавленного раствора желаемой концентрации, можно рассчитать математически.Отношения следующие:
[латекс] M_1V_1 = M_2V_2 [/ латекс]
M 1 обозначает концентрацию исходного раствора, а V1 обозначает объем исходного раствора; M 2 представляет собой концентрацию разбавленного раствора, а V2 представляет собой конечный объем разбавленного раствора. При расчете коэффициентов разбавления важно, чтобы единицы объема и концентрации были одинаковыми для обеих сторон уравнения.
Пример
- 175 мл 1.6 М водный раствор LiCl разбавляют водой до конечного объема 1,0 л. Какова конечная концентрация разбавленного раствора?
- [латекс] M_1V_1 = M_2V_2 [/ латекс]
- (1,6 M) (175 мл) = M 2 (1000 мл)
- M 2 = 0,28 M
Серийные разведения
Серийные разведения включают разведение исходного раствора или стандартного раствора несколько раз подряд.Обычно коэффициент разбавления остается постоянным для каждого разбавления, что приводит к экспоненциальному снижению концентрации. Например, десятикратное серийное разведение может привести к следующим концентрациям: 1 M, 0,1 M, 0,01 M, 0,001 M и так далее. Как видно из этого примера, на каждом этапе концентрация снижается в десять раз. Последовательные разведения используются для точного создания чрезвычайно разбавленных растворов, а также растворов для экспериментов, требующих кривой концентрации с экспоненциальной или логарифмической шкалой.Серийные разведения широко используются в экспериментальных науках, включая биохимию, фармакологию, микробиологию и физику.
Последовательные разведения используются для точного создания чрезвычайно разбавленных растворов, а также растворов для экспериментов, требующих кривой концентрации с экспоненциальной или логарифмической шкалой.Серийные разведения широко используются в экспериментальных науках, включая биохимию, фармакологию, микробиологию и физику.
Boundless проверяет и курирует высококачественный контент с открытой лицензией из Интернета.Этот конкретный ресурс использовал следующие источники:
Концентрация раствора | Безграничная химия
Разведений растворов
Разбавление раствора включает добавление дополнительного растворителя для уменьшения концентрации раствора.
Цели обучения
Рассчитайте концентрацию разбавленного раствора.
Ключевые выводы
Ключевые моменты
- Чаще всего концентрация раствора выражается в массовых процентах, мольных долях, молярности, моляльности и нормальности.При расчете коэффициентов разбавления важно, чтобы единицы объема и концентрации оставались согласованными.
- Расчеты разбавления могут быть выполнены по формуле M 1 V 1 = M 2 V 2 .
- Серийное разведение — это серия пошаговых разведений, где коэффициент разбавления поддерживается постоянным на каждом этапе.
Ключевые термины
- разбавление : раствор, в который был добавлен дополнительный растворитель, например вода, чтобы сделать его менее концентрированным
- серийное разведение : ступенчатое разведение вещества в растворе
Разбавление — это процесс добавления в раствор дополнительного растворителя для уменьшения его концентрации.Этот процесс поддерживает постоянное количество растворенного вещества, но увеличивает общее количество раствора, тем самым уменьшая его конечную концентрацию. Разбавление также может быть достигнуто путем смешивания раствора более высокой концентрации с идентичным раствором меньшей концентрации. Разбавление растворов — необходимый процесс в лаборатории, так как исходные растворы часто покупаются и хранятся в очень концентрированных формах. Чтобы растворы можно было использовать в лаборатории (например, для титрования), они должны быть точно разбавлены до известной, меньшей концентрации.
Разбавление также может быть достигнуто путем смешивания раствора более высокой концентрации с идентичным раствором меньшей концентрации. Разбавление растворов — необходимый процесс в лаборатории, так как исходные растворы часто покупаются и хранятся в очень концентрированных формах. Чтобы растворы можно было использовать в лаборатории (например, для титрования), они должны быть точно разбавлены до известной, меньшей концентрации.
Объем растворителя, необходимый для приготовления нового разбавленного раствора желаемой концентрации, можно рассчитать математически. Отношения следующие:
[латекс] \ text {M} _1 \ text {V} _1 = \ text {M} _2 \ text {V} _2 [/ latex]
M 1 обозначает концентрацию исходного раствора, а V1 обозначает объем исходного раствора; M 2 представляет собой концентрацию разбавленного раствора, а V2 представляет собой конечный объем разбавленного раствора.При расчете коэффициентов разбавления важно, чтобы единицы объема и концентрации были одинаковыми для обеих сторон уравнения.
Пример
- 175 мл 1,6 М водного раствора LiCl разбавляют водой до конечного объема 1,0 л. Какова конечная концентрация разбавленного раствора?
- [латекс] \ text {M} _1 \ text {V} _1 = \ text {M} _2 \ text {V} _2 [/ латекс]
- (1,6 M) (175 мл) = M 2 (1000 мл)
- M 2 = 0.28 M
Разведения : Разведения иногда можно наблюдать визуально. На изображении выше интенсивный красный цвет медленно исчезает по мере того, как раствор становится более разбавленным.
Серийные разведения
Серийные разведения включают разведение исходного раствора или стандартного раствора несколько раз подряд. Обычно коэффициент разбавления остается постоянным для каждого разбавления, что приводит к экспоненциальному снижению концентрации. Например, десятикратное серийное разведение может привести к следующим концентрациям: 1 M, 0.1 M, 0,01 M, 0,001 M и т. Д. Как видно из этого примера, на каждом этапе концентрация снижается в десять раз. Последовательные разведения используются для точного создания чрезвычайно разбавленных растворов, а также растворов для экспериментов, требующих кривой концентрации с экспоненциальной или логарифмической шкалой. Серийные разведения широко используются в экспериментальных науках, включая биохимию, фармакологию, микробиологию и физику.
Д. Как видно из этого примера, на каждом этапе концентрация снижается в десять раз. Последовательные разведения используются для точного создания чрезвычайно разбавленных растворов, а также растворов для экспериментов, требующих кривой концентрации с экспоненциальной или логарифмической шкалой. Серийные разведения широко используются в экспериментальных науках, включая биохимию, фармакологию, микробиологию и физику.
Решение проблем разбавления в химии раствора ЯСНО И ПРОСТО — YouTube : В этом видео показано, как решить две задачи разбавления, используя стандартную формулу разбавления M 1 V 1 = M 2 V 2 .
Использование молярности в расчетах растворов
Молярность — это единица концентрации; он равен молям растворенного вещества, деленным на общий объем раствора в литрах.
Цели обучения
Переведите между молярностью, граммами растворенного вещества в растворе и объемом раствора.
Ключевые выводы
Ключевые моменты
- Молярная концентрация, также называемая молярностью, — это количество молей растворенного вещества на литр раствора.Молярность — наиболее распространенное измерение концентрации раствора.
- Поскольку молярность измеряется в моль / л, мы часто используем эту единицу для стехиометрических расчетов, чтобы определить количество химического вещества в данной смеси.
- Не путайте моль с молярностью: молярность — это мера концентрации, а моль — мера количества вещества.
Ключевые термины
- молярность : Концентрация вещества в растворе, выраженная в количестве молей растворенного вещества на литр раствора.
- раствор : гомогенная смесь жидкости, газа или твердого вещества, образованная растворением одного или нескольких веществ
- моль :
Молярность
В химии молярная концентрация или молярность определяется как количество молей растворенного вещества на общее количество литров раствора. Это важное различие; объем в определении молярности относится к объему раствора , а не к объему растворителя. Причина этого в том, что один литр раствора обычно содержит чуть больше или чуть меньше 1 литра растворителя из-за присутствия растворенного вещества.Единица измерения молярности в системе СИ — моль / м 3 ; однако вы почти всегда будете встречать молярность в единицах моль / л. Раствор с концентрацией 1 моль / л также обозначается как «1 молярный» (1 М). Мол / л также можно записать следующими способами (однако чаще всего используется моль / л или просто М):
Это важное различие; объем в определении молярности относится к объему раствора , а не к объему растворителя. Причина этого в том, что один литр раствора обычно содержит чуть больше или чуть меньше 1 литра растворителя из-за присутствия растворенного вещества.Единица измерения молярности в системе СИ — моль / м 3 ; однако вы почти всегда будете встречать молярность в единицах моль / л. Раствор с концентрацией 1 моль / л также обозначается как «1 молярный» (1 М). Мол / л также можно записать следующими способами (однако чаще всего используется моль / л или просто М):
1 моль / л = 1 M = 1 моль / дм 3 = 1 моль дм −3 = 1000 моль / м 3
Важно отличать родинки от молярности; молярность — это мера концентрации, в то время как моль — мера количества вещества, присутствующего в данный момент.
Молярность : Молярность — это мера концентрации в единицах моль растворенного вещества на литр раствора.
Использование молярности в расчетах с решениями
Молярность может использоваться в различных расчетах с использованием растворов. Следующая формула очень полезна, поскольку она связывает молярность раствора, общий объем раствора (в литрах) и количество молей растворенного вещества:
[латекс] \ text {MV} = \ text {mol} [/ latex]
Пример 1
Студент набирает пипеткой 100 мл пробы 1.5 М раствор бромида калия. Сколько молей бромида калия содержится в образце?
[латекс] \ text {MV} = \ text {mol} [/ latex]
(1,5 M) (0,100 л) =
мольмоль = 0,15 моль KBr
Обратите внимание, что в приведенном выше примере объем должен быть преобразован в л из мл.
Вы можете заметить, что приведенная выше формула имеет некоторое сходство с нашей формулой разбавления :
[латекс] \ text {M} _1 \ text {V} _1 = \ text {M} _2 \ text {V} _2 [/ latex]
Поскольку теперь мы знаем, что MV = моль, мы можем упростить нашу формулу разбавления до следующего:
[латекс] \ text {mol} _1 = \ text {mol} _2 [/ latex]
Это не должно нас удивлять.В конце концов, при любом разбавлении изменяется количество растворителя, в то время как количество молей растворенного вещества остается постоянным на всем протяжении.
Пример 2
Какова молярность раствора, содержащего 0,32 моль NaCl в 3,4 л раствора?
[латекс] \ text {M} = \ frac {0,32 \ text {моль NaCl}} {3,4 \ text {L раствор}} = {0,094 \ text {M NaCl}} [/ латекс]
Практические проблемы молярности — YouTube : Это видео демонстрирует практические задачи с молярностью, вычислением молей и литров для определения молярной концентрации.Он также использует коэффициенты преобразования для преобразования граммов в моль и между миллилитрами и литрами.
Проблемы практики молярности (часть 2) — YouTube : Используйте молярность для преобразования массы и объема в растворе. В этом видео показано, как использовать молярность в качестве коэффициента преобразования. Если вам известна молярность, вы можете определить количество молей или объем раствора. Кроме того, молярность — это соотношение, которое описывает количество молей растворенного вещества на литр раствора.
Стехиометрия раствора
Стехиометрия может использоваться для расчета количественных соотношений между видами в водном растворе.
Цели обучения
Рассчитывайте концентрации растворов по молярности, моляльности, мольной доле и процентам по массе и объему.
Ключевые выводы
Ключевые моменты
- Стехиометрия определяет относительные количества реагентов и продуктов в химических реакциях. Его можно использовать для определения количества продуктов из данных реагентов в сбалансированной химической реакции, а также процентного выхода.
- Чтобы рассчитать количество продукта, рассчитайте количество молей для каждого реагента. Моли продукта равны молям ограничивающего реагента в однозначной стехиометрии реакции. Чтобы найти массу продукта, нужно умножить количество молей на молекулярную массу продукта.
- В стехиометрических расчетах растворов в качестве коэффициента пересчета часто используется заданная концентрация раствора.
Ключевые термины
- стехиометрия : исследование и расчет количественных (измеримых) соотношений реагентов и продуктов в химических реакциях (химические уравнения)
- молярность : концентрация вещества в растворе, выраженная как количество молей растворенного вещества на литр раствора
- моляльность : концентрация вещества в растворе, выраженная как количество молей растворенного вещества на килограмм растворителя
Концентрация растворов
Напомним, что раствор состоит из двух компонентов: растворенного вещества (растворенного вещества) и растворителя (жидкости, в которой растворено растворенное вещество).Количество растворенного вещества в данном количестве раствора или растворителя известно как концентрация. Двумя наиболее распространенными способами выражения концентрации являются молярность и молярность.
Молярность
Молярная концентрация (M) раствора определяется как количество молей растворенного вещества (n) на литр раствора (т.е. объем, раствор V ):
[латекс] \ text {M} = \ frac {\ text {n}} {\ text {V} _ {\ text {solution}}} [/ latex]
Единицы измерения молярности — моль / л, часто сокращенно M .
Например, количество молей NaCl в 0,123 л 1,00 М раствора NaCl можно рассчитать следующим образом:
[латекс] 0,123 \ text {л раствора} \ times \ frac {1,00 \ text {моль}} {1,00 \ text {л раствора}} = 0,123 \ text {моль NaCl} [/ латекс]
Моляльность
Молярная концентрация (m) раствора определяется как количество молей растворенного вещества (n) на килограмм растворителя (т.е. масса растворителя, m растворителя ):
[латекс] \ text {m} = \ frac {\ text {n}} {\ text {m} _ {\ text {растворитель}}} [/ латекс]
Единицы моляльности — моль / кг, или м .
Например, количество молей NaCl, растворенных в 0,123 кг H 2 O (растворитель), чтобы приготовить 1,00 м раствор NaCl, можно рассчитать следующим образом:
[латекс] 0,123 \ text {кг растворителя} \ times \ frac {1,00 \ text {моль}} {1,00 \ text {кг растворителя}} = 0,123 \ text {моль NaCl} [/ латекс]
Стехиометрия реакций в растворах
Мы можем выполнять стехиометрические расчеты для реакций в водной фазе так же, как и для реакций в твердой, жидкой или газовой фазах.Почти всегда в наших расчетах мы будем использовать концентрации растворов в качестве коэффициентов преобразования .
Пример
- 123 мл 1,00 М раствора NaCl смешивают с 72,5 мл 2,71 М раствора AgNO 3 . Какова масса AgCl (ов), образовавшихся в результате реакции осаждения?
Кристаллы хлорида серебра (AgCl) : Стехиометрия определяет относительные количества реагентов и продуктов в химических реакциях.Его можно использовать для определения количества продуктов из данных реагентов в сбалансированной химической реакции, а также процентного выхода.
Во-первых, нам нужно выписать наше сбалансированное уравнение реакции:
[латекс] \ text {AgNO} _3 (aq) + \ text {NaCl} (aq) \ rightarrow \ text {AgCl} (s) + \ text {NaNO} _3 (aq) [/ latex]
Следующим шагом, как и в любом расчете, включающем стехиометрию, является определение нашего предельного реагента. Мы можем сделать это, преобразовав оба наших реагента в моль:
[латекс] \ text {123 мл NaCl} \ times \ frac {\ text {1 L}} {\ text {1000 мл}} \ times \ frac {\ text {1.00 моль NaCl}} {\ text {1 L}} = \ text {0,123 моль NaCl} [/ латекс]
[латекс] \ text {72,5 мл AgNO} _3 \ times \ frac {\ text {1 L}} {\ text {1000 мл}} \ times \ frac {\ text {2,71 моль AgNO} _3} {\ text { 1 л}} = \ text {0,196 моль AgNO} _3 [/ латекс]
Из нашего уравнения реакции видно, что AgNO3 и NaCl реагируют в соотношении 1: 1. Поскольку в растворе присутствует меньше молей NaCl, NaCl является нашим ограничивающим реагентом. Теперь мы можем найти массу образовавшегося AgCl:
[латекс] \ text {123 мл NaCl} \ times \ frac {\ text {1 L}} {\ text {1000 мл}} \ times \ frac {\ text {1.00 моль NaCl}} {\ text {1 л}} \ times \ frac {\ text {1 моль AgCl}} {\ text {1 моль NaCl}} \ times \ frac {\ text {143 г}} {\ text {1 моль AgCl}} = \ text {17,6 г AgCl} [/ латекс]
Следовательно, в реакции образуется 17,6 г AgCl ( s ).
Подводя итог: мы пересчитали в моли каждого реагента, используя данные концентрации в качестве коэффициентов пересчета, выражая молярность как моль / л; как только мы нашли наш ограничивающий реагент, мы преобразовали его в граммы образовавшегося AgCl.
| Шаг | Описание | Расчет |
|---|---|---|
| 1 | Разбавляемый раствор находится в сосуде, таком как мерная колба.Этот раствор называется исходным. Чтобы предотвратить загрязнение этого исходного раствора, поместите его небольшое количество в чистую, сухую коническую колбу (колбу Эрленмейера), перемешайте и затем соответствующим образом выбросьте этот раствор. НЕ используйте воду или какой-либо другой растворитель для ополаскивания колбы, потому что добавление большего количества растворителя приведет к разбавлению раствора, и мы больше не будем знать, какова его концентрация. Налейте немного основного раствора в промытую коническую колбу. Закрывайте коническую колбу, когда вы не используете ее, чтобы предотвратить загрязнение из атмосферы. Пометьте его датой, формулой раствора и его концентрацией, например [NaCl (aq)] = 0,10 моль л -1 Запишите концентрацию этого неразбавленного исходного раствора как c 1 в моль л -1 | c 1 = [неразбавленный раствор] моль л -1 |
| 2 | Вам понадобится чистая, сухая пипетка известного объема. Это будет напечатано на пипетке, например 10,00 мл, 25,00 мл и т. Д. Используйте наполнитель для пипетки (грушу), чтобы набрать небольшое количество исходного раствора из конической колбы, выньте пипетку из раствора, перемешайте раствор в пипетке, чтобы промыть его, а затем удалите этот раствор соответствующим образом. НЕ используйте воду или какой-либо другой растворитель для промывки пипетки, потому что вы будете разбавлять раствор, и мы больше не будем знать, какова его концентрация. Поместите промытую пипетку в основной раствор в конической колбе и набирайте раствор, пока он не превысит уровень, отмеченный на пипетке. Выньте пипетку из основного раствора. Подвешивали пипетку в пределах стакана. Дайте раствору вытечь из пипетки капля за каплей, пока нижняя часть мениска (если смотреть на уровне глаз) не окажется на уровне, отмеченном на пипетке. Вам необходимо записать объем неразбавленного исходного раствора, находящегося в пипетке. Рекомендуется преобразовать этот объем в миллилитрах (мл) в объем в литрах (л), если ваша концентрация моль л -1 (молярность): объем в л = объем в мл ÷ 1000 Запишите объем этой пипетки как V 1 , например, V (NaCl) 1 = 10,00 мл = 10,00 / 1000 = 0,0100 л V 1 = [объем неразбавленного раствора в пипетке] л | V 1 = V (неразбавленный раствор) L |
| 3 | Расположите пипетку так, чтобы кончик пипетки совпадал с внутренней горловиной чистой мерной колбы под углом. Дайте раствору из пипетки вытечь и стечь по горлышку мерной колбы в ее корпус. Пипетки обычно предназначены для подачи известного объема, это означает, что небольшая капля раствора, остающаяся на кончике пипетки, должна быть там, поэтому не пытайтесь ее выдуть. Теперь у нас есть известный объем неразбавленного исходного раствора с известной концентрацией в этой мерной колбе. Рассчитайте количество молей растворенного вещества, n (растворенного вещества), содержащегося в этой мерной колбе. моль растворенного вещества (моль) = концентрация раствора (моль л -1 ) × объем раствора, доставленного из пипетки (л) n (растворенное вещество) = c 1 × V 1 Запишите количество молей растворенного вещества, n (растворенное вещество) в молях. | n (растворенное вещество) = c 1 × V 1 моль |
| 4 | Вставьте стеклянную воронку в горлышко мерной колбы. Когда вы наливаете свой растворитель, например воду, в воронку, оставьте небольшой воздушный зазор между штоком воронки и горлышком мерной колбы, чтобы растворитель мог свободно течь. Когда растворитель достигнет основания горловины мерной колбы, прекратите заливку и дайте возможность растворителю, оставшемуся в воронке, вытечь. Медленно и осторожно добавляйте больше растворителя, пока дно мениска не окажется примерно на 1 см от уровня, отмеченного на горлышке мерной колбы, если смотреть на уровне глаз. Используйте чистую пипетку Пастера, промытую растворителем, чтобы добавлять по каплям растворитель в мерную колбу, пока дно мениска не окажется точно на уровне, отмеченном на горлышке колбы, если смотреть на уровне глаз. Пробка мерной колбы. Запишите объем разбавленного раствора в мерной колбе как V 2 в мл. Преобразуйте объем в миллилитрах в объем в литрах, разделив его на 1000. Запишите этот том как V 2 L. | V 2 = [разбавленный раствор] л |
| 5 | Рассчитайте концентрацию разбавленного раствора, c 2 : концентрация разбавленного раствора = моль растворенного вещества ÷ объем разбавленного раствора молярность разбавленного раствора (моль л -1 ) = моль растворенного вещества (моль) ÷ объем разбавленного раствора (л) c 2 = n (растворенное вещество) ÷ V 2 Прикрепите этикетку к мерной колбе с указанием даты приготовления раствора, его формулы и концентрации. | |

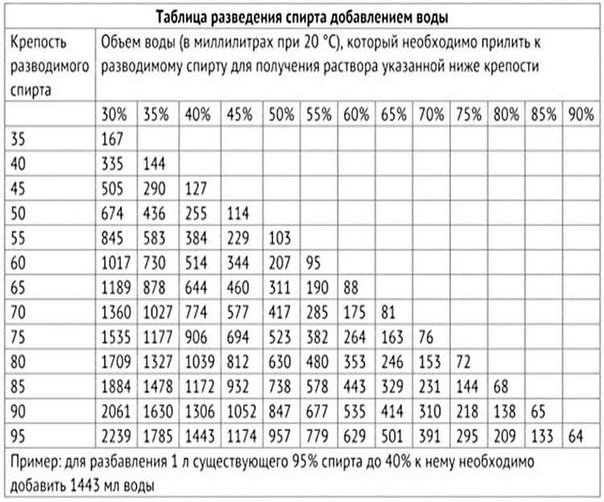 Берем, естественно, этиловый спирт, который пригоден для употребления внутрь. Как вы знаете, есть еще метиловый (технический) спирт, который является ядом. У него совсем другие задачи и его брать не надо. Даже даром.
Берем, естественно, этиловый спирт, который пригоден для употребления внутрь. Как вы знаете, есть еще метиловый (технический) спирт, который является ядом. У него совсем другие задачи и его брать не надо. Даже даром.

 Большинство именитых производителей рекомендует применять только собственное масло. В случае возникновения гарантийного случая, если сервис обнаружит что вы заправляли другую марку масла, он имеет полное право отказать в бесплатном обслуживании.
Большинство именитых производителей рекомендует применять только собственное масло. В случае возникновения гарантийного случая, если сервис обнаружит что вы заправляли другую марку масла, он имеет полное право отказать в бесплатном обслуживании. Старайтесь покупать 2Т масло в специализированных магазинах у официальных дилеров.
Старайтесь покупать 2Т масло в специализированных магазинах у официальных дилеров. Если остался старый излишек, его следует утилизировать, даже тот который остался в баке бензопилы или бензотриммера.
Если остался старый излишек, его следует утилизировать, даже тот который остался в баке бензопилы или бензотриммера. Плюс, закоксованная окалина из глушителя может вылететь в цилиндр — опять ремонт поршневой.
Плюс, закоксованная окалина из глушителя может вылететь в цилиндр — опять ремонт поршневой.

 Итак, апельсиновый концентрат теперь распределяется
через 5 единичных объемов. Это будет называться разбавлением 1: 5,
и OJ сейчас на 1/5 меньше, чем было изначально. Так,
при простом разбавлении добавить на одну единицу объема растворителя меньше чем желаемое значение коэффициента разбавления.
Итак, апельсиновый концентрат теперь распределяется
через 5 единичных объемов. Это будет называться разбавлением 1: 5,
и OJ сейчас на 1/5 меньше, чем было изначально. Так,
при простом разбавлении добавить на одну единицу объема растворителя меньше чем желаемое значение коэффициента разбавления. На втором этапе
одна единица объема разведения 1: 100 сочетается с
99 единиц объема бульона, что дает общее разведение 1: 100×100.
= 1: 10 000 разведение. Снова повторил (третий шаг) сумма
разбавление будет 1: 100×10 000 = 1: 1000000 общего разбавления.Концентрация бактерий теперь в миллион раз на меньше , чем в исходном образце.
На втором этапе
одна единица объема разведения 1: 100 сочетается с
99 единиц объема бульона, что дает общее разведение 1: 100×100.
= 1: 10 000 разведение. Снова повторил (третий шаг) сумма
разбавление будет 1: 100×10 000 = 1: 1000000 общего разбавления.Концентрация бактерий теперь в миллион раз на меньше , чем в исходном образце.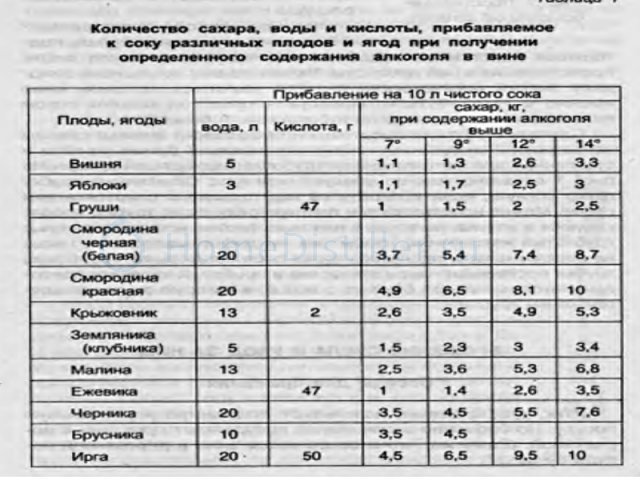 2
мл x 25 мг / мл) / 100 мг / мл
2
мл x 25 мг / мл) / 100 мг / мл 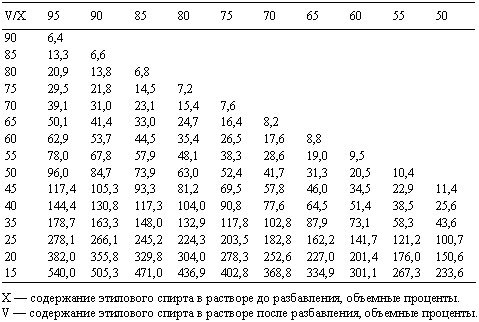
 0045 М раствор
химическое вещество, имеющее FW 178,7 к процентному раствору:
0045 М раствор
химическое вещество, имеющее FW 178,7 к процентному раствору: Приклад 20x
будет приготовлен в концентрации 20 * 0,05 М = 1.0 М. А
Приклад 30X составит 30 * 0,05 M = 1,5 млн.
Приклад 20x
будет приготовлен в концентрации 20 * 0,05 М = 1.0 М. А
Приклад 30X составит 30 * 0,05 M = 1,5 млн.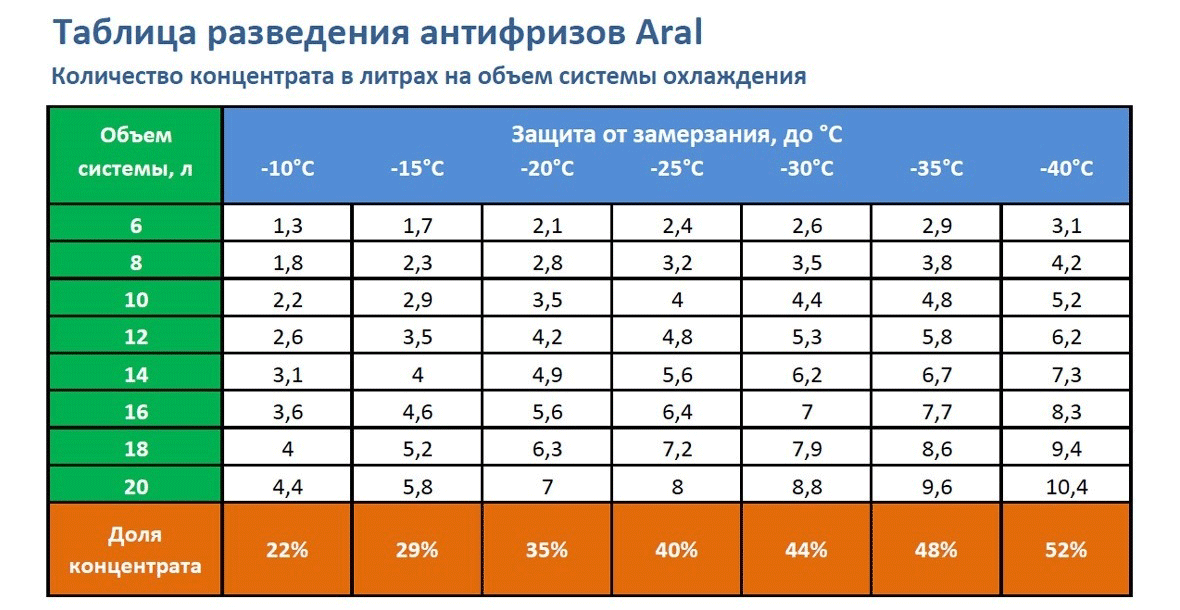 9color (красный) (отмена (цвет (черный) («M»)))) = 1.58 #
9color (красный) (отмена (цвет (черный) («M»)))) = 1.58 #