PhysBook:Электронный учебник физики — PhysBook
Содержание
- 1 Учебники
-
2 Механика
- 2.1 Кинематика
- 2.2 Динамика
- 2.3 Законы сохранения
- 2.4 Статика
- 2.5 Механические колебания и волны
-
3 Термодинамика и МКТ
- 3.1 МКТ
 2 Термодинамика
2 Термодинамика
-
4 Электродинамика
- 4.1 Электростатика
- 4.2 Электрический ток
- 4.3 Магнетизм
- 4.4 Электромагнитные колебания и волны
-
5 Оптика. СТО
- 5.1 Геометрическая оптика
- 5.2 Волновая оптика
-
5.
 3 Фотометрия
3 Фотометрия
- 5.4 Квантовая оптика
- 5.5 Излучение и спектры
- 5.6 СТО
-
6 Атомная и ядерная
- 6.1 Атомная физика. Квантовая теория
- 6.2 Ядерная физика
- 7 Общие темы
- 8 Новые страницы
Здесь размещена информация по школьной физике:
- материалы из учебников, лекций, рефератов, журналов;
- разработки уроков, тем;
- flash-анимации, фотографии, рисунки различных физических процессов;
- ссылки на другие сайты
и многое другое.
Каждый зарегистрированный пользователь сайта имеет возможность выкладывать свои материалы (см. справку), обсуждать уже созданные.
Учебники
Формулы по физике – 7 класс – 8 класс – 9 класс – 10 класс – 11 класс –
Механика
Кинематика
Основные понятия кинематики – Прямолинейное движение – Криволинейное движение – Движение в пространстве
Динамика
Законы Ньютона – Силы в механике – Движение под действием нескольких сил
Законы сохранения
Закон сохранения импульса – Закон сохранения энергии
Статика
Статика твердых тел – Динамика твердых тел – Гидростатика – Гидродинамика
Механические колебания и волны
Механические колебания – Механические волны
Термодинамика и МКТ
МКТ
Основы МКТ – Газовые законы – МКТ идеального газа
Термодинамика
Первый закон термодинамики – Второй закон термодинамики – Жидкость-газ – Поверхностное натяжение – Твердые тела – Тепловое расширение
Электродинамика
Электростатика
Электрическое поле и его параметры – Электроемкость
Электрический ток
Постоянный электрический ток – Электрический ток в металлах – Электрический ток в жидкостях – Электрический ток в газах – Электрический ток в вакууме – Электрический ток в полупроводниках
Магнетизм
Магнитное поле – Электромагнитная индукция
Электромагнитные колебания и волны
Электромагнитные колебания – Производство и передача электроэнергии – Электромагнитные волны
Оптика.
 СТО
СТОГеометрическая оптика
Прямолинейное распространение света. Отражение света – Преломление света – Линзы
Волновая оптика
Свет как электромагнитная волна – Интерференция света – Дифракция света
Фотометрия
Фотометрия
Квантовая оптика
Квантовая оптика
Излучение и спектры
Излучение и спектры
СТО
СТО
Атомная и ядерная
Атомная физика. Квантовая теория
Строение атома – Квантовая теория – Излучение атома
Ядерная физика
Атомное ядро – Радиоактивность – Ядерные реакции – Элементарные частицы
Общие темы
Измерения – Методы решения – Развитие науки- Статья- Как писать введение в реферате- Подготовка к ЕГЭ — Репетитор по физике
Новые страницы
Запрос не дал результатов.
Мерой изменения кинетической энергии тела является работа внешних сил.
Ваш ответ
| Отображаемое имя (по желанию): |
| Отправить мне письмо на это адрес если мой ответ выбран или прокомментирован:Отправить мне письмо если мой ответ выбран или прокомментирован |
Конфиденциальность: Ваш электронный адрес будет использоваться только для отправки уведомлений. |
| Анти-спам проверка: |
Чтобы избежать проверки в будущем, пожалуйста войдите или зарегистрируйтесь. |
1 Ответ
0 голосов
Похожие вопросы
Как называется деформация тела, которая исчезает после прекращения действия внешних сил?
спросил от Вопросы и ответы в категории Естественные науки
Процесс изменения горных пород под воздействием внешних сил называется
спросил от Вопросы и ответы в категории Тесты ЕНТ, КТА, ВОУД Ответы на тесты ЕНТ
Какая физическая величина является мерой инертности тела?
спросил от Вопросы и ответы в категории Естественные науки
Над телом совершена работа A внешними силами и телу передано количество теплоты Q. Изменение внутренней энергии U тела равен
Изменение внутренней энергии U тела равен
спросил от Вопросы и ответы в категории Естественные науки
Давление идеального газа при неизменной концентрации частиц и изменении средней кинетической энергии теплового
спросил от Вопросы и ответы в категории Естественные науки
Если в некотором процессе работа газа и изменение его внутренней энергии равна по модулю, то такой процесс является
спросил от Вопросы и ответы в категории Естественные науки
При питании лампочки от элемента с ЭДС 1,5 В сила тока в цепи равна 0,2 А.
спросил от Жауапбек в категории Естественные науки
Работа электростатистических сил при перемещении заряда в однородном электрическом поле по замкнутой траектории KLMNK, равна
спросил от Жауапбек в категории Естественные науки
Работа, каких из перечисленных ниже сил зависит от формы пути? 1.Сила тяготения. 2.Сила упругости. З.Сила трения.
спросил от Вопросы и ответы в категории Естественные науки
Результатом взаимодействия внутренних и внешних сил на Земле являются
спросил от Вопросы и ответы в категории Тесты ЕНТ, КТА, ВОУД Ответы на тесты ЕНТ
В каком из указанных случаев движения тела работа силы тяжести положительная?
спросил от Вопросы и ответы в категории Естественные науки
Тело свободно падает с высоты h. Сравните потенциальные и кинетические энергии тела в точке, лежащей на высоте h/4 от поверхности Земли
Сравните потенциальные и кинетические энергии тела в точке, лежащей на высоте h/4 от поверхности Земли
спросил от Жауапбек в категории Естественные науки
Тело свободно падает и при этом точка 1 расположена выше точки 2.Сравните кинетические энергии тела в этих точках
спросил от Жауапбек в категории Естественные науки
Вся совокупность внешних признаков животных, их телосложение, соотношение частей тела
спросил от Айман в категории Животные, Растения
Не является мерой пресечения:
спросил от Akma в категории Тесты ЕНТ, КТА, ВОУД Ответы на тесты ЕНТ
12.
 3 Второй закон термодинамики: энтропия — физика
3 Второй закон термодинамики: энтропия — физикаРаздел Цели обучения
К концу этого раздела вы сможете делать следующее:
- Описывать энтропию
- Опишите второй закон термодинамики
- Решить задачи, связанные со вторым законом термодинамики
Поддержка учителей
Поддержка учителей
Цели обучения в этом разделе помогут вашим учащимся освоить следующие стандарты:
- (6) Научные концепции. Учащийся знает, что изменения происходят в физической системе, и применяет законы сохранения энергии и импульса. Ожидается, что студент:
- (Г) анализировать и объяснять повседневные примеры, иллюстрирующие законы термодинамики, в том числе закон сохранения энергии и закон энтропии
Основные термины раздела
| энтропия | второй закон термодинамики |
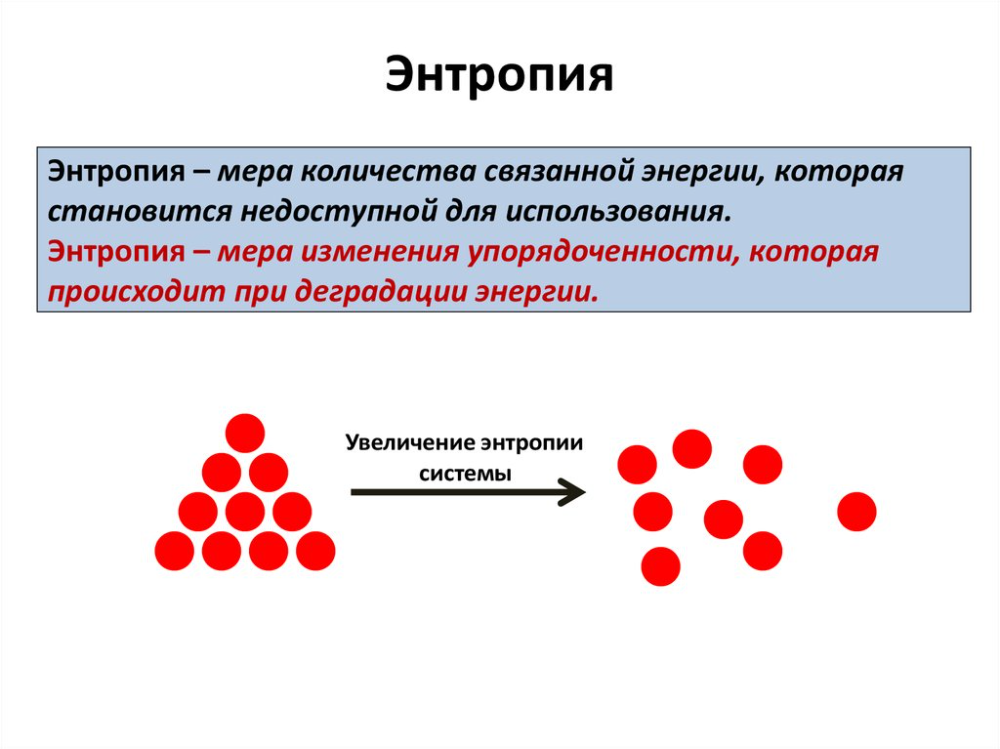
Энтропия
Поддержка учителей
Поддержка учителей
[BL][OL][AL] Просмотр тепла и абсолютной температуры.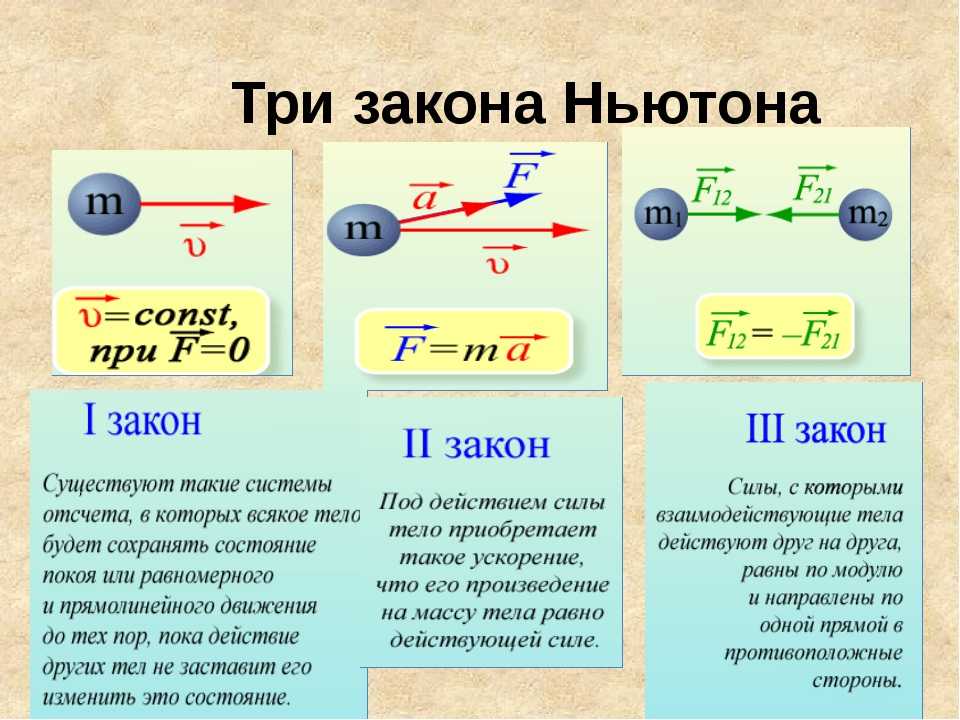 Вспомните более ранние обсуждения эффективности двигателя. Оценить понимание учащимися эффективности.
Вспомните более ранние обсуждения эффективности двигателя. Оценить понимание учащимися эффективности.
Вспомним из введения к главе, что даже теоретически двигатели не могут быть на 100 % эффективными. Это явление объясняется вторым законом термодинамики, который опирается на понятие, известное как энтропия. Энтропия есть мера беспорядка системы. Энтропия также описывает, сколько энергии составляет , а не доступен для работы. Чем более неупорядочена система и выше ее энтропия, тем меньше энергии системы доступно для выполнения работы.
Поддержка учителей
Поддержка учителей
Значение энтропии трудно понять, так как это может показаться абстрактным понятием. Однако мы видим примеры энтропии в нашей повседневной жизни. Например, если автомобильная шина проколота, воздух рассеивается во всех направлениях. Когда вода из тарелки ставится на прилавок, она в конце концов испаряется, а отдельные молекулы расходятся в окружающем воздухе. Когда в комнату помещают горячий предмет, он быстро распространяет тепловую энергию во всех направлениях. Энтропию можно рассматривать как меру рассеивания энергии. Он измеряет, сколько энергии было рассеяно в процессе. Течение любой энергии всегда идет от высшего к низшему. Следовательно, энтропия всегда имеет тенденцию к увеличению.
Когда в комнату помещают горячий предмет, он быстро распространяет тепловую энергию во всех направлениях. Энтропию можно рассматривать как меру рассеивания энергии. Он измеряет, сколько энергии было рассеяно в процессе. Течение любой энергии всегда идет от высшего к низшему. Следовательно, энтропия всегда имеет тенденцию к увеличению.
Хотя для выполнения работы можно использовать все формы энергии, невозможно использовать всю доступную энергию для работы. Следовательно, не вся энергия, переносимая теплотой, может быть превращена в работу, а часть ее теряется в виде отработанной теплоты, т. е. теплоты, не идущей на совершение работы. Недоступность энергии важна в термодинамике; на самом деле поле возникло в результате усилий по преобразованию тепла в работу, как это делают двигатели.
Уравнение изменения энтропии ΔSΔS равно
ΔS=QT, ΔS=QT,
, где Q — теплота, передающая энергию в процессе, а T — абсолютная температура, при которой происходит процесс.
Q положителен для энергии, переданной в систему за счет тепла, и отрицателен для энергии, переданной из в систему за счет тепла. В системе СИ энтропия выражается в джоулях на кельвин (Дж/К). Если температура изменяется во время процесса, то обычно хорошим приближением (для небольших изменений температуры) является T , чтобы быть средней температурой, чтобы избежать сложной математики (исчисления).
Советы для успеха
Абсолютная температура – это температура, измеренная в градусах Кельвина. Шкала Кельвина представляет собой абсолютную шкалу температуры, которая измеряется количеством градусов выше абсолютного нуля. Следовательно, все температуры положительны. Использование температуры из другой, неабсолютной шкалы, такой как градусы Фаренгейта или Цельсия, даст неверный ответ.
Второй закон термодинамики
Вы когда-нибудь играли в карточную игру 52 pickup? Если это так, то вы стали жертвой розыгрыша и в процессе получили ценный урок о природе Вселенной, описанной вторым законом термодинамики. В игре 52 pickup шутник бросает на пол целую колоду игральных карт, и вы можете их подобрать. В процессе сбора карт вы, возможно, заметили, что объем работы, необходимый для восстановления упорядоченного состояния карт в колоде, намного больше, чем объем работы, необходимый для подбрасывания карт и создания беспорядка.
В игре 52 pickup шутник бросает на пол целую колоду игральных карт, и вы можете их подобрать. В процессе сбора карт вы, возможно, заметили, что объем работы, необходимый для восстановления упорядоченного состояния карт в колоде, намного больше, чем объем работы, необходимый для подбрасывания карт и создания беспорядка.
Второй закон термодинамики утверждает, что полная энтропия системы либо увеличивается, либо остается постоянной в любом самопроизвольном процессе; она никогда не уменьшается. Важным следствием этого закона является то, что тепло самопроизвольно переносит энергию от объектов с более высокой температурой к объектам с более низкой температурой, но никогда самопроизвольно в обратном направлении. Это связано с тем, что энтропия увеличивается при передаче тепла от горячего к холодному (рис. 12.9). Поскольку изменение энтропии равно Q / T наблюдается большее изменение ΔSΔS при более низких температурах (меньшее T ). Следовательно, уменьшение энтропии горячего (более крупного T ) объекта меньше, чем увеличение энтропии холодного (меньшего T ) объекта, что приводит к общему увеличению энтропии для системы.
Следовательно, уменьшение энтропии горячего (более крупного T ) объекта меньше, чем увеличение энтропии холодного (меньшего T ) объекта, что приводит к общему увеличению энтропии для системы.
Рисунок 12,9 Лед в этом напитке медленно тает. В конце концов компоненты жидкости достигнут теплового равновесия, как и предсказывает второй закон термодинамики, то есть после того, как тепло передаст энергию от более теплой жидкости к более холодному льду. (Джон Салливан, PDPhoto.org)
Другой способ думать об этом состоит в том, что ни один процесс не может иметь своим единственным результатом передачу тепла от более холодного объекта к более горячему. Тепло не может самопроизвольно передавать энергию от более холодного к более горячему, потому что энтропия всей системы уменьшилась бы.
Предположим, мы смешиваем равные массы воды, которые изначально имеют две разные температуры, скажем, 20,0 °C20,0 °C. и 40,0°С40,0°С. В результате получится вода с промежуточной температурой 30,0 °C30,0 °C. Результатом стали три результата: энтропия увеличилась, часть энергии стала недоступна для выполнения работы, а система стала менее упорядоченной. Давайте подумаем о каждом из этих результатов.
и 40,0°С40,0°С. В результате получится вода с промежуточной температурой 30,0 °C30,0 °C. Результатом стали три результата: энтропия увеличилась, часть энергии стала недоступна для выполнения работы, а система стала менее упорядоченной. Давайте подумаем о каждом из этих результатов.
Во-первых, почему увеличилась энтропия? Смешивание двух водоемов имеет тот же эффект, что и передача тепла от вещества с более высокой температурой к веществу с более низкой температурой. Смешивание уменьшает энтропию более горячей воды, но увеличивает энтропию более холодной воды на большую величину, вызывая общее увеличение энтропии.
Во-вторых, как только две массы воды смешаны, больше не остается разницы температур, необходимой для передачи энергии посредством тепла и, следовательно, для совершения работы. Энергия все еще в воде, но теперь ее недоступен для работы.
В-третьих, смесь менее упорядочена или, говоря другим языком, менее структурирована. Вместо того, чтобы иметь две массы при разных температурах и с разным распределением молекулярных скоростей, мы теперь имеем единую массу с широким распределением молекулярных скоростей, среднее значение которых дает промежуточную температуру.
Вместо того, чтобы иметь две массы при разных температурах и с разным распределением молекулярных скоростей, мы теперь имеем единую массу с широким распределением молекулярных скоростей, среднее значение которых дает промежуточную температуру.
Эти три результата — энтропия, недоступность энергии и беспорядок — не только связаны, но фактически эквивалентны. Теплопередача энергии от горячего к холодному связана с тенденцией природы к неупорядоченности систем и уменьшению количества энергии, доступной для использования в качестве работы.
На основании этого закона, что не может произойти? Холодный объект, соприкасаясь с горячим, никогда самопроизвольно не передает энергию в виде тепла горячему объекту, становясь холоднее, в то время как горячий объект становится горячее. Точно так же горячий неподвижный автомобиль никогда не остывает самопроизвольно и не трогается с места.
Другим примером является расширение газовой струи, введенной в один из углов вакуумной камеры. Газ расширяется, заполняя камеру, но никогда не собирается сам по себе в углу. Беспорядочное движение молекул газа могло бы привести их всех обратно в угол, но этого никогда не происходит (рис. 12.10).
Газ расширяется, заполняя камеру, но никогда не собирается сам по себе в углу. Беспорядочное движение молекул газа могло бы привести их всех обратно в угол, но этого никогда не происходит (рис. 12.10).
Рисунок 12.10 Примеры односторонних процессов в природе. а) Теплопередача происходит самопроизвольно от горячего к холодному, но не от холодного к горячему. (b) Тормоза этого автомобиля преобразуют его кинетическую энергию в увеличение своей внутренней энергии (температуры), а тепло передает эту энергию окружающей среде. Обратный процесс невозможен. (c) Выброс газа, выпущенного в эту вакуумную камеру, быстро расширяется, чтобы равномерно заполнить все части камеры. Беспорядочные движения молекул газа не дадут им вообще вернуться в угол.
Мы объяснили, что тепло никогда не передает энергию спонтанно от более холодного объекта к более горячему. Ключевое слово здесь спонтанно . Если мы совершаем работу в системе, то возможна передача энергии посредством тепла от более холодного объекта к более горячему. Мы узнаем об этом больше в следующем разделе, посвященном холодильникам как одному из приложений законов термодинамики.
Мы узнаем об этом больше в следующем разделе, посвященном холодильникам как одному из приложений законов термодинамики.
Иногда люди неправильно понимают второй закон термодинамики, думая, что согласно этому закону энтропия не может уменьшаться в каком-либо конкретном месте. Но на самом деле возможно для энтропии одной части Вселенной уменьшаться, пока общее изменение энтропии Вселенной увеличивается. В форме уравнения мы можем записать это как
ΔStot=ΔSsyst+ΔSenvir>0.ΔStot=ΔSsyst+ΔSenvir>0.
Исходя из этого уравнения, мы видим, что ΔSsystΔSsyst может быть отрицательным до тех пор, пока ΔSenvirΔSenvir положительна и больше по величине.
Как может уменьшиться энтропия системы? Необходима передача энергии. Если вы подберете разбросанные по комнате шарики и положите их в чашку, ваша работа уменьшит энтропию этой системы. Если вы добудете железную руду из земли, превратите ее в сталь и построите мост, ваша работа уменьшит энтропию этой системы. Энергия, исходящая от солнца, может уменьшить энтропию локальных систем на Земле, то есть ΔSsystΔSsyst отрицательно. Но общая энтропия остальной части Вселенной увеличивается на большую величину, то есть ΔSenvir ΔSenvir положительна и больше по величине. В случае с железной рудой, хотя вы сделали систему моста и стали более структурированной, вы сделали это за счет вселенной. В целом энтропия вселенной увеличивается из-за беспорядка, создаваемого выкапыванием руды и превращением ее в сталь. Следовательно,
Энергия, исходящая от солнца, может уменьшить энтропию локальных систем на Земле, то есть ΔSsystΔSsyst отрицательно. Но общая энтропия остальной части Вселенной увеличивается на большую величину, то есть ΔSenvir ΔSenvir положительна и больше по величине. В случае с железной рудой, хотя вы сделали систему моста и стали более структурированной, вы сделали это за счет вселенной. В целом энтропия вселенной увеличивается из-за беспорядка, создаваемого выкапыванием руды и превращением ее в сталь. Следовательно,
ΔStot=ΔSsyst+ΔSenvir>0, ΔStot=ΔSsyst+ΔSenvir>0,
12,14
и второй закон термодинамики , а не нарушается.
Каждый раз, когда растение накапливает некоторую солнечную энергию в виде химической потенциальной энергии, или восходящий поток теплого воздуха поднимает парящую птицу, Земля испытывает локальное уменьшение энтропии, поскольку она использует часть энергии, передаваемой от Солнца в дальний космос, чтобы работа. В результате этой массивной передачи энергии происходит большое общее увеличение энтропии. Небольшая часть этой передачи энергии с помощью тепла хранится в структурированных системах на Земле, что приводит к гораздо меньшему локальному уменьшению энтропии.
В результате этой массивной передачи энергии происходит большое общее увеличение энтропии. Небольшая часть этой передачи энергии с помощью тепла хранится в структурированных системах на Земле, что приводит к гораздо меньшему локальному уменьшению энтропии.
Поддержка учителей
Поддержка учителей
[AL] Спросите учащихся, что произошло бы, если бы второй закон термодинамики не был верен. Что, если бы направление потока энергии нельзя было предсказать? Сможет ли жизнь на Земле функционировать?
Решение задач, связанных со вторым законом термодинамики
Энтропия связана не только с недоступностью энергии для выполнения работы; это также мера беспорядка. Например, в случае таяния глыбы льда высокоструктурированная и упорядоченная система молекул воды превращается в беспорядочную жидкость, в которой молекулы не имеют фиксированных положений (рис. 12.11). В этом процессе происходит значительное увеличение энтропии, как мы увидим в следующем рабочем примере.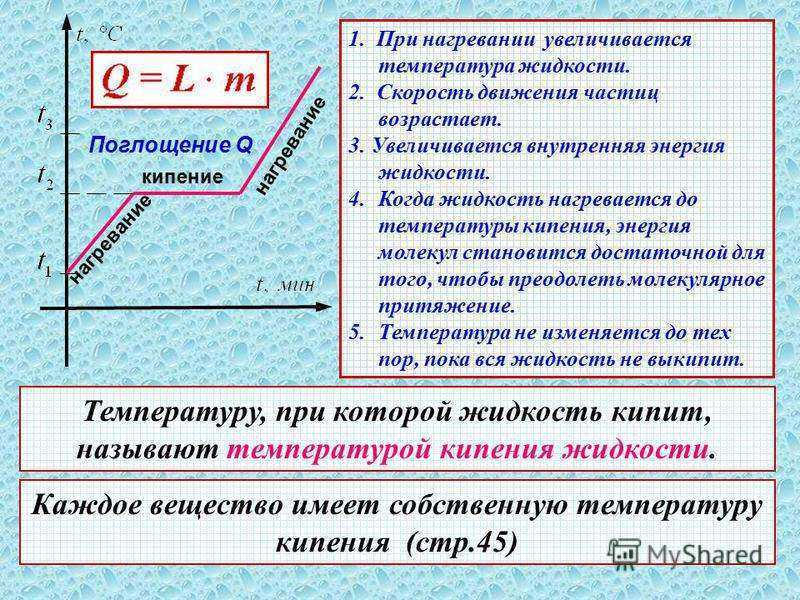
Рисунок 12.11 Эти льдины тают во время арктического лета. Некоторые из них замерзают зимой, но второй закон термодинамики предсказывает, что молекулы воды, содержащиеся в этих конкретных льдинах, крайне маловероятны, чтобы преобразоваться в характерную форму аллигатора, которой они обладали, когда эта фотография была сделана летом 2008 года. 2009 г. (Патрик Келли, Береговая охрана США, Геологическая служба США)
Рабочий пример
Энтропия, связанная с беспорядком
Найдите прирост энтропии 1,00 кг льда, который первоначально находился при температуре 0 °C0 °C. и плавится с образованием воды при 0 °C0 °C.
Стратегия
Изменение энтропии можно рассчитать по определению ΔSΔS, как только мы найдем энергию Q , необходимую для таяния льда.
Решение
Изменение энтропии определяется как
ΔS=QT. ΔS=QT.
ΔS=QT.
12,15
Здесь Q — теплота, необходимая для плавления 1,00 кг льда, равная
Q=mLf,Q=mLf,
12,16
где m — масса, а LfLf — скрытая теплота плавления. Lf=334 кДж/кг Lf=334 кДж/кг для воды, поэтому
Q=(1,00 кг)(334 кДж/кг)=3,34×105 Дж. Q=(1,00 кг)(334 кДж/кг)=3,34×105 Дж .
12,17
Поскольку Q — это количество энергии, которое тепло добавляет льду, его значение положительно, а T — это температура плавления льда, T=273 KT=273 K. Таким образом, изменение энтропии равно
ΔS=QT=3,34×105J273 K=1,22×103J/K. ΔS=QT=3,34×105J273K=1,22×103J/K.
12.18
Обсуждение
Рисунок
12.12
Когда лед тает, он становится более неупорядоченным и менее структурированным.
систематическое расположение молекул в кристаллической структуре сменяется более
случайное и менее упорядоченное движение молекул без фиксированного местоположения или ориентации. Его энтропия увеличивается, потому что в него происходит передача тепла. Энтропия – это мера
расстройство.
Его энтропия увеличивается, потому что в него происходит передача тепла. Энтропия – это мера
расстройство.
Изменение энтропии положительно, потому что тепло передает энергию в 9\circ \text{C}, каково изменение энтропии?
0,105\,\text{Дж/К}
2,5\,\текст{Дж/К}9,50\,\текст{Дж/К}
0,45\,\текст{Дж/К}
9,50\,\текст{Дж/К}
Проверьте свое понимание
Поддержка учителей
Поддержка учителей
Используйте эти вопросы, чтобы оценить достижение учащимися учебных целей раздела. Если учащиеся борются с определенной целью, эти вопросы помогут определить, какая именно, и направить учащихся к соответствующему содержанию.
Если учащиеся борются с определенной целью, эти вопросы помогут определить, какая именно, и направить учащихся к соответствующему содержанию.
13.
Что такое энтропия?
- Энтропия — это мера потенциальной энергии системы.
- Энтропия — это мера чистой работы, выполняемой системой.
- Энтропия является мерой беспорядка системы.
- Энтропия является мерой теплопередачи энергии в систему.
14.
Какие виды энергии можно использовать для выполнения работы?
- Только работа способна делать работу.
- Только теплота может совершать работу.
- Только внутренняя энергия способна совершать работу.
- Теплота, работа и внутренняя энергия способны совершать работу.
15.
В чем формулировка второго закона термодинамики?
Все самопроизвольные процессы приводят к уменьшению полной энтропии системы.
Все самопроизвольные процессы приводят к увеличению полной энтропии системы.
Все самопроизвольные процессы приводят к пониженной или постоянной полной энтропии системы.
Все самопроизвольные процессы приводят к повышенной или постоянной полной энтропии системы.
16.
Что обычно происходит с энтропией всей системы при передаче тепла от высокой температуры к низкой?
- Уменьшается.
- Должно оставаться постоянным.
- Энтропия системы не может быть предсказана без конкретных значений температуры.

- Увеличивается.
Внутренняя энергия: определение, формула и изменение
Сегодня суббота, и у вас есть билеты, чтобы пойти на футбольный стадион, чтобы посмотреть матч вашей любимой команды (вы можете заменить футбол на любой вид спорта, не волнуйтесь). Но вы читали много статей на StudySmarter и теперь работаете физиком на полную ставку. Итак, как только вы садитесь со своим напитком и закусками, вы смотрите на своего любимого игрока и представляете его просто как частицу. И когда вы отводите взгляд, все футбольное поле уже не поле, а пространство, заполненное физическими частицами. Конечно, вы хотите получить удовольствие от матча, но сначала у вас возникает вопрос, и вам нужно на него ответить. Обладает ли система реальных частиц полной кинетической энергией, подобно игрокам на поле?
Помните, что система в физике — это любая часть Вселенной, которую мы хотели бы изучить.
Ответ на этот вопрос — да. Точно так же, как игроки на футбольном поле, частицы в системе движутся.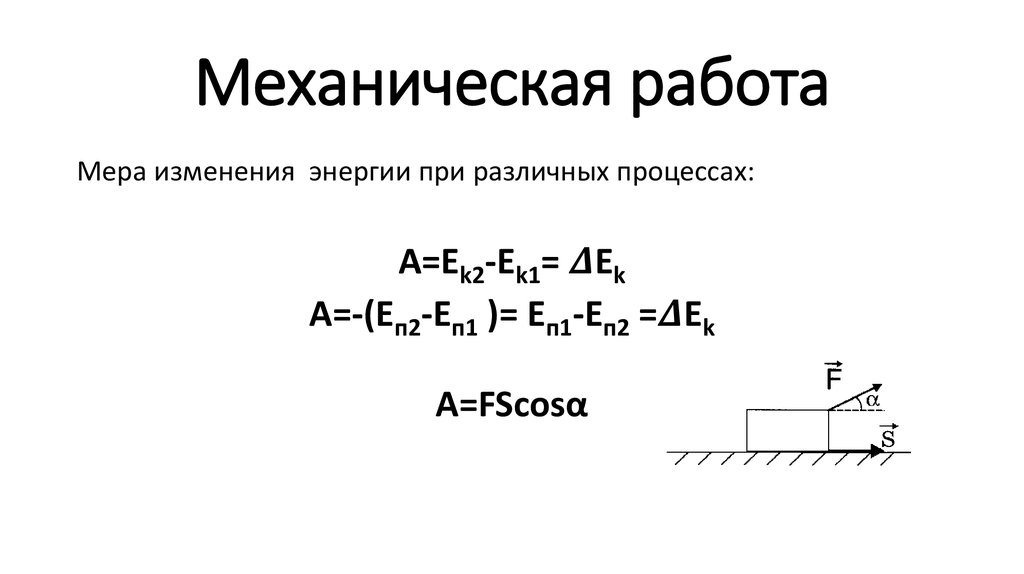 Частицы внутри этой системы обладают определенной кинетической энергией из-за температуры системы: частицы обычно движутся быстрее, когда температура системы выше. Кроме того, частицы могут иметь и потенциальную энергию, например, за счет взаимного притяжения между частицами (например, если они являются электрическими диполями).
Частицы внутри этой системы обладают определенной кинетической энергией из-за температуры системы: частицы обычно движутся быстрее, когда температура системы выше. Кроме того, частицы могут иметь и потенциальную энергию, например, за счет взаимного притяжения между частицами (например, если они являются электрическими диполями).
Определение внутренней энергии
Внутренняя энергия системы — это энергия, находящаяся внутри. Это сумма всех микроскопических кинетических и потенциальных энергий частиц в системе, если бы система находилась в состоянии покоя, а не в макроскопическом энергетическом потенциале.
Важно понимать, что эта внутренняя энергия не имеет прямого отношения к внешней энергии системы. Это означает, что если система движется и обладает кинетической энергией, то внутренняя энергия системы не включает эту энергию, возникающую в результате общего движения системы. Точно так же, если мы поместим всю систему на высоте 1 км над землей, эта макроскопическая потенциальная энергия не повлияет на внутреннюю энергию системы. Система может быть совершенно неподвижной и не иметь кажущейся энергии, пока ее внутренняя энергия изменяется, но, с другой стороны, система может двигаться, в то время как ее внутренняя энергия постоянна.
Система может быть совершенно неподвижной и не иметь кажущейся энергии, пока ее внутренняя энергия изменяется, но, с другой стороны, система может двигаться, в то время как ее внутренняя энергия постоянна.
Если мы нагреем воду, макроскопическая энергия системы не увеличится, поскольку вода не движется. Однако мы знаем, что что-то происходит, потому что температура воды повышается. По мере повышения температуры воды частицы воды начинают двигаться все быстрее и быстрее, что приводит к увеличению их общей кинетической энергии. Таким образом, внутренняя энергия воды увеличивается по мере нагревания воды. При этом внешняя кинетическая энергия остается равной нулю.
В общем случае изменение внутренней энергии системы вызывает либо изменение температуры, либо изменение состояния.
Внутренняя энергия — экстенсивное свойство: свойство системы, которое зависит от того, как система оценивает свой размер или массу. Его значение можно описать как сумму значений более мелких подразделений системы.
Для реальных систем нас обычно интересует (и, следовательно, вычисляется) изменение внутренней энергии во время процесса, такого как повышение температуры.
Внутренняя энергия в термодинамике
В физике энергия передается за счет изменения температуры, приложения сил и т. д. Разделом, изучающим это, является термодинамика .
Термодинамика — это раздел физики, изучающий взаимосвязь между теплотой, работой и другими видами передачи энергии.
Теперь представьте себе любую систему (и на этот раз это не обязательно должен быть футбольный стадион). Помните, что система в термодинамике — это любая часть Вселенной, которую мы хотим изучить, так что это может быть человеческое тело, определенное количество жидкости, растение или что-то еще, что вы можете себе представить.
Рис. 1: Термодинамическая система с границей, адаптированная из изображения.
Частицы с микроскопическими энергиями находятся внутри системы, и сумма всех этих микроскопических энергий составляет то, что мы называем внутренней энергией.
Это приводит нас к изучению того, что происходит с внутренней энергией, когда часть энергии передается системе. В нашем случае мы сосредоточимся на том, что происходит, когда температура увеличивается. Для этого в систему должна быть передана энергия , , так что либо система должна быть нагрета, либо в системе должна быть совершена работа.
Тепло – это энергия, передаваемая в систему или из системы за счет разницы температур с окружающей средой.
Тепло, добавленное к системе или отведенное от нее, не следует путать с температурой системы.
Теплопередача вызывает изменение внутренней энергии системы. Точно так же приложение работы к системе увеличивает внутреннюю энергию системы.
Рис. 2: Теплопередача между двумя системами при разных температурах.
Изменение внутренней энергии системы может изменить либо потенциальную энергию частиц, либо кинетическую энергию частиц. Если потенциальная энергия изменяется, мы говорим об изменении состояния. Если кинетическая энергия изменяется, мы говорим об изменении температуры.
Если кинетическая энергия изменяется, мы говорим об изменении температуры.
Температура системы является мерой полной кинетической энергии в системе. Когда тепло поступает в систему и не происходит изменения состояния, внутренняя энергия увеличивается, а, следовательно, увеличивается и общая кинетическая энергия. Это означает, что температура повышается.
Изменения внутренней энергии
Как указывалось ранее, изменение внутренней энергии системы вызывает либо изменение температуры, либо изменение состояния. Мы рассмотрим изменения температуры в следующем разделе, а здесь сосредоточимся на изменениях состояния.
Как вы знаете, мы обычно различаем три состояния вещества: газ, жидкость и твердое тело . Если температура системы повышается или понижается до определенной точки, которая зависит от вещества, с которым мы работаем, может произойти переход из одного состояния в другое. При этом изменении состояния температура остается постоянной, но внутренняя энергия системы все же изменяется.
Во-первых, внутренняя энергия системы может увеличение, в результате приложения тепла или работы. Это три разных изменения состояния, связанные с увеличением внутренней энергии:
- Твердое тело будет плавиться , образуя жидкость.
- Жидкость будет испаряться, превращаясь в газ.
- Если у нас есть твердое тело и оно при увеличении внутренней энергии сразу превращается в газ, то мы говорим о сублимации .
Иначе можно уменьшить внутренняя энергия вещества, когда система начинает отдавать теплоту наружу или совершает работу в окружающей среде:
- Газ будет конденсироваться, получать жидкость.
- Жидкость замерзнет, превратится в твердое тело.
- Если вещество переходит из газообразного состояния в твердое, минуя свое жидкое состояние, говорят об отложении .

Рис. 3: Повышая и понижая температуру мы можем изменить состояние вещества.
Вы можете узнать больше об изменениях состояния здесь, в StudySmarter.
Уравнение изменения внутренней энергии
В большинстве случаев изменение внутренней энергии вызывает изменение температуры. При этом меняется только полная кинетическая энергия частиц, а полная потенциальная энергия остается неизменной.
тепловая энергия системы представляет собой сумму всех микроскопических кинетических энергий частиц в системе, если бы система находилась в состоянии покоя.
Короче говоря, тепловую энергию можно рассматривать как кинетическую часть внутренней энергии. Когда во время процесса не происходит изменения состояния, изменение внутренней энергии совпадает с изменением тепловой энергии системы.
Уравнение, связывающее изменение тепловой энергии и изменение температуры системы:
\[\text{изменение тепловой энергии}=\text{масса}\cdot \text{удельная теплоемкость}\cdot \ текст{изменение температуры}\].
В символах это уравнение принимает вид
\[\Delta E=mc\Delta \theta\],
где
- \(\Delta E\) — изменение тепловой энергии системы. Стандартной единицей измерения является джоулей \(\mathrm{J}\).
- \(m\) — масса системы. Стандартной единицей измерения является кг (\(\mathrm{kg}\)}.
- \(c\) называется удельной теплоемкостью . Определяется как количество энергии, необходимое для увеличения температура единицы массы определенного вещества на одну единицу температуры.Каждое вещество имеет свою постоянную удельную теплоемкость: это характеристика, такая же как плотность и цвет.Стандартная единица j oule/(килограмм x кельвин) , (\(\mathrm{J}/(\mathrm{kg \cdot K})\)). Это всегда положительно.
- \(\Delta \theta\) — изменение температуры системы. Если конечная температура меньше начальной температуры, значение будет отрицательным. Стандартной единицей является кельвинов , (\(K\))
Как видите, если масса вещества не меняется в процессе (поэтому имеет постоянное значение), температура системы будет увеличится, если мы увеличим его тепловую энергию. При определенном энерговкладе изменение температуры зависит от массы системы и удельной теплоемкости материала, из которого состоит система. Для двух систем с двумя разными веществами с одинаковой массой, одинаково изменяющими тепловую энергию обеих систем, изменение температуры будет различным. Это связано с тем, что два вещества будут иметь разные значения удельной теплоемкости.
При определенном энерговкладе изменение температуры зависит от массы системы и удельной теплоемкости материала, из которого состоит система. Для двух систем с двумя разными веществами с одинаковой массой, одинаково изменяющими тепловую энергию обеих систем, изменение температуры будет различным. Это связано с тем, что два вещества будут иметь разные значения удельной теплоемкости.
Внутренняя энергия системы также может быть изменена с помощью работы .
В термодинамике обычно говорят о расширении и сжатии. Когда объем системы увеличивается, мы говорим о расширении, а когда он уменьшается, мы говорим о сжатии.
Рис. 4: Примеры а) расширения и б) сжатия системы.
Выполнение работы в системе приведет к сжатию системы. Какая работа необходима для сжатия системы на определенный объем, определяется давлением в системе по следующей формуле: 93\)).
Если мы работаем над системой, то из формулы видим, что разница в объеме отрицательна, значит, у нас действительно есть сжатие. {\circ}\)C. Какова удельная теплоемкость этого материала? Какой материал у нас есть?
{\circ}\)C. Какова удельная теплоемкость этого материала? Какой материал у нас есть?
Решение
Изменения состояния не было, поэтому изменение внутренней энергии равно изменению тепловой энергии. Снова нам нужно использовать уравнение изменения тепловой энергии, но на этот раз нам нужно выделить удельную теплоемкость следующим образом:
\[\Delta E=mc \Delta \theta \ \rightarrow \ c= \dfrac{\Delta E}{m \Delta \theta}\].
Теперь мы можем подставить значения в уравнение:
\[c=\dfrac{2250\,\,\mathrm{J}}{0,5\,\,\mathrm{kg}\cdot 10\ ,\,\mathrm{K}}=450\,\,\mathrm{\frac{J}{kg \cdot K}}\].
Удельная теплоемкость \(c=450\,\, \mathrm{Дж/кг \cdot K}\). Если мы посмотрим на таблицу удельной теплоемкости, то обнаружим, что у железа есть эта удельная теплоемкость, поэтому, скорее всего, у нас есть железо.
Внутренняя энергия — основные выводы
- Термодинамика — это раздел физики, изучающий взаимосвязь между теплом, работой и другими видами передачи энергии.

- Термодинамическая система является ограниченной частью Вселенной.
- внутренняя энергия системы представляет собой сумму всех микроскопических кинетических и потенциальных энергий частиц в системе.
- Увеличение внутренней энергии системы приведет либо к повышению температуры, либо к изменению состояния.
- Тепловая энергия системы представляет собой сумму всех микроскопических кинетических энергий частиц в системе.
- Увеличение тепловой энергии системы заставит частицы системы двигаться быстрее (по мере увеличения их кинетической энергии), что вызывает повышение температуры.
- Изменение температуры системы в результате изменения тепловой энергии можно рассчитать по следующей формуле: \(\Delta E=mc \Delta \theta\).
- Удельная теплоемкость вещества определяется как количество энергии, необходимое для повышения температуры одной единицы массы вещества на одну единицу температуры.


 2 Термодинамика
2 Термодинамика
