Катализаторы
Под катализом понимают изменение скорости реакции при участии веществ-катализаторов, которые сами в ней не участвуют. С катализатором химический процесс происходит быстрее. Ингибитор, наоборот, снижает скорость нежелательных реакций. Он отличается от катализатора еще и тем, что при нем энергия процесса остается неизменной. Ингибитор реагирует с одним из промежуточных продуктов и образует прочное соединение или блокирует активные центры катализатора.
Катализ может быть осуществлен самим промежуточным продуктом химической реакции. Данный процесс называется автокаталитическим, который сначала протекает медленно и постепенно ускоряется по мере образования продуктов.
Характеристиками катализатора являются его селективность и активность. Селективность – это ускорение только одной реакции из ряда допустимых. Активность катализатора поясняет во сколько раз он увеличил скорость процесса.
Малого количества катализатора достаточно для ускорения превращения большого объема реагирующих веществ. В химической среде катализатор и одно реагирующее вещество образуют активированный комплекс, который затем взаимодействует с другими веществами. В результате образуются продукты реакции и катализатор, химический состав и структура которого изменилась под воздействием продуктов смеси.
В химической среде катализатор и одно реагирующее вещество образуют активированный комплекс, который затем взаимодействует с другими веществами. В результате образуются продукты реакции и катализатор, химический состав и структура которого изменилась под воздействием продуктов смеси.
Каталитические процессы бывают трех видов. Гетерогенный катализ подразумевает, что фаза реагирующих веществ отлична от фазы, представленной самим катализатором. Чаще всего рассматривают гетерогенные процессы, в которых молекулы газов вступают в реакцию с поверхностью твердого тела. Если реагирующие вещества находятся в одной фазе с катализатором, то говорится о гомогенном катализе. Такие процессы наблюдаются в растворах. Ферментативный катализ отличается от других видов тем, что происходит в живых организмах под действием ферментов (энзимов), которые являются белковыми молекулами. Без них биохимические реакции протекают медленно или не происходят вообще. Селективность и активность ферментов являются самыми большими величинами среди изученных катализаторов.
В химии выделяют каталитические яды. Они способны снизить или полностью прекратить активность катализатора. Такое вещество может быть ядом при одной температуре или в определенной концентрации, а при других условиях может стать и промотором, то есть веществом, активизирующим катализатор.
Для катализа часто используют носители – инертные либо неактивные материалы. Нанесенный на них катализатор увеличивает свою поверхность, что экономит дорогостоящие вещества, предотвращает рекристаллизацию или спекание компонента, значительно увеличивает катализаторную активность.
Каталитические процессы считаются основными во всех крупнотоннажных производствах даже после появления новых методов активации молекул: радиационная, лазерная химия и плазмохимия. В масштабных промышленных процессах ускоряется образование высококачественных бензинов, моторных, дизельных и реактивных топлив и другие процессы нефтепереработки, производство каучука, гидрогенизация жиров. Катализаторы используются при переработке низкосортного сырья в высокоценные продукты: лекарства, пластмассы, удобрения и прочие химические реактивы.
Высокое экономическое значение имеет ингибирование нежелательных химических процессов. Например, для создания долгохранящихся продуктов используются антиоксиданты. Эти вещества способны предотвратить процесс окисления.
Охрана окружающей среды невозможна без катализа. Самое главное достижение в этом направлении – создание нейтрализатора автомобильных выхлопных газов.
Быстрая реакция: Зачем нужны катализаторы
- Наука
- / Химия
2 мая 2019 г. | Автор: Евгений Фёдоров
Быстрая реакция: Зачем нужны катализаторы
Без универсальных ускорителей мир вокруг нас превратился бы в замедленное кино. Не образуя химических связей с реагирующими веществами, катализаторы искусно управляют динамикой реакций.
Эта статья была опубликована в журнале OYLA №11(39). Оформить подписку на печатную и онлайн-версию можно здесь.
Оформить подписку на печатную и онлайн-версию можно здесь.
Рабочая лошадка химии
Что мешает веществам реагировать самостоятельно и обходиться без катализаторов? Энергия активации. Молекулам исходных веществ необходимо преодолеть её для запуска взаимодействия. Катализатор же снижает эту энергию. Каталитические реакции могут протекать в жидких и газообразных средах, а также на поверхности твёрдых тел.
Химические ускорители различаются по эффективности, избирательности, а также по масштабам воздействия — от отдельных атомов до гигантских белков-ферментов. Катализатор может выбрать две или более молекул, которым нужна помощь в осуществлении реакции. Он запускает процесс без образования химических связей, после чего отрывается от продукта и прикрепляется к новым молекулам.
Впрочем, есть способ обойтись без катализаторов. В промышленном производстве можно точно настроить температуру, подобрать концентрацию веществ, давление и время контакта реагентов — всё это помогает ускорить процесс, но дорого стоит и очень сложно.
В некоторых ситуациях без катализаторов вообще не обойтись. К примеру, получение аммиака из азота и водорода возможно только при температуре не более 6000°С, а для разрыва тройной связи в молекуле N 2 требуются бóльшие температуры. Это термодинамическое противоречие снимается за счёт специального катализатора, снижающего температуру разрушения тройной связи.
Использование химических катализаторов ещё и экологично. Без них реакции пришлось бы ускорять путём повышения температуры и давления. А это означает сжигание миллионов тонн топлива, что неизбежно увеличило бы вредные выбросы в атмосферу.
Катализаторы позволили значительно снизить расход реагентов. Например, раньше эпоксиэтилен С2H4O, важный компонент для синтеза антифриза, получали в три стадии — вместе с вредными побочными продуктами. Катализатор (серебро, активированное хлором) позволил уменьшить количество стадий до одной, а из вредных выбросов осталось лишь немного CO Катализаторы применяются в 85–90% промышленных химических процессов: от пищевой индустрии до каталитической переработки нефти.
Катализаторы применяются в 85–90% промышленных химических процессов: от пищевой индустрии до каталитической переработки нефти.
Катализ и чёрное золото
Транспортировка реактора гидроочистки нефти
Доля тяжёлых остатков нефти (их ещё называют «дно бочки») в добыче жидких углеводородов со временем будет увеличиваться.
Нефтяные ресурсы истощаются: лёгкой нефти становится всё меньше — приходится выкачивать тяжёлую и высоковязкую. Ключевую роль в её переработке играют катализаторы. Увеличение выхода бензина из тяжёлых остатков (мазут) всего на 1% снизит потребность США в импорте нефти на миллионы баррелей в год!
Рециркуляция отработанных газов
EGR (Exhaust Gas Recirculation) — система в двигателях внутреннего сгорания, направляющая отработанные выхлопные газы обратно в цилиндры. Это делается для снижения расхода топлива и количества вредных выбросов.
Дело в том, что при сгорании топлива азот «крадёт» кислород из топливной смеси. А это уменьшает экономичность и мощность мотора. Повторная подача в цилиндры охлаждённых выхлопных газов снижает температуру — кислород перестаёт реагировать с азотом. В итоге падает расход топлива и количество вредных выбросов, а каталитический нейтрализатор работает эффективнее.
А это уменьшает экономичность и мощность мотора. Повторная подача в цилиндры охлаждённых выхлопных газов снижает температуру — кислород перестаёт реагировать с азотом. В итоге падает расход топлива и количество вредных выбросов, а каталитический нейтрализатор работает эффективнее.
AdBlue
Для селективной нейтрализации вредных выхлопов применяют мочевину (NH 2)2CO3. Этот способ получил название AdBlue. Система впрыскивает мочевину порциями в горячий выпускной тракт дизельного двигателя, где она сразу же разлагается:
(NH
2)2CO3 = NH3 + HNCO.Далее аммиак Nh4 нейтрализует оксиды азота:
NO + NO
2 + 2NH3 = 2N2 + 3H2O.
Преимущество такого метода в возможности использования в дизельных моторах, выхлопные газы которых бедны кислородом, отчего использование трёхкомпонентных каталитических нейтрализаторов становится невозможно.
Помимо экономической выгоды стоит сказать и об экологической: одно только удаление серы и азота снижает токсичность выхлопных газов автомобилей в несколько раз. В воздух перестают попадать серная кислота и ядовитые оксиды, образующиеся в цилиндрах двигателей внутреннего сгорания.
Катализатор гидроочистки
Для удаления атомов N и S и внедрения атомов Н используют катализаторы гидроочистки нефти. Типичным примером такого соединения является дисульфид молибдена MoS 2 с кобальтом или никелем, покрытый оксидом алюминия Al2O3. Самые стойкие к гидрированию молекулы приходится атаковать дорогостоящими катализаторами, в которых молибден заменён на вольфрам.
Дисульфид молибдена
Против термически стабильных серосодержащих молекул в составе нефти применяются вещества на основе палладия и платины. Механика работы таких катализаторов достаточно проста: они приближаются к органической молекуле, содержащей серу, отрывают её, присоединяют к собственному атому металла, а затем отпускают его на свободу в виде сероводорода. При этом химики до сих пор не изучили все тонкости каталитической гидроочистки нефти. А постоянное ужесточение требований к содержанию серы в бензине с каждым днём делает это направление науки всё более актуальным.
При этом химики до сих пор не изучили все тонкости каталитической гидроочистки нефти. А постоянное ужесточение требований к содержанию серы в бензине с каждым днём делает это направление науки всё более актуальным.Ферменты (Каталитические клубки)
Высокоточными природными катализаторами являются белки-ферменты, или энзимы. Их активность зависит от конфигурации клубка, в который сворачивается молекула. Существует 6 классов ферментов.
Оксиредуктазы отвечают за окисление и восстановление веществ.
Трансферазы транспортируют химические группы от одной молекулы к другой.
Лиазы — агрессивные катализаторы, разрывающие связи без гидролиза.
Лигазы — ферменты-строители, способные формировать химические связи.
Изомеразы отвечают
за преобразование структуры молекул и изомеризацию.
Защитники природы
Заслуги катализаторов перед экологией не сводятся к перечисленным выше. Существует целая группа химических ускорителей, отвечающих непосредственно за чистоту воздуха (их называют каталитическими нейтрализаторами). Их задача — связывать угарный газ, оксиды азота и серы, а также недогоревшие органические соединения различной природы. Весь этот букет присутствует в выхлопных газах автомобилей и дымах промышленных предприятий. Каталитические нейтрализаторы превращают эти яды в менее токсичные вещества типа H 2, умеренно вредный углекислый газ CO2 и уж совсем нейтральную воду.
Оксид ванадия под микроскопическим увеличением
Трёхкомпонентный каталитический нейтрализатор стал чрезвычайно удачным образцом химического инжиниринга и ставится сейчас практически в каждый автомобиль. На пористом керамическом монолите, покрытом тонким слоем платины и родия, проходят трансформацию три главных загрязнителя: CO, NO и несгоревшие углеводороды.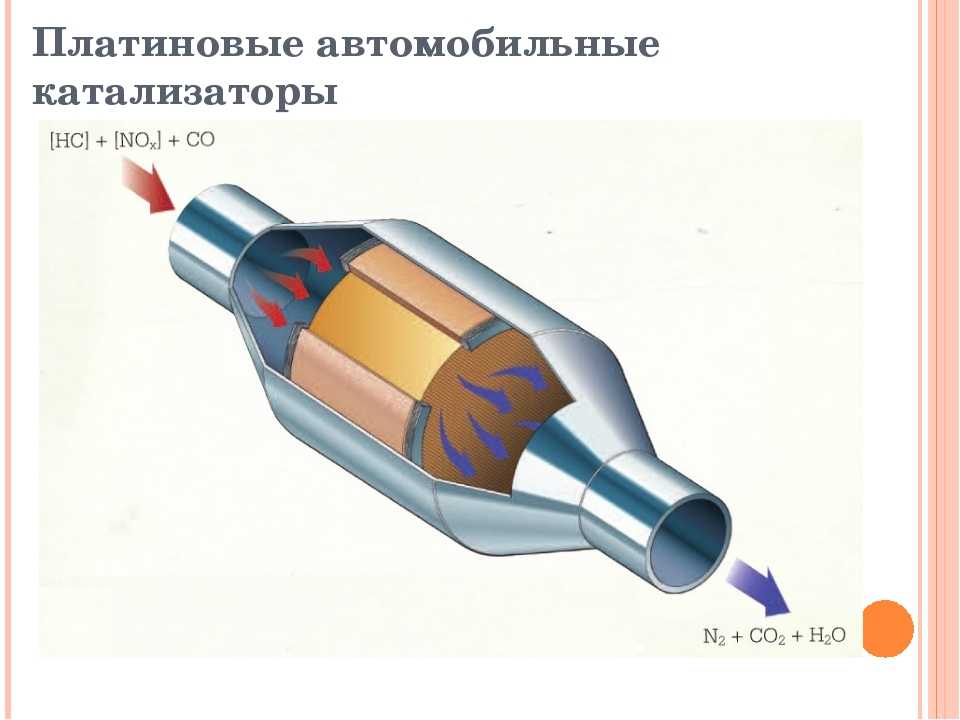 Реакции выглядят так:
Реакции выглядят так:
СО + О
2 = СО2С
xHy + O2 = CO2NO + CO = N
2 + CO2.Доля кислорода в этих процессах должна регулироваться, потому что его избыток может пойти на полное окисление угарного газа, и, как следствие, оксиды азота останутся в составе выхлопных газов. Уровень кислорода контролируется лямбда-зондом, который подаёт корректирующие сигналы двигателю о составе топливно-воздушной смеси. Оптимальным является соотношение воздуха и топлива в пропорции 14,7:1.
Рабочий диапазон каталитического нейтрализатора лежит в пределах от 3500 до 6500°С, что создаёт трудности при холодном запуске двигателя.
Нейтрализатор
Автомобильные нейтрализаторы впервые внедрили в массовое производство в США в 1975 году. Это стало одной из мер по борьбе с удушающими смогами, которые накрывали мегаполисы с их избытком автомобилей.
Непрогретый катализатор не выполняет защитную функцию, и в воздух попадают все три токсичных отхода: СO, NO и С
xHy. Именно поэтому в некоторых странах (к примеру, скандинавских) запрещено прогревать мотор на холостых оборотах — только в движении. Так быстрее.
Именно поэтому в некоторых странах (к примеру, скандинавских) запрещено прогревать мотор на холостых оборотах — только в движении. Так быстрее.
Промышленные выбросы, содержащие оксид серы SO 2, стали причиной кислотных дождей во второй половине XX века. И тогда химики придумали с помощью расплава V2O5 каталитически окислять оксид серы (IV) до оксида серы (VI), а затем до жидкой серной кислоты.
Экологические последствия кислотных дождей
Многие промышленные предприятия стали попутно серную кислоту производить! Бороться с NО x в дымовых трубах пришлось более сложными методами — добавляя восстановитель-аммиак и катализатор на основе оксидов титана и ванадия. Каталитическая реакция в полном виде:
4NH
3 + 4NO + O2 = 4N2 + 6H2O.
Каталитическая химия находится в зените славы — её достижения экономят гигантские ресурсы и помогают бережно относиться к природе. В то же время это одна из самых сложных и малоизученных областей химии, а значит, главные каталитические прорывы ещё впереди.
В то же время это одна из самых сложных и малоизученных областей химии, а значит, главные каталитические прорывы ещё впереди.
Тэги:
химиянефтьнефтехимияпроизводствонефтепереработка
Теплота реакции | Определение и факты
энергетические профили для каталитических и термических (некаталитических) реакций
Просмотреть все средства массовой информации
- Ключевые люди:
- Юлиус Томсен
- Похожие темы:
- механизм реакции Закон Гесса
Просмотреть весь связанный контент →
теплота реакции , также называемая энтальпия реакции , количество тепла, которое необходимо добавить или отвести во время химической реакции, чтобы поддерживать все присутствующие вещества при одинаковой температуре. Если давление в сосуде, содержащем реагирующую систему, поддерживается на постоянном уровне, измеренная теплота реакции также представляет собой изменение термодинамической величины, называемой энтальпией, или теплосодержанием, сопровождающее процесс, т. е. разницу между энтальпией вещества, присутствующие в конце реакции, и энтальпия веществ, присутствующих в начале реакции. Таким образом, теплота реакции, определяемая при постоянном давлении, также обозначается энтальпией реакции, обозначаемой символом Δ Н . Если теплота реакции положительна, то говорят, что реакция эндотермическая; если отрицательный, экзотермический.
е. разницу между энтальпией вещества, присутствующие в конце реакции, и энтальпия веществ, присутствующих в начале реакции. Таким образом, теплота реакции, определяемая при постоянном давлении, также обозначается энтальпией реакции, обозначаемой символом Δ Н . Если теплота реакции положительна, то говорят, что реакция эндотермическая; если отрицательный, экзотермический.
Прогнозирование и измерение тепловых эффектов, сопровождающих химические изменения, важны для понимания и использования химических реакций. Если сосуд, содержащий реагирующую систему, изолирован так, что тепло не поступает в систему и не выходит из нее (адиабатические условия), тепловой эффект, сопровождающий превращение, может проявляться в повышении или понижении температуры, в зависимости от обстоятельств. присутствующих веществ. Точные значения теплот реакций необходимы для правильного проектирования оборудования, используемого в химических процессах.
Еще из Britannica
термодинамика: энтальпия и теплота реакции
Поскольку измерение теплоты для каждой протекающей реакции нецелесообразно, а для некоторых реакций такое измерение может быть даже неосуществимым, принято оценивать теплоту реакции на основе подходящих комбинаций скомпилированных стандартных тепловых данных.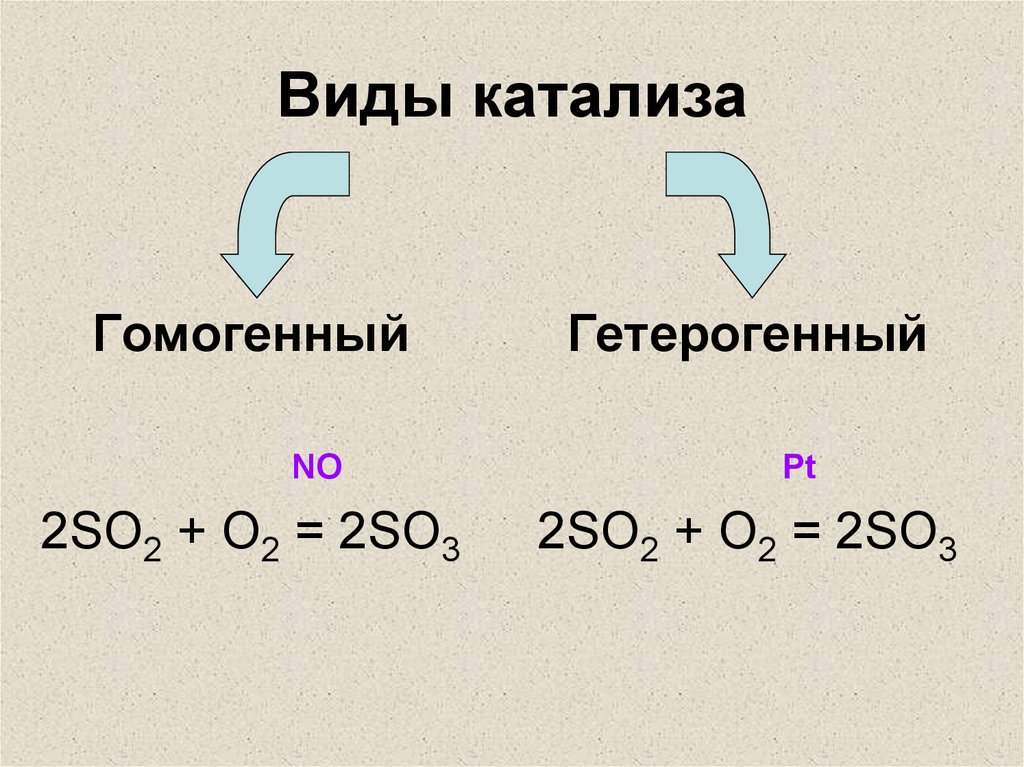 Эти данные обычно принимают в виде стандартных теплот образования и теплот сгорания. Стандартная теплота образования определяется как количество тепла, поглощенного или выделенного при 25°C (77°F) и давлении в одну атмосферу, когда один моль соединения образуется из составляющих его элементов, причем каждое вещество находится в своем нормальном физическом состоянии. (газообразное, жидкое или твердое). Теплоте образования элемента произвольно присваивается нулевое значение. Стандартная теплота сгорания определяется аналогичным образом как количество теплоты, выделяющееся при 25°С и давлении в одну атмосферу, когда один моль вещества сгорает в избытке кислорода. Метод расчета теплот реакций по измеренным значениям теплот образования и сгорания основан на принципе, известном как закон суммирования теплот Гесса.
Эти данные обычно принимают в виде стандартных теплот образования и теплот сгорания. Стандартная теплота образования определяется как количество тепла, поглощенного или выделенного при 25°C (77°F) и давлении в одну атмосферу, когда один моль соединения образуется из составляющих его элементов, причем каждое вещество находится в своем нормальном физическом состоянии. (газообразное, жидкое или твердое). Теплоте образования элемента произвольно присваивается нулевое значение. Стандартная теплота сгорания определяется аналогичным образом как количество теплоты, выделяющееся при 25°С и давлении в одну атмосферу, когда один моль вещества сгорает в избытке кислорода. Метод расчета теплот реакций по измеренным значениям теплот образования и сгорания основан на принципе, известном как закон суммирования теплот Гесса.
Редакторы Британской энциклопедии Эта статья была недавно отредактирована и дополнена Эриком Грегерсеном.
Теория переходного состояния | Определение и факты
- Развлечения и поп-культура
- География и путешествия
- Здоровье и медицина
- Образ жизни и социальные вопросы
- Литература
- Философия и религия
- Политика, право и правительство
- Наука
- Спорт и отдых
- Технология
- Изобразительное искусство
- Всемирная история
- В этот день в истории
- Викторины
- Подкасты
- Словарь
- Биографии
- Резюме
- Популярные вопросы
- Обзор недели
- Инфографика
- Демистификация
- Списки
- #WTFact
- Товарищи
- Галереи изображений
- Прожектор
- Форум
- Один хороший факт
- Развлечения и поп-культура
- География и путешествия
- Здоровье и медицина
- Образ жизни и социальные вопросы
- Литература
- Философия и религия
- Политика, право и правительство
- Наука
- Спорт и отдых
- Технология
- Изобразительное искусство
- Всемирная история
- Britannica объясняет
В этих видеороликах Britannica объясняет различные темы и отвечает на часто задаваемые вопросы.
- Britannica Classics
Посмотрите эти ретро-видео из архивов Encyclopedia Britannica. - Demystified Videos
В Demystified у Britannica есть все ответы на ваши животрепещущие вопросы. - #WTFact Видео
В #WTFact Britannica делится некоторыми из самых странных фактов, которые мы можем найти. - На этот раз в истории
В этих видеороликах узнайте, что произошло в этом месяце (или любом другом месяце!) в истории.
- Студенческий портал
Britannica — это главный ресурс для учащихся по ключевым школьным предметам, таким как история, государственное управление, литература и т. д. - Портал COVID-19
Хотя этот глобальный кризис в области здравоохранения продолжает развиваться, может быть полезно обратиться к прошлым пандемиям, чтобы лучше понять, как реагировать сегодня. - 100 женщин
Britannica празднует столетие Девятнадцатой поправки, выделяя суфражисток и политиков, творящих историю.
