Белки — химический состав, структура, общая формула
Поможем понять и полюбить химию
Начать учиться
Белки — основной строительный материал клеток, они составляют 15–20% общей массы человека. Так что разобраться в значении белков для организма человека важно не только ради экзамена по химии, но и для того, чтобы лучше понимать, как мы устроены, правильно питаться и быть здоровым.
Что такое белок. Химический состав и образование белков
Белки — это высокомолекулярные органические соединения, которые состоят из аминокислотных остатков, соединенных между собой пептидной связью. Важно уточнить, что в состав белков входит только 20 альфа-аминокислот, тогда как всего ученым известно около 500 аминокислот. Общая формула белков выглядит следующим образом:
Греческая приставка «альфа-» в названиях альфа-аминокислот взялась из систематической номенклатуры. По ее правилам, следующий после карбоксильной группы углерод получает название первой буквы греческого алфавита — альфа, затем идет буква бета и так далее. В названии аминокислоты указывается греческая буква того углерода, у которого есть заместитель, в данном случае — аминогруппа.
По ее правилам, следующий после карбоксильной группы углерод получает название первой буквы греческого алфавита — альфа, затем идет буква бета и так далее. В названии аминокислоты указывается греческая буква того углерода, у которого есть заместитель, в данном случае — аминогруппа.
Рассмотрим пример образования молекулы белка. Для этого познакомимся сначала с представителем альфа-аминокислот — альфа-аминопропановой кислотой.
Рассматривая строение молекулы, можно увидеть две конкурирующие по свойствам группы: карбоксильную, которая отвечает за кислотные свойства, и аминогруппу, которая отвечает за оснóвные свойства. Две молекулы аминокислот и более могут вступать в реакцию между собой, реагируя по разным функциональным группам. Именно таким образом получается пептид:
Соединение, которое образуется в результате взаимодействия двух аминокислот, называется дипептидом. Благодаря наличию двух свободных функциональных групп (карбоксильной и аминогруппы) дипептид может взаимодействовать с другими аминокислотами, увеличивая свое строение и превращаясь в полипептид.
Благодаря наличию двух свободных функциональных групп (карбоксильной и аминогруппы) дипептид может взаимодействовать с другими аминокислотами, увеличивая свое строение и превращаясь в полипептид.
Полезные подарки для родителей
В колесе фортуны — гарантированные призы, которые помогут наладить учебный процесс и выстроить отношения с ребёнком!
Аминокислоты и их значение для человеческого организма
Говоря об аминокислотах, важно рассмотреть понятие незаменимости. Основной критерий определения биологической ценности аминокислоты — это способность поддерживать рост человека, что, в свою очередь, связано с синтезом белка в живом организме.
Незаменимые аминокислоты — это такие кислоты, которые либо не синтезируются в организме, либо синтезируются со скоростью, недостаточной для обмена веществ и образования новых клеток и тканей.
Если исключить из рациона хотя бы одну из незаменимых аминокислот, это повлечет за собой задержку роста и снижение массы тела растущего организма.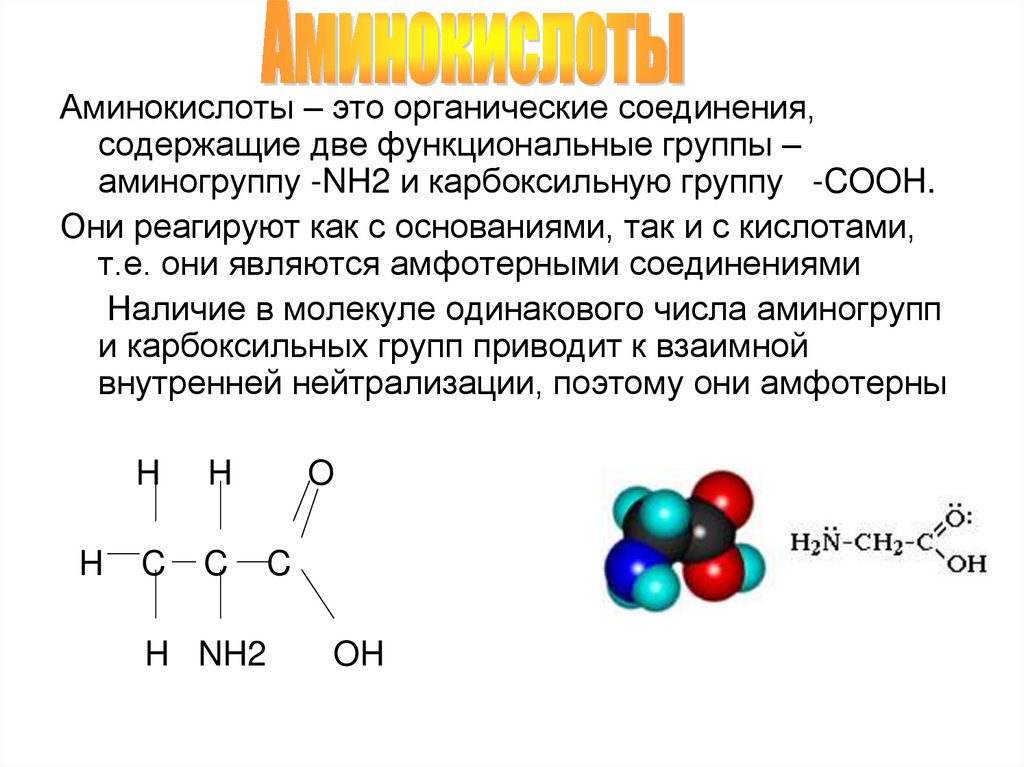
К незаменимым аминокислотам относятся валин, изолейцин, лейцин, лизин, метионин, треонин, триптофан, фенилаланин.
Заменимые аминокислоты
| аланин | глицин | серин |
| аргинин | глютамин | таурин |
| аспарагин | инозитол | тирозин |
| аспартат | орнитин | цистеин |
| гистидин | пролин | цитруллин |
Давайте рассмотрим основные функции некоторых аминокислот в организме человека, чтобы лучше понять их значение:
аспартат используется для процессов регенерации;
-
гистидин необходим маленьким детям, у которых недостаточен эндогенный синтез;
глютамин нужен для регенерационных процессов, важный энергетический субстрат в критических состояниях;
таурин нужен новорожденным, у которых недостаточен эндогенный синтез, а также больным в критических состояниях.
 Дефицит таурина возникает при недостатке метионина и цистеина;
Дефицит таурина возникает при недостатке метионина и цистеина;тирозин необходим маленьким детям, у которых недостаточен эндогенный синтез. При нарушении функции почек снижено образование тирозина из фенилаланина;
цистеин необходим маленьким детям, у которых недостаточен эндогенный синтез. Дефицит цистеина возникает при недостаточном содержании метионина в питании. Необходим при нарушениях функции печени, а также больным в критических состояниях.
Пептиды
Вернемся к продукту синтеза двух аминокислот — пептиду — и дадим ему определение.
Пептид — это продукт конденсации двух аминокислот или более, соединенных пептидной связью.
Пептид и белок — это одно и то же? Между ними действительно есть сходство, но есть и различия:
Основные различия — это структура и размер.
 Белки значительно больше пептидов. Пептиды состоят из 2–50 аминокислот, а белки — из более чем 50 аминокислот.
Белки значительно больше пептидов. Пептиды состоят из 2–50 аминокислот, а белки — из более чем 50 аминокислот.- Пептиды менее строго определены в структуре, в то время как белки могут принимать сложные конформации.
Пептиды делятся на олигопептиды и полипептиды, а белок состоит из нескольких полипептидов.
Какие бывают белки
По строению
По строению белки делятся на простые (протеины) и сложные (протеиды):
составными частями простых белков являются в большинстве 20 различных остатков α–аминокислот;
сложные белки могут содержать ионы металлов или образовывать комплексные соединения с углеводами, липидами и др.
По форме молекулы
По форме молекулы белки подразделяются на глобулярные и фибриллярные:
форма молекулы
 Например, альбумин (яичный белок), казеин (молочный белок). Такие белки растворимы в воде;
Например, альбумин (яичный белок), казеин (молочный белок). Такие белки растворимы в воде;форма молекулы фибриллярных белков — фибрилла (нити или волокна). Например, кератин (волосы, ногти, перья), коллаген (мускулы, сухожилия). Эти белки в воде не растворяются.
По аминокислотному составу
Как мы уже знаем, существуют незаменимые аминокислоты. Так вот, исходя из их наличия, белки бывают либо полноценные, либо неполноценные:
к полноценным относятся белки животного происхождения, также полноценные белки содержат некоторые растения: картофель, бобовые и другие;
- к неполноценным относятся желатин и белки преимущественно растительного происхождения.
По растворимости
Растворимость белков зависит от их структуры, величины рН, солевого состава раствора, температуры и определяется природой тех групп, которые находятся на поверхности белковой молекулы.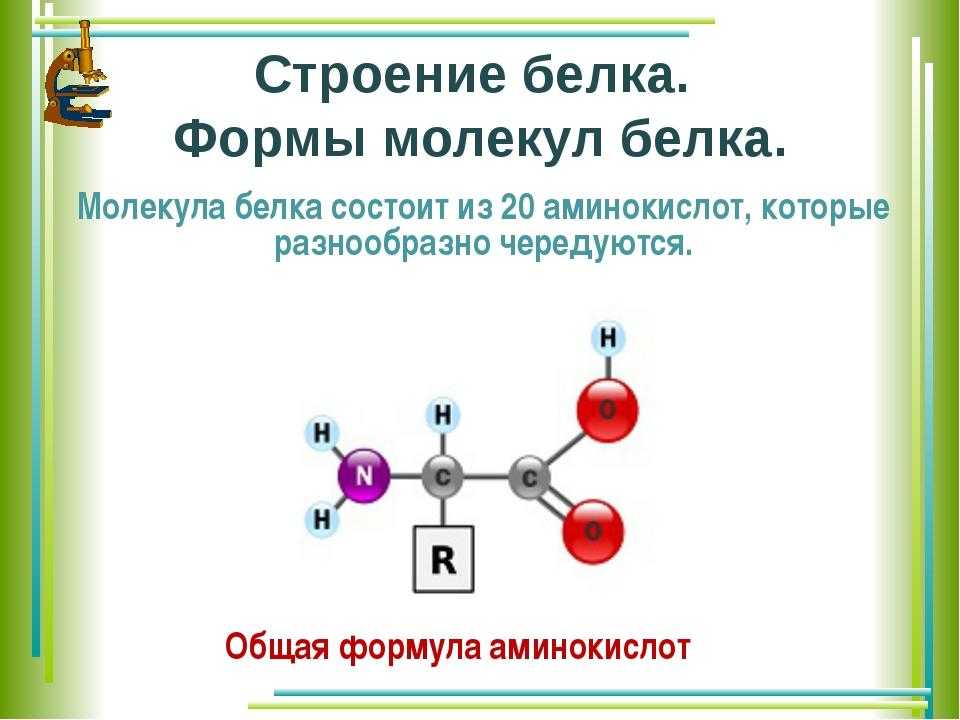
Так, существуют белки (глобулины), которые растворяются только в растворах солей и не растворяются в чистой воде, а противоположные им альбумины хорошо растворимы в чистой воде.
К нерастворимым белкам относятся кератин (волосы, ногти, перья), коллаген (сухожилия), фиброин (шелк, паутина).
Чтобы запомнить классификацию белков было проще, показали ее на картинке:
Структура белков
После того как мы рассмотрели все производные белков, пора переходить к структуре белков.
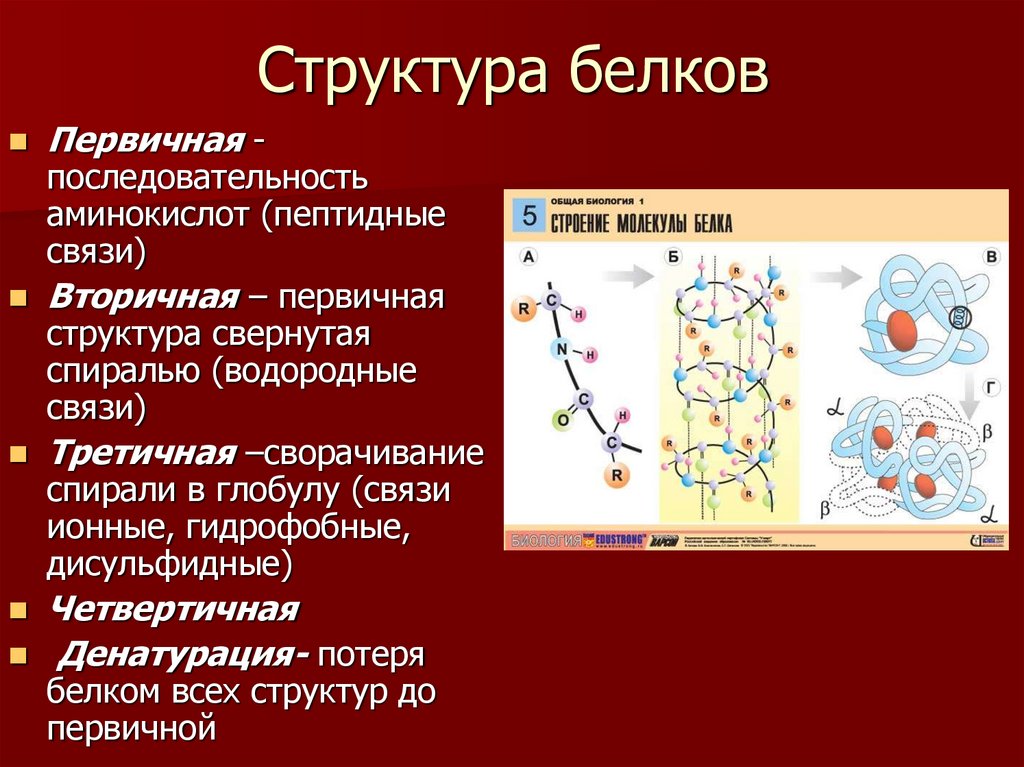
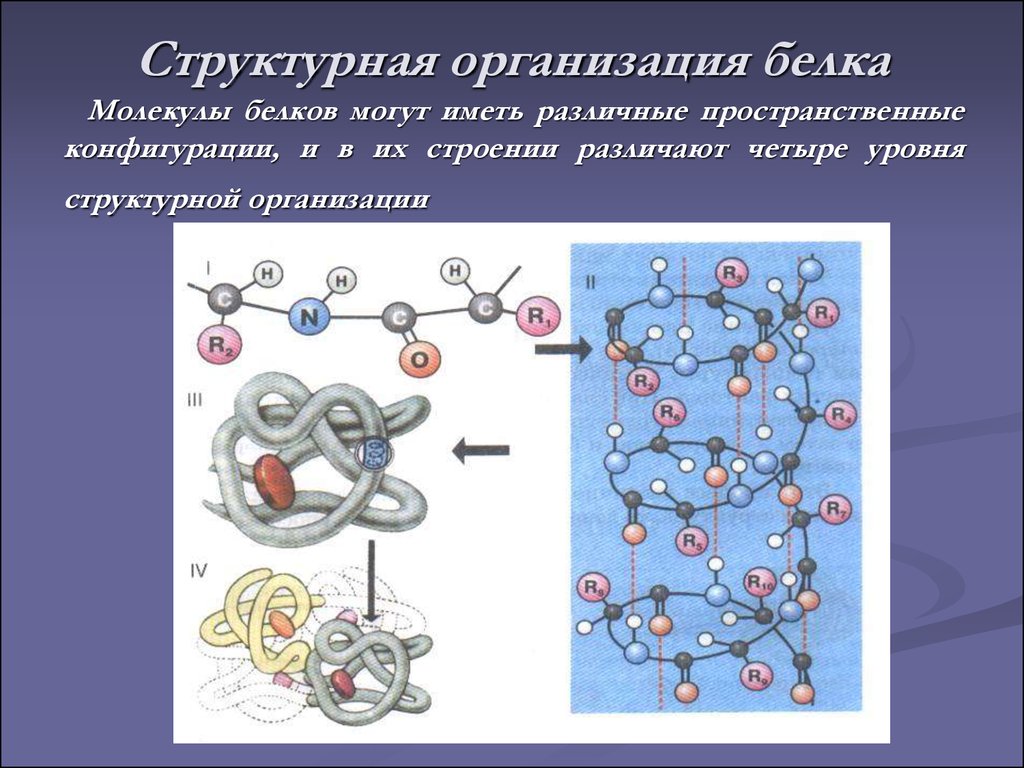
Как видно из рисунка, белки имеют 4 структуры: первичную, вторичную, третичную и четвертичную. Рассмотрим каждую чуть более подробно.
Первичная структура белка — это простейший вид белковой структуры. Представляет собой последовательность аминокислот в полипептидной цепи. Последовательность аминокислот в белке определяется ДНК, а именно геном, кодирующим этот белок.
 Изменение всего лишь одной аминокислоты влечет за собой последствия: например, если вместо глутаминовой кислоты в молекуле гемоглобина находится валин, то у человека образуется серповидноклеточная анемия. При замене глутаминовой кислоты на валин клетки гемоглобина вытягиваются и принимают форму месяца или серпа.
Изменение всего лишь одной аминокислоты влечет за собой последствия: например, если вместо глутаминовой кислоты в молекуле гемоглобина находится валин, то у человека образуется серповидноклеточная анемия. При замене глутаминовой кислоты на валин клетки гемоглобина вытягиваются и принимают форму месяца или серпа.Вторичная структура — пространственная структура, которая образуется в результате взаимодействия функциональных групп пептидного остова (полипептидная цепь без атомов R-групп). Самые распространенные формы вторичной структуры — это α-спираль и β-лист. Обе структуры удерживают форму благодаря водородным связям между кислородом карбонильной группы одной аминокислоты и водородом аминогруппы другой аминокислоты.
Третичная структура — это пространственное строение всей молекулы белка, состоящей из единственной цепи.
 Эта структура обусловлена взаимодействиями между R-группами аминокислот, которые входят в состав белка. Среди взаимодействий между R-группами, формирующими третичную структуру, встречаются водородные, ионные и диполь-дипольные связи, а также дисперсионные силы.
Эта структура обусловлена взаимодействиями между R-группами аминокислот, которые входят в состав белка. Среди взаимодействий между R-группами, формирующими третичную структуру, встречаются водородные, ионные и диполь-дипольные связи, а также дисперсионные силы.Четвертичная структура — взаимное расположение нескольких полипептидных цепей в составе единого белкового комплекса.
Подробнее об основных функциях белков и их химических свойствах можно узнать из другой нашей статьи. А чтобы убедиться, что вы запомнили характеристику белков, их строение, структуру и функции, приходите на онлайн-курсы химии в школу Skysmart. Здесь вас ждут интересные факты из мира химии, интерактивные задания и опытные преподаватели, которые всегда помогут и поддержат.
Ксения Боброва
К предыдущей статье
Тепловой эффект
К следующей статье
Моносахариды
Получите план обучения, который поможет понять и полюбить химию
На вводном уроке с методистом
Выявим пробелы в знаниях и дадим советы по обучению
Расскажем, как проходят занятия
Подберём курс
§ 9.
 Физико-химические свойства белков
Физико-химические свойства белков§ 9. ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА БЕЛКОВ
Белки – это очень крупные молекулы, по своим размерам они могут уступать только отдельным представителям нуклеиновых кислот и полисахаридам. В таблице 4 представлены молекулярные характеристики некоторые белков.
Таблица 4
Молекулярные характеристики некоторых белков
|
Белок |
Относитель-ная молекулярная масса |
Число цепей |
Число аминокислотных остатков |
|
Инсулин |
5733 |
2 |
51 |
|
Рибонуклеаза |
13683 |
1 |
|
|
Миоглобин |
16890 |
1 |
153 |
|
Химотрипсин |
22600 |
3 |
241 |
|
Гемоглобин |
64500 |
4 |
574 |
|
Глутамат-дегидрогеназа |
~1000000 |
~40 |
~8300 |
В молекулах белков может содержаться самое разное количество аминокислотных остатков — от 50 и до нескольких тысяч; относительные молекулярные массы белков также сильно колеблются — от нескольких тысяч (инсулин, рибонуклеаза) до миллиона (глутаматдегидрогеназа) и более.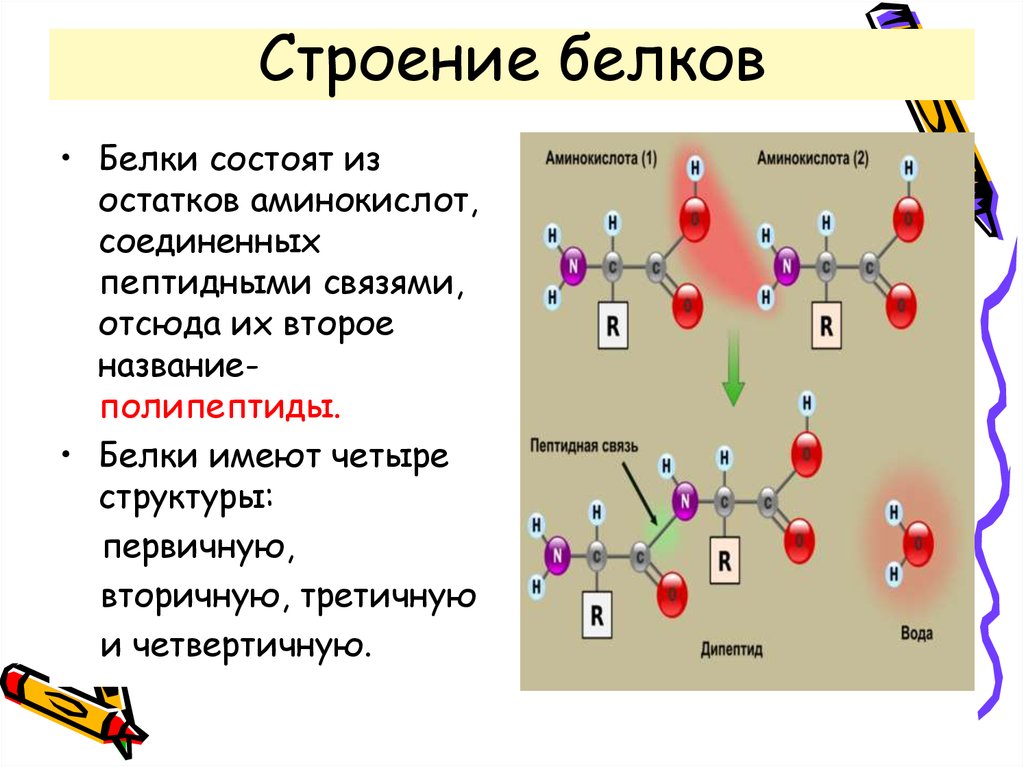 Число полипептидных цепей в составе белков может составлять от единицы до нескольких десятков и даже тысяч. Так, в состав белка вируса табачной мозаики входит 2120 протомеров.
Число полипептидных цепей в составе белков может составлять от единицы до нескольких десятков и даже тысяч. Так, в состав белка вируса табачной мозаики входит 2120 протомеров.
Зная относительную молекулярную массу белка, можно приблизительно оценить, какое число аминокислотных остатков входит в его состав. Средняя относительная молекулярная масса аминокислот, образующих полипептидную цепь, равна 128. При образовании пептидной связи происходит отщепление молекулы воды, следовательно, средняя относительная масса аминокислотного остатка составит 128 – 18 = 110. Используя эти данные, можно подсчитать, что белок с относительной молекулярной массой 100000 будет состоять приблизительно из 909 аминокислотных остатков.
Электрические свойства белковых молекул
Электрические свойства белков определяются присутствием на их поверхности положительно и отрицательно заряженных аминокислотных остатков. Наличие заряженных группировок белка определяет суммарный заряд белковой молекулы.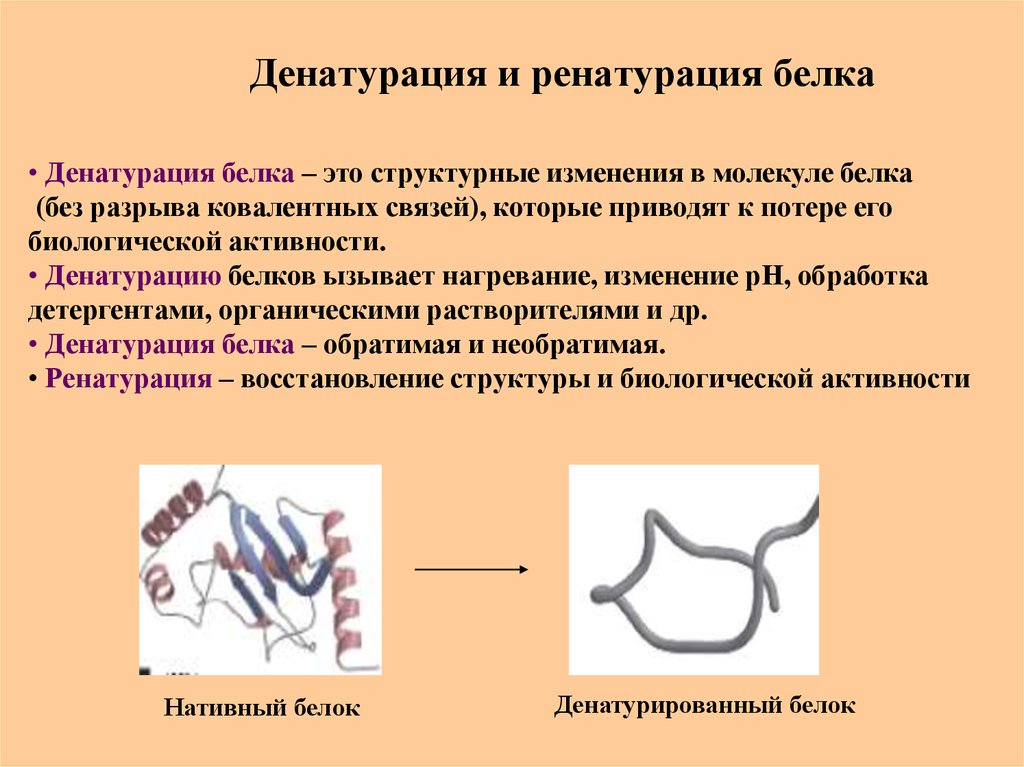 Если в белках преобладают отрицательно заряженные аминокислоты, то его молекула в нейтральном растворе будет иметь отрицательный заряд, если преобладают положительно заряженные – молекула будет иметь положительный заряд. Суммарный заряд белковой молекулы зависит и от кислотности (рН) среды. При увеличении концентрации ионов водорода (увеличении кислотности) происходит подавление диссоциации карбоксильных групп:
Если в белках преобладают отрицательно заряженные аминокислоты, то его молекула в нейтральном растворе будет иметь отрицательный заряд, если преобладают положительно заряженные – молекула будет иметь положительный заряд. Суммарный заряд белковой молекулы зависит и от кислотности (рН) среды. При увеличении концентрации ионов водорода (увеличении кислотности) происходит подавление диссоциации карбоксильных групп:
и в то же время увеличивается число протонированных амино-групп;
.
Таким образом, при увеличении кислотности среды происходит уменьшение на поверхности молекулы белка числа отрицательно заряженных и увеличение числа положительно заряженных групп. Совсем другая картина наблюдается при снижении концентрации ионов водорода и увеличении концентрации гидроксид-ионов. Число диссоциированных карбоксильных групп возрастает
и снижается число протонированных аминогрупп
.
Итак, изменяя кислотность среды, можно изменить и заряд молекулы белка.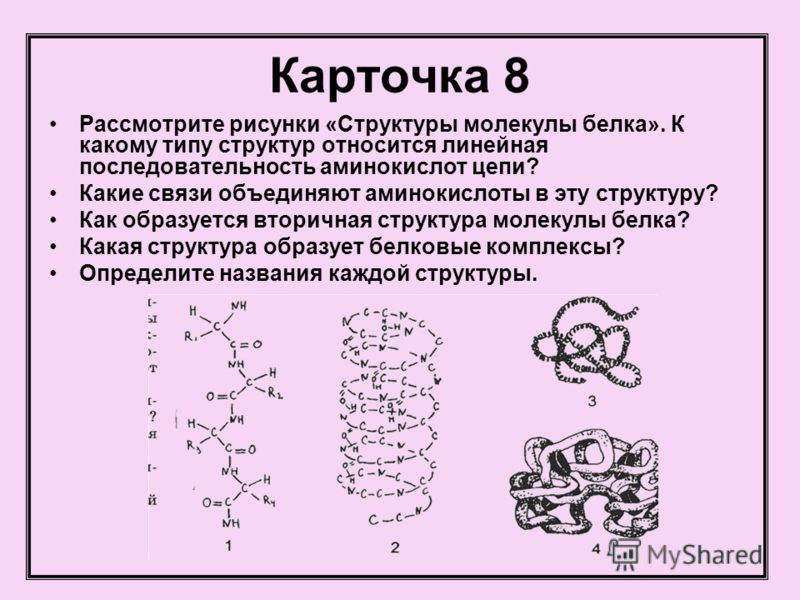 При увеличении кислотности среды в молекуле белка снижается число отрицательно заряженных группировок и увеличивается число положительно заряженных, молекула постепенно теряет отрицательный и приобретает положительный заряд. При снижении кислотности раствора наблюдается противоположная картина. Очевидно, что при определенных значениях рН молекула будет электронейтральной, т.е. число положительно заряженных групп будет равно числу отрицательно заряженных групп, и суммарный заряд молекулы будет равен нулю (рис. 14).
При увеличении кислотности среды в молекуле белка снижается число отрицательно заряженных группировок и увеличивается число положительно заряженных, молекула постепенно теряет отрицательный и приобретает положительный заряд. При снижении кислотности раствора наблюдается противоположная картина. Очевидно, что при определенных значениях рН молекула будет электронейтральной, т.е. число положительно заряженных групп будет равно числу отрицательно заряженных групп, и суммарный заряд молекулы будет равен нулю (рис. 14).
Значение рН, при котором суммарный заряд белка равен нулю, называется изоэлектрической точкой и обозначается pI.
Рис. 14. В состоянии изоэлектрической точки суммарный заряд молекулы белка равен нулю
Изоэлектрическая точка для большинства белков находится в области рН от 4,5 до 6,5. Однако есть и исключения. Ниже приведены изоэлектрические точки некоторых белков:
|
Белок |
pI |
|
Пепсин |
1,0 |
|
Каталаза |
5,1 |
|
Рибонуклеаза |
7,8 |
|
Лизоцим |
11,0 |
При значениях рН ниже изоэлектрической точки белок несет суммарный положительный заряд, выше – суммарный отрицательный.
В изоэлектрической точке растворимость белка минимальна, так как его молекулы в таком состоянии электронейтральны и между ними нет сил взаимного отталкивания, поэтому они могут «слипаться» за счет водородных и ионных связей, гидрофобных взаимодействий, ван-дер-ваальсовых сил. При значениях рН, отличающихся от рI, молекулы белка будут нести одинаковый заряд — либо положительный, либо отрицательный. В результате этого между молекулами будут существовать силы электростатического отталкивания, препятствующие их «слипанию», растворимость будет выше.
Растворимость белков
Белки бывают растворимые и нерастворимые в воде. Растворимость белков зависит от их структуры, величины рН, солевого состава раствора, температуры и других факторов и определяется природой тех групп, которые находятся на поверхности белковой молекулы. К нерастворимым белкам относятся кератин (волосы, ногти, перья), коллаген (сухожилия), фиброин (щелк, паутина).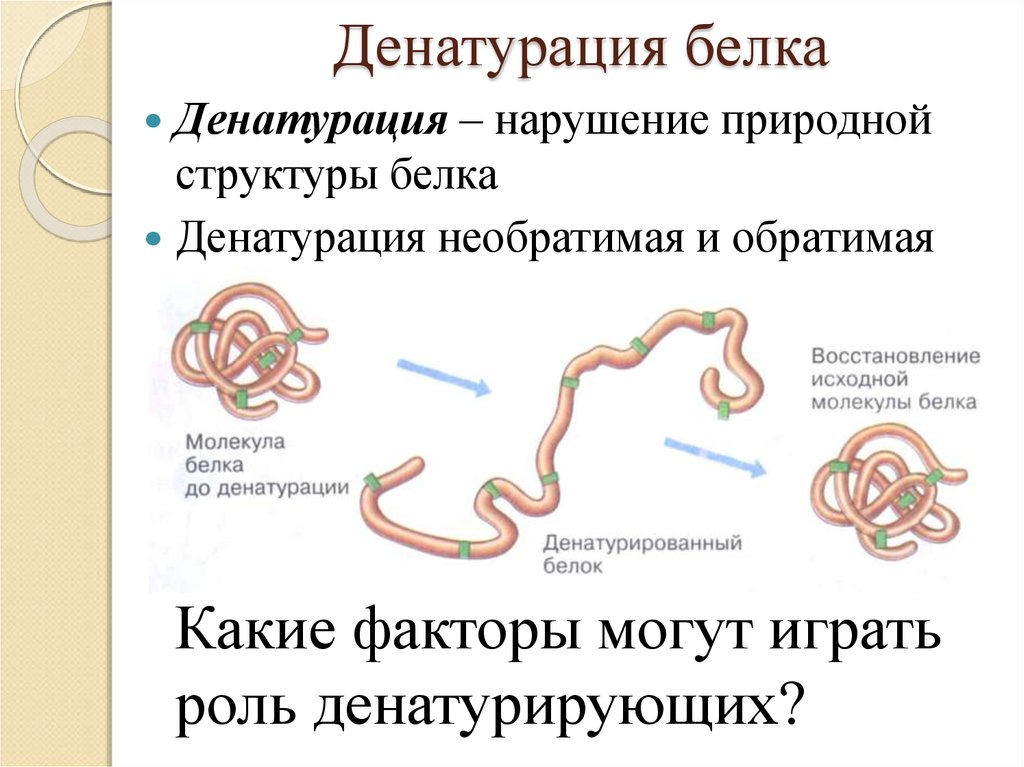 Многие другие белки растворимы в воде. Растворимость определяется наличием на их поверхности заряженных и полярных группировок (-СОО—, -NH3+, -OH и др.). Заряженные и полярные группировки белков притягивают к себе молекулы воды, и вокруг них формируется гидратная оболочка (рис. 15), существование которой обусловливает их растворимость в воде.
Многие другие белки растворимы в воде. Растворимость определяется наличием на их поверхности заряженных и полярных группировок (-СОО—, -NH3+, -OH и др.). Заряженные и полярные группировки белков притягивают к себе молекулы воды, и вокруг них формируется гидратная оболочка (рис. 15), существование которой обусловливает их растворимость в воде.
Рис. 15. Образование гидратной оболочки вокруг молекулы белка.
На растворимость белка влияет наличие нейтральных солей (Na2SO4, (NH4)2SO4 и др.) в растворе. При малых концентрациях солей растворимость белка увеличивается (рис. 16), так как в таких условиях увеличивается степень диссоциации полярных групп и экранируются заряженные группы белковых молекул, тем самым снижается белок-белковое взаимодействие, способствующее образованию агрегатов и выпадению белка в осадок. При высоких концентрациях солей растворимость белка снижается (рис. 16) вследствие разрушения гидратной оболочки, приводящего к агрегации молекул белка.
16) вследствие разрушения гидратной оболочки, приводящего к агрегации молекул белка.
Рис. 16. Зависимость растворимости белка от концентрации соли
Существуют белки, которые растворяются только в растворах солей и не растворяются в чистой воде, такие белки называют глобулины. Существуют и другие белки – альбумины, они в отличие от глобулинов хорошо растворимы в чистой воде.
Растворимость белков зависит и от рН растворов. Как мы уже отмечали, минимальной растворимостью обладают белки в изоэлектрической точке, что объясняется отсутствием электростатического отталкивания между молекулами белка.
При определенных условиях белки могут образовывать гели. При образовании геля молекулы белка формируют густую сеть, внутреннее пространство которой заполнено растворителем. Гели образуют, например, желатина (этот белок используют для приготовления желе) и белки молока при приготовлении простокваши.
На растворимость белка оказывает влияние и температура. При действии высокой температуры многие белки выпадают в осадок вследствие нарушения их структуры, но об этом более подробно поговорим в следующем разделе.
При действии высокой температуры многие белки выпадают в осадок вследствие нарушения их структуры, но об этом более подробно поговорим в следующем разделе.
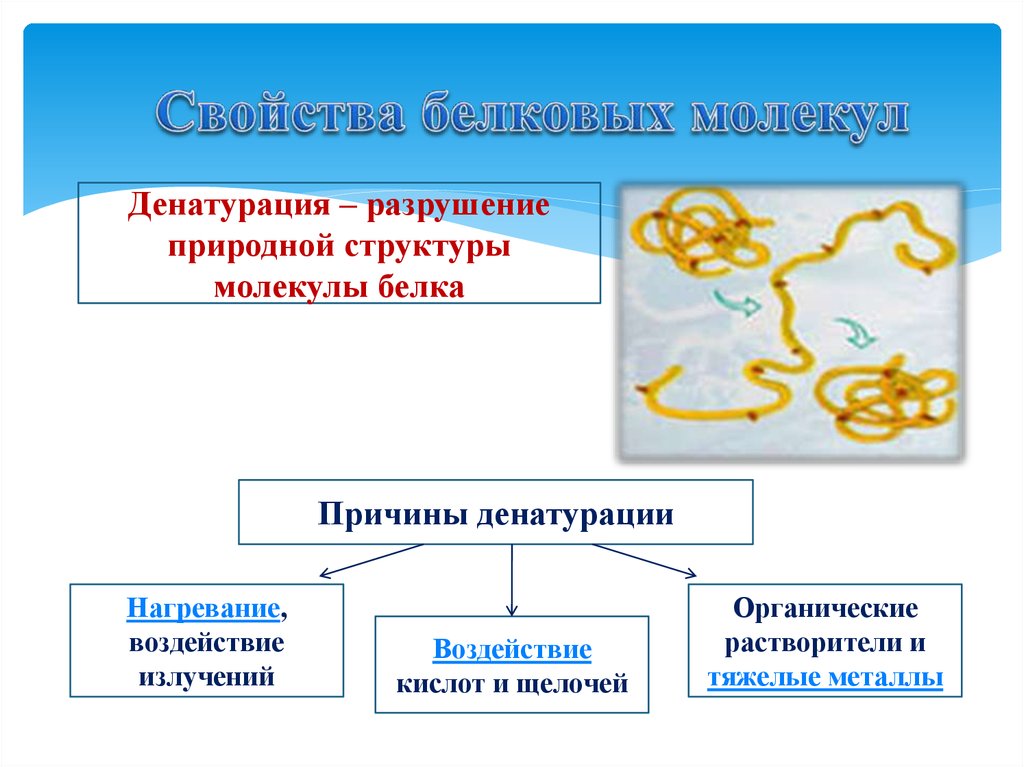
Денатурация белка
Рассмотрим хорошо нам знакомое явление. При нагревании яичного белка происходит постепенное его помутнение, и затем образуется твердый сгусток. Свернувшийся яичный белок – яичный альбумин – после охлаждения оказывается нерастворимым, в то время как до нагревания яичный белок хорошо растворялся в воде. Такие же явления происходят и при нагревании практически всех глобулярных белков. Те изменения, которые произошли при нагревании, называются денатурацией. Белки в естественном состоянии носят название нативных белков, а после денатурации — денатурированных.
При денатурации происходит нарушение нативной кон-формации белков в результате разрыва слабых связей (ион-ных, водородных, гидрофобных взаимодействий). В результате этого процесса могут разрушаться четвертичная, третичная и вторичные структуры белка. Первичная структура при этом сохраняется (рис. 17).
Первичная структура при этом сохраняется (рис. 17).
Рис. 17. Денатурация белка
При денатурации гидрофобные радикалы аминокислот, находящиеся в нативных белках в глубине молекулы, оказываются на поверхности, в результате создаются условия для агрегации. Агрегаты белковых молекул выпадают в осадок. Денатурация сопровождается потерей биологической функции белка.
Денатурация белка может быть вызвана не только повышенной температурой, но и другими факторами. Кислоты и щелочи способны вызвать денатурацию белка: в результате их действия происходит перезарядка ионогенных групп, что приводит к разрыву ионных и водородных связей. Мочевина разрушает водородные связи, следствием этого является потеря белками своей нативной структуры. Денатурирующими агентами являются органические растворители и ионы тяжелых металлов: органические растворители разрушают гидрофобные связи, а ионы тяжелых металлов образуют нерастворимые комплексы с белками.
Наряду с денатурацией существует и обратный процесс – ренатурация. При снятии денатурирующего фактора возможно восстановление исходной нативной структуры. Например, при медленном охлаждении до комнатной температуры раствора восстанавливается нативная структура и биологическая функция трипсина.
Белки могут денатурировать и в клетке при протекании нормальных процессов жизнедеятельности. Совершенно очевидно, что утрата нативной структуры и функции белков – крайне нежелательное событие. В связи с этим следует упомянуть об особых белках – шаперонах. Эти белки способны узнавать частично денатурированные белки и, связываясь с ними, восстанавливать их нативную конформацию. Шапероны также узнают белки, процесс денатурации которых зашел далеко, и транспортируют их в лизосомы, где происходит их расщепление (деградация). Шапероны играют важную роль и в процессе формирования третичной и четвертичной структур во время синтеза белка.
Интересно знать! В настоящее время часто упоминается такое заболевание, как коровье бешенство.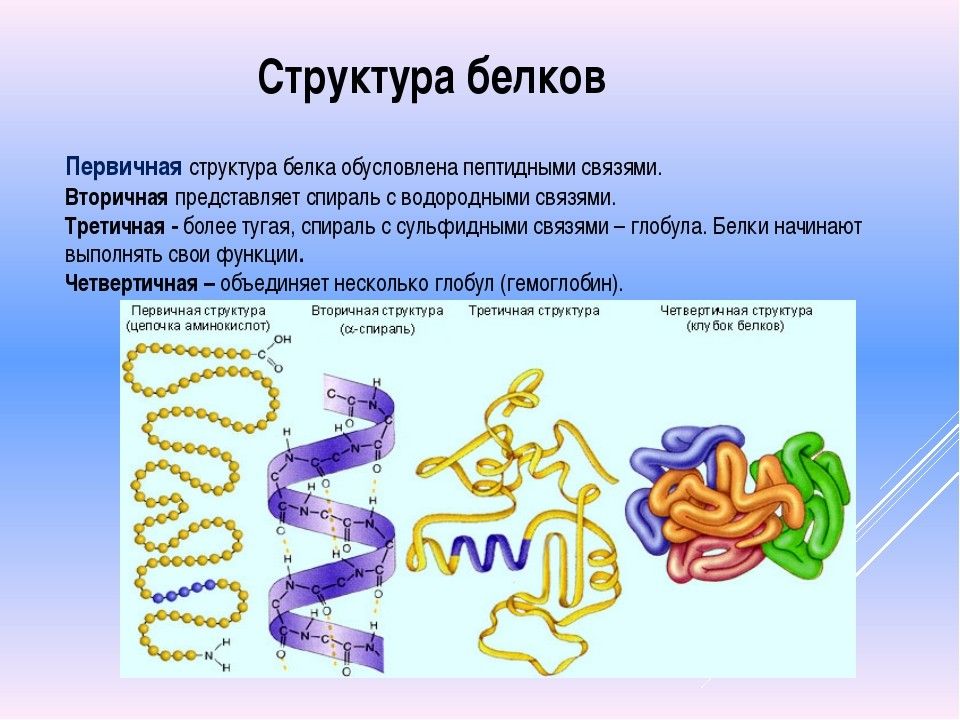 Эту болезнь вызывают прионы. Они могут вызывать у животных и человека и другие заболевания, носящие нейродегенеративный характер. Прионы – это инфекционные агенты белковой природы. Прион, попадая в клетку, вызывает изменение конформации своего клеточного аналога, который сам становится прионом. Так возникает заболевание. Прионный белок отличается от клеточного по вторичной структуре. Прионная форма белка имеет в основном b-складчатую структуру, а клеточная – a-спиральную.
Эту болезнь вызывают прионы. Они могут вызывать у животных и человека и другие заболевания, носящие нейродегенеративный характер. Прионы – это инфекционные агенты белковой природы. Прион, попадая в клетку, вызывает изменение конформации своего клеточного аналога, который сам становится прионом. Так возникает заболевание. Прионный белок отличается от клеточного по вторичной структуре. Прионная форма белка имеет в основном b-складчатую структуру, а клеточная – a-спиральную.
5.3: Белки — Многофункциональные компоненты — Биология LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 74508
Может ли что-либо или все входить или выходить из клетки?
Нет.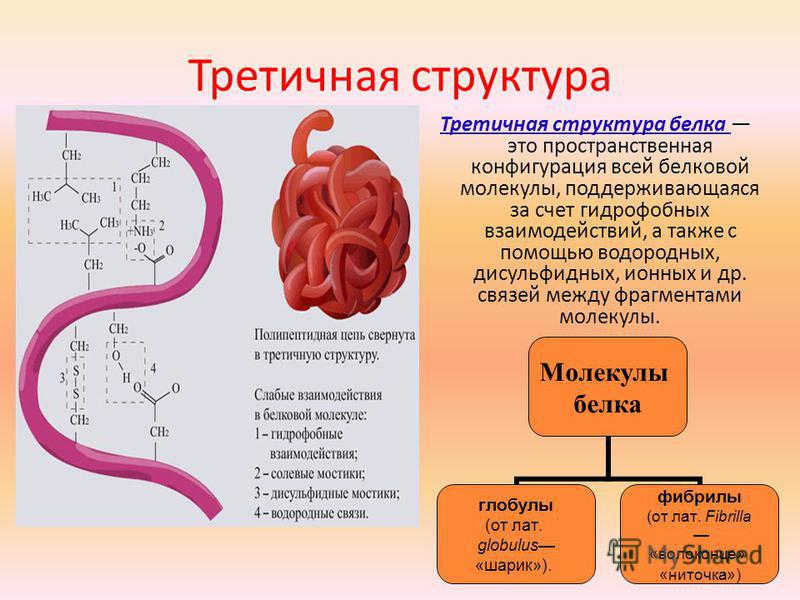 Именно полупроницаемая плазматическая мембрана определяет, что может войти и выйти из клетки. Итак, если не все может пересечь мембрану, то как некоторые вещи проходят через нее?
Именно полупроницаемая плазматическая мембрана определяет, что может войти и выйти из клетки. Итак, если не все может пересечь мембрану, то как некоторые вещи проходят через нее?
Плазматическая мембрана содержит молекулы, отличные от фосфолипидов, прежде всего другие липиды и белки. Зеленые молекулы на рисунке ниже, например, представляют собой липидный холестерин. Молекулы холестерина помогают плазматической мембране сохранять свою форму. Многие белки плазматической мембраны помогают другим веществам пересекать мембрану.
Плазматические мембраны также содержат определенные типы белков. Мембранный белок представляет собой белковую молекулу, которая прикреплена к мембране клетки или органеллы или связана с ней. Мембранные белки можно разделить на две группы в зависимости от того, как белок связан с мембраной.
Интегральные мембранные белки постоянно встроены в плазматическую мембрану. Они выполняют ряд важных функций.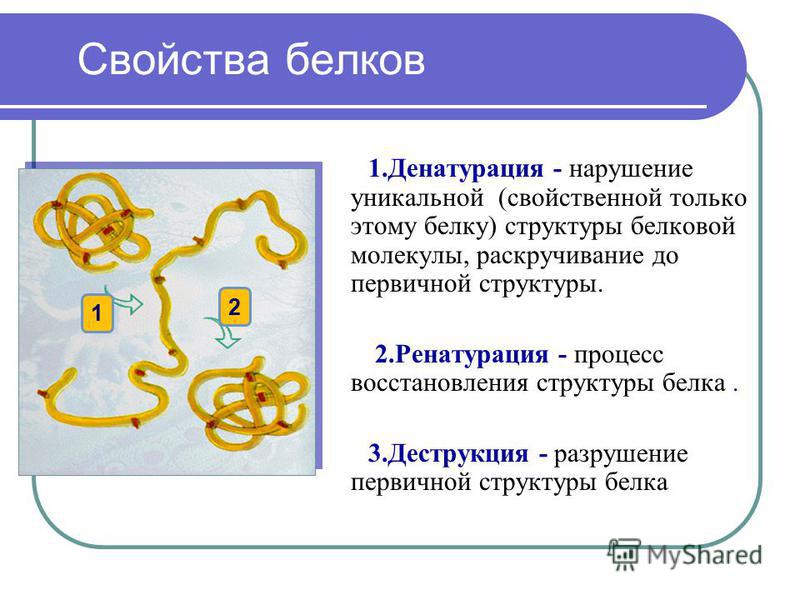 Такие функции включают канализацию или транспортировку молекул через мембрану. Другие интегральные белки действуют как клеточные рецепторы. Интегральные мембранные белки можно классифицировать в соответствии с их отношением к бислою:
Такие функции включают канализацию или транспортировку молекул через мембрану. Другие интегральные белки действуют как клеточные рецепторы. Интегральные мембранные белки можно классифицировать в соответствии с их отношением к бислою:
- Трансмембранные белки охватывают всю плазматическую мембрану. Трансмембранные белки встречаются во всех типах биологических мембран.
- Интегральные монотопные белки прочно прикреплены к мембране только с одной стороны.
Некоторые интегральные мембранные белки ответственны за клеточную адгезию (прилипание клетки к другой клетке или поверхности). На внешней стороне клеточных мембран и прикрепленных к некоторым белкам углеводных цепях, которые действуют как метки, идентифицирующие тип клетки. Показано в На рисунке ниже показаны два различных типа мембранных белков и связанных с ними молекул.
Белки периферической мембраны — это белки, которые только временно связаны с мембраной. Их можно легко удалить, что позволяет им участвовать в клеточной передаче сигналов. Периферические белки также могут быть присоединены к интегральным мембранным белкам или они могут сами по себе прикрепляться к небольшому участку липидного двойного слоя. Периферические мембранные белки часто связаны с ионными каналами и трансмембранными рецепторами. Большинство белков периферических мембран являются гидрофильными.
Их можно легко удалить, что позволяет им участвовать в клеточной передаче сигналов. Периферические белки также могут быть присоединены к интегральным мембранным белкам или они могут сами по себе прикрепляться к небольшому участку липидного двойного слоя. Периферические мембранные белки часто связаны с ионными каналами и трансмембранными рецепторами. Большинство белков периферических мембран являются гидрофильными.
Некоторые мембранные белки составляют основную транспортную систему, которая перемещает молекулы и ионы через полярный бислой фосфолипидов.
Модель Fluid Mosaic
В 1972 году С.Дж. Зингер и Г. Л. Николсон предложили широко распространенную в настоящее время Fluid Mosaic Model структуры клеточных мембран. Модель предполагает, что интегральные мембранные белки встроены в бислой фосфолипидов, как показано на рисунке выше. Некоторые из этих белков проходят через бислой полностью, а некоторые лишь частично. Эти мембранные белки действуют как транспортные белки и белки-рецепторы.
Эти мембранные белки действуют как транспортные белки и белки-рецепторы.
В их модели также предполагалось, что мембрана ведет себя как жидкость, а не как твердое тело. Белки и липиды мембраны движутся вокруг мембраны, подобно буям в воде. Такое движение вызывает постоянное изменение «мозаичного рисунка» плазматической мембраны.
Дальнейшее описание жидкостной мозаичной модели можно посмотреть по адресу http://www.youtube.com/watch?v=Qqsf_UJcfBc (1:27).
Расширения плазматической мембраны
Плазматическая мембрана может иметь расширения, например хлыстообразные жгутики или кистевидные реснички . У одноклеточных организмов, подобных тем, что показаны на рис. ниже, расширения мембраны могут помогать организмам двигаться. В многоклеточных организмах отростки выполняют другие функции. Например, реснички на клетках легких человека сметают инородные частицы и слизь по направлению ко рту и носу.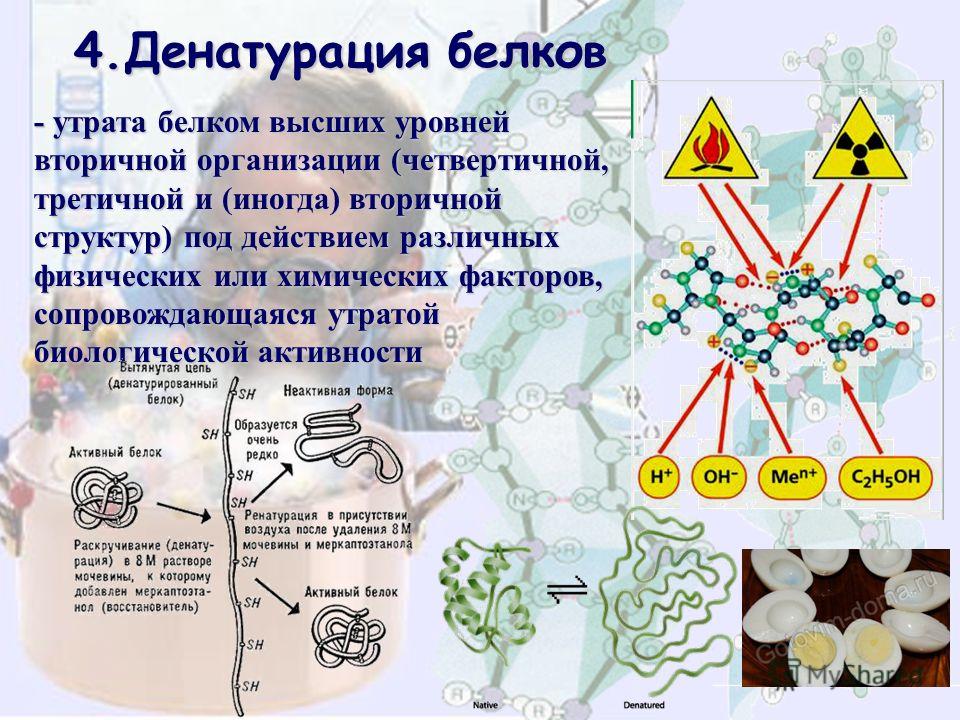
Жгутики и реснички. Реснички и жгутики являются продолжением плазматической мембраны многих клеток.
Резюме
- Плазматическая мембрана содержит множество белков, помогающих другим веществам проникать через мембрану.
- Жидкостная мозаичная модель отражает биологическую природу плазматической мембраны.
- Реснички и жгутики являются продолжением плазматической мембраны.
Узнать больше
Используйте эти ресурсы, чтобы ответить на следующие вопросы.
Узнайте больше I
- Мембраны клеток на http://johnkyrk.com/cellmembrane.html.
- Какова основная роль многих мембранных белков?
- Какая часть генетического материала клетки может кодировать мембранные белки?
- Что такое трансмембранные белки и какова их основная функция?
- Каким образом через мембрану может образоваться белковый «туннель»?
- Каким образом белковый «канал» может образовываться через мембрану?
Подробнее II
- Создание клеточной мембраны на http://www.
 wisc-online.com/Objects/ViewObject.aspx?ID=AP1101.
wisc-online.com/Objects/ViewObject.aspx?ID=AP1101.
- Как молекулы воды могут попасть в клетку?
- Как ионы могут попасть в клетку?
- Какой тип(ы) белка(ов) идентифицируют клетку?
- Какая молекула содержится в мембранах клеток животных, но не содержится в клетках растений?
Обзор
- В чем основное различие между двумя основными типами белков, ассоциированных с плазматической мембраной?
- Каковы две функции интегральных мембранных белков?
- Обсудите мозаичную модель жидкости.
- Что такое жгутики и реснички?
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Автор
- Фонд CK-12
- Лицензия
- CC BY-NC
- Программа OER или Publisher
- СК-12
- Показать оглавление
- нет
- Включено
- да
- Теги
- источник[1]-био-6442
Многофункциональные белки (молекулярная биология)
Многофункциональные белки объединяют несколько автономных функций в одной полипептидной цепи. В этом смысле автономия подразумевает, что каждая функция закреплена за отдельной областью или доменом полипептидной цепи. Многофункциональные белки отличаются от мультиферментных комплексов, в которых различные полипептиды связаны нековалентно. Это определение не включает ферменты, катализирующие разные реакции с использованием одного и того же активного центра, такие как аспарагиназа, функционирующая как глутаминаза, фосфоглицеромутаза, которая может катализировать три разные реакции с использованием одного и того же реакционного центра, или цистатионин-g-синтаза, которая может катализировать целый ряд аналогичных реакций. реакций из-за относительной недостаточности субстратной специфичности. Аллостерические ферменты не считаются многофункциональными. Хотя они и обладают сайтами связывания эффекторных лигандов (ингибиторов или активаторов), расположенными в разных участках полипептидной цепи, они определены только в отношении каталитической функции.
В этом смысле автономия подразумевает, что каждая функция закреплена за отдельной областью или доменом полипептидной цепи. Многофункциональные белки отличаются от мультиферментных комплексов, в которых различные полипептиды связаны нековалентно. Это определение не включает ферменты, катализирующие разные реакции с использованием одного и того же активного центра, такие как аспарагиназа, функционирующая как глутаминаза, фосфоглицеромутаза, которая может катализировать три разные реакции с использованием одного и того же реакционного центра, или цистатионин-g-синтаза, которая может катализировать целый ряд аналогичных реакций. реакций из-за относительной недостаточности субстратной специфичности. Аллостерические ферменты не считаются многофункциональными. Хотя они и обладают сайтами связывания эффекторных лигандов (ингибиторов или активаторов), расположенными в разных участках полипептидной цепи, они определены только в отношении каталитической функции.
Многофункциональные белки обычно имеют разные каталитические функции, находящиеся в отдельных доменах одной и той же полипептидной цепи.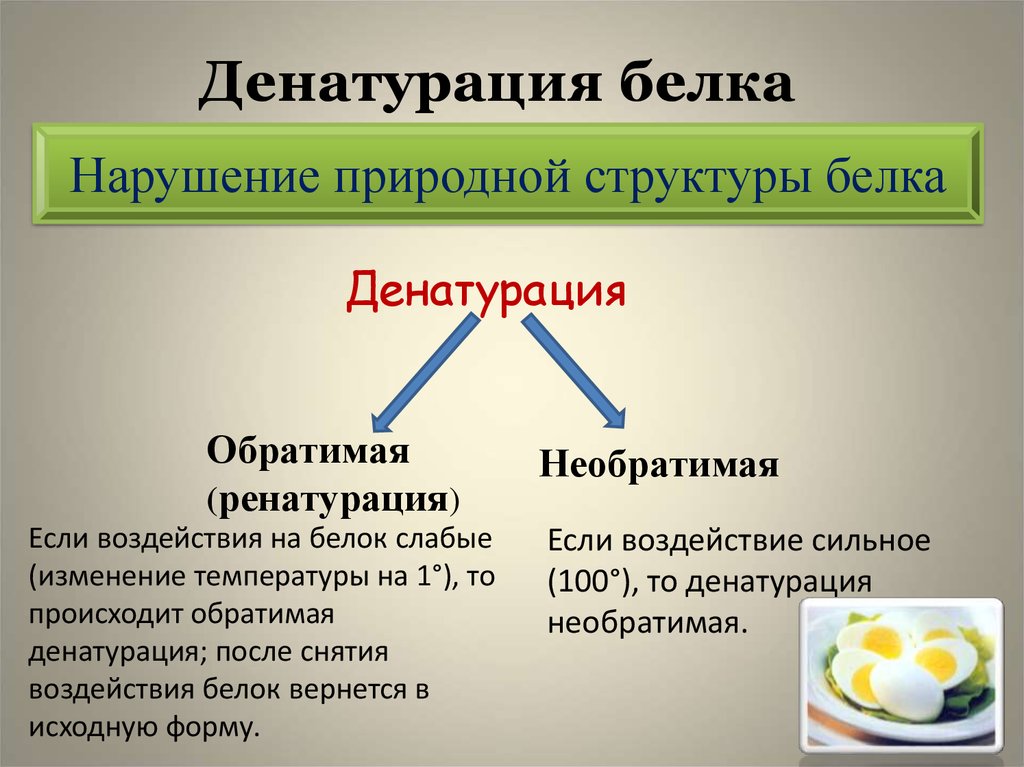 Несколькими примерами у Escherichia coli являются ДНК-полимераза I, фосфорибозилантранилатизомераза-индолглицеролфосфатсинтетаза ((1), (2)) (см. TRP Operon), аспартаткиназы-гомосериндегидрогеназы ((3), (4)) и хоризматмутаза- префенатдегидрогеназа ((5),(6)). У Neurospora crassa две функции триптофансинтазы (см. TRP Operon), а именно расщепление индолглицеролфосфата и соединение индола с серином, выполняются на одной и той же полипептидной цепи, тогда как у E. coli каждая из них выполняется независимой цепью. нековалентно связаны друг с другом. В этом случае фермент E. coli представляет собой не многофункциональный белок, а мультиферментный комплекс ((7),(8)).
Несколькими примерами у Escherichia coli являются ДНК-полимераза I, фосфорибозилантранилатизомераза-индолглицеролфосфатсинтетаза ((1), (2)) (см. TRP Operon), аспартаткиназы-гомосериндегидрогеназы ((3), (4)) и хоризматмутаза- префенатдегидрогеназа ((5),(6)). У Neurospora crassa две функции триптофансинтазы (см. TRP Operon), а именно расщепление индолглицеролфосфата и соединение индола с серином, выполняются на одной и той же полипептидной цепи, тогда как у E. coli каждая из них выполняется независимой цепью. нековалентно связаны друг с другом. В этом случае фермент E. coli представляет собой не многофункциональный белок, а мультиферментный комплекс ((7),(8)).
Другими примерами являются флавоцитохром b2 Saccharomyces cerevisiae (9), гомотетрамер, который представляет собой как l-лактат-цитохром c-оксидоредуктазу (флавопротеин), так и цитохром b 2.
1. Более двух каталитических функций могут Быть слитым в одну и ту же полипептидную цепь
ДНК-полимераза I из E. coli представляет собой мономер, обладающий тремя видами активности: ДНК-полимераза, 5′-3′-экзонуклеаза и 3′-5′-экзонуклеаза (10). Карбамилфосфатсинтетаза из клеток асцитной гепатомы представляет собой гомотетрамер, также наделенный активностью аспартатранскарбамоилазы (у E. coli эта активность осуществляется независимыми белками) ((11),(12)). У N. crassa одна полипептидная цепь, организованная в виде гомодимера, отвечает за пять биохимических реакций, ведущих к биосинтезу ароматического кольца (13). 9б6) состоит из двух многофункциональных белков. Один из полипептидов несет активность малонилтрансацетилазы, β-гидроксиацилдегидразы, еноилредуктазы и пальмитилдеацилазы, тогда как другая полипептидная цепь несет β-кетоацилсинтазу, β-кетоацилредуктазу и белок-носитель ацила. В сочетании с ацетил-КоА-карбоксилазой комплекс катализирует конденсацию ацетильных субъединиц в конечный продукт — пальмитиновую кислоту (14). Синтетаза жирных кислот птиц, которая осуществляет ту же серию реакций, представляет собой гомодимер, организованный по принципу «голова к хвосту».
coli представляет собой мономер, обладающий тремя видами активности: ДНК-полимераза, 5′-3′-экзонуклеаза и 3′-5′-экзонуклеаза (10). Карбамилфосфатсинтетаза из клеток асцитной гепатомы представляет собой гомотетрамер, также наделенный активностью аспартатранскарбамоилазы (у E. coli эта активность осуществляется независимыми белками) ((11),(12)). У N. crassa одна полипептидная цепь, организованная в виде гомодимера, отвечает за пять биохимических реакций, ведущих к биосинтезу ароматического кольца (13). 9б6) состоит из двух многофункциональных белков. Один из полипептидов несет активность малонилтрансацетилазы, β-гидроксиацилдегидразы, еноилредуктазы и пальмитилдеацилазы, тогда как другая полипептидная цепь несет β-кетоацилсинтазу, β-кетоацилредуктазу и белок-носитель ацила. В сочетании с ацетил-КоА-карбоксилазой комплекс катализирует конденсацию ацетильных субъединиц в конечный продукт — пальмитиновую кислоту (14). Синтетаза жирных кислот птиц, которая осуществляет ту же серию реакций, представляет собой гомодимер, организованный по принципу «голова к хвосту».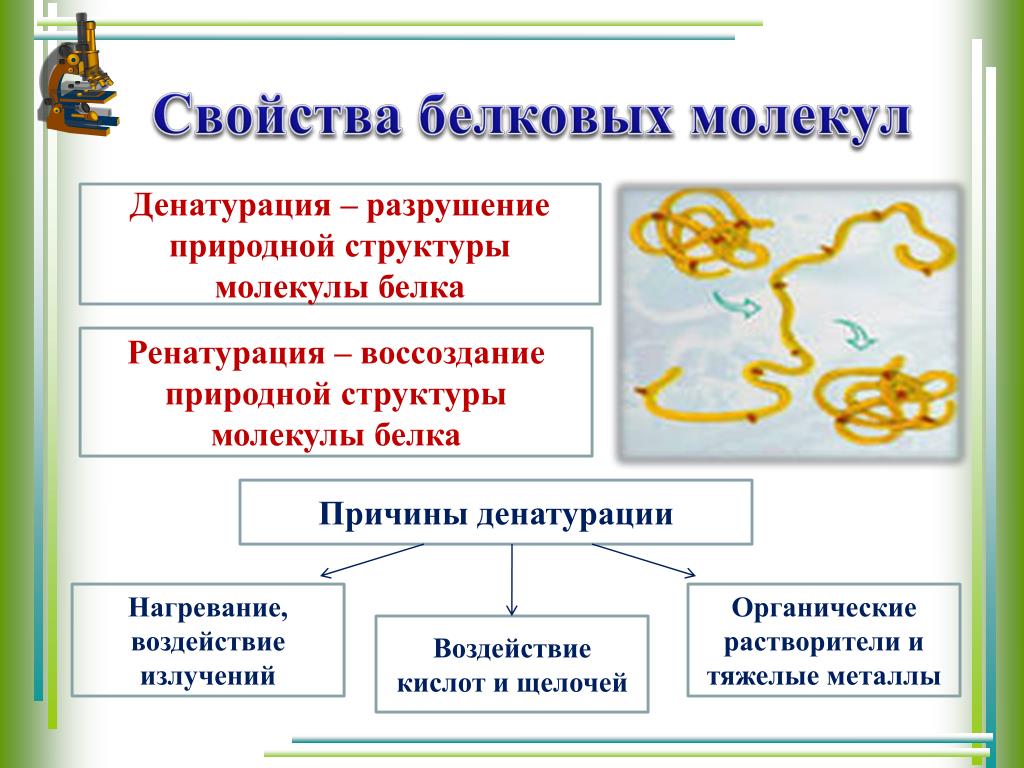 Каждый из идентичных полипептидов несет все вышеперечисленные ферменты (15).
Каждый из идентичных полипептидов несет все вышеперечисленные ферменты (15).
2. Каталитическая и некаталитическая функции могут быть слиты
В случае цитохрома b 2 из микросом печени теленка один домен белка представляет собственно цитохром b2, тогда как другой домен отвечает за якорную функцию (16) . Гомодимерный меромиозин млекопитающих имеет домен, наделенный АТФазной активностью, тогда как другой домен имеет структурную функцию (формирование толстых филаментов) (17). Дифтерийный токсин представляет собой мономер, аминоконцевая часть которого рибозилирует фактор элонгации млекопитающих, тогда как С-концевая часть отвечает за перенос каталитической части через мембрану (18). Репрессор биотина представляет собой очень интересный бифункциональный белок из 321 аминокислотного остатка, который действует на двух разных уровнях. В дополнение к своей репрессорной функции он наделен активностью холоферментсинтетазы ацетил-КоА-карбоксилазы (19).).
3.
 Некаталитические функции могут быть объединены
Некаталитические функции могут быть объединеныЧеловеческий и бычий сывороточные альбумины состоят из трех гомологичных доменов. Они наделены независимыми связывающими и транспортными функциями для триптофана, билирубина и длинноцепочечных жирных кислот (20). Репрессор Lac, гомотетрамер, имеет два независимых домена: небольшой N-концевой домен, который распознает соответствующую ДНК-оператор, и ядро, которое связывает индуктор. Аминоконцевая часть конститутивного мономера обеспечивает сборку тетрамеров (21). Другие репрессоры также имеют отдельные домены для связывания лиганда и для специфического связывания ДНК. Иммуноглобулины млекопитающих имеют отдельные сайты связывания антигена и фиксации комплемента (22).
4. Структурные доказательства многофункционального белка
1. В одной полипептидной цепи должно быть более одной функции.
2. Автономность этих функций должна быть продемонстрирована наличием различных доменов в этой полипептидной цепи.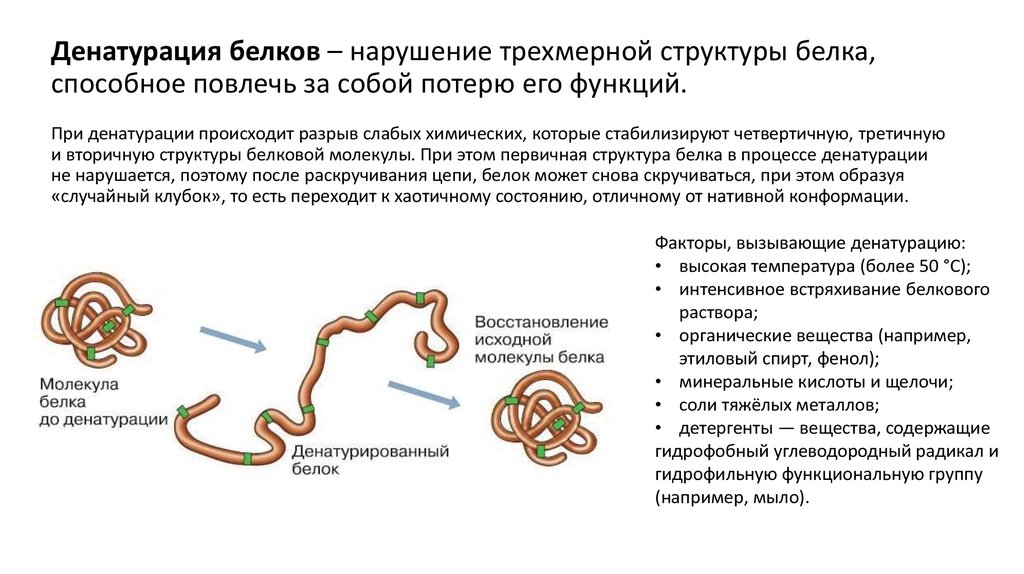 Генетический анализ может дать доказательства, если удастся выделить мутантов, дефектных только по одной функции. Одноточечные мутации могут привести к потере более чем одной функции. Однако в этом случае следует исключить плейотропные эффекты. Убедительные доказательства могут быть получены путем построения подробной генетической карты, как это сделано для нескольких ферментов E. coli ((23), (24)).
Генетический анализ может дать доказательства, если удастся выделить мутантов, дефектных только по одной функции. Одноточечные мутации могут привести к потере более чем одной функции. Однако в этом случае следует исключить плейотропные эффекты. Убедительные доказательства могут быть получены путем построения подробной генетической карты, как это сделано для нескольких ферментов E. coli ((23), (24)).
3. Методом, дающим убедительные доказательства, является выделение и характеристика фрагментов, которые сохранили свою индивидуальную функцию неповрежденной. N-концевой домен может быть получен и выделен с использованием нонсенс-мутантов. Ограниченный протеолиз также полезен, потому что шарнирный пептид, который связывает отдельные домены, часто очень чувствителен к протеолитической атаке (25).
4. Химическая модификация может влиять на одну функцию, не затрагивая другую. Например, активность аспартаткиназы I E. coli разрушается при обработке фермента сульфгидрильными реагентами, в то время как другая каталитическая активность бифункционального белка, гомосериндегидрогеназы, остается неизменной (26).
