Химические растворители: химические свойства органических растворителей
Высокая стойкость к химическому взаимодействию является важной предпосылкой для использования жидкости в качестве растворителя. Алифатические и ароматические углеводороды являются химически инертными и, следовательно, чрезвычайно хорошо удовлетворяют этому требованию.
Довольно устойчивы и спирты, однако они реагируют со щелочными, щелочноземельными металлами и с алюминием, образуя с этими веществами соли. В определенных условиях спирты можно превратить в карбоксильные кислоты путем добавления сильных окисляющих веществ. При этом они стабильны по отношению к атмосферному кислороду. Растворители, содержащие гидроксильные группы (например, спирты, гликоли и гликолевые эфиры) не должны использоваться в качестве растворителей для полиуретановых красок из-за способности реагировать с изоцианатами с образованием уретанов.
При продолжительном хранении большинство эфиров и гликолевых эфиров образуют пероксиды, взаимодействуя с атмосферным кислородом. (1/2),
(1/2),
где k — константа реакции; а — начальная концентрация сложного эфира; х — концентрация кислоты.
Например, если 44 г этилацетата растворить в 1 л воды при 20 °С, то за 130 дней гидролизуется примерно 15 г вещества. При катализе в присутствии кислоты или основания скорость реакции соответственно составляет 105 и 108.
Скорость гидролиза сложного эфира зависит от его химической структуры. При комнатной температуре скорость щелочного гидролиза изобутилацетата и бутилацетата больше, чем вторичного бутилацетата; а трет-бутилацетат еще более стабилен при воздействии щелочей (изо >п> вторичный > третичный). Скорость кислотного гидролиза бутилацетата уменьшается в следующем порядке: изо > п > третичный > вторичный.
Хлорированные углеводороды могут высвобождать хлористый водород в присутствии оснований и металлов, но добавление стабилизаторов производителями обеспечивает их высокую химическую устойчивость. Нитросоединения, диметилформамид и диметилсульфоксид являются высокостабильными растворителями, однако при продолжительном хранении на воздухе они зачастую темнеют. Перед использованием растворителя желательно ознакомиться с его химическими свойствами для того, чтобы предвидеть и объяснить предполагаемые взаимодействия с другими веществами. Существует литература, содержащая достаточно полные сведения о свойствах растворителей и химических реакциях, в которые они вступают.
Перед использованием растворителя желательно ознакомиться с его химическими свойствами для того, чтобы предвидеть и объяснить предполагаемые взаимодействия с другими веществами. Существует литература, содержащая достаточно полные сведения о свойствах растворителей и химических реакциях, в которые они вступают.
Биологические растворители — полезные статьи
Применение растворителей для промышленности растет по мере роста самой мировой промышленности, то есть постоянно. При этом сегодня большую часть растворителей составляют продукты переработки нефти и каменноугольных смол. При всех своих положительных свойствах, эти растворители не разлагаются на простейшие компоненты и остаются в природе в виде полимерных соединений, химические свойства которых позволяют им вступать в химическую реакцию с находящимися рядом веществами, а значит, продолжают разрушать экологическое равновесие планеты. Изменить или поменять свойства таких растворителей не удается, проще найти им достойную замену, а нефтяные углеводороды направить на использование в другом качестве.
Создание новых «зеленых» растворителей привело к перспективе использования в качестве всеобщих растворителей – растворителей ионных жидкостей. К ионным жидкостям относятся все расплавленные соли, однако нас интересуют только те, которые имеют температуру плавления ниже 100С. Для применения в быту наиболее подходящими являются соли, которые плавятся при комнатных температурах (английская аббревиатура – «RTIL»). Главными свойствами ионной жидкости является способность вступать в соединения с другими химическими веществами, и разрушать многие химические органические соединения. Примером таких реакций может стать разрушение молекулярной решетки жировых пятен и красок.
Область применения
- Для очистки металлических поверхностей от остатков жиров и загрязнений перед покраской;
- Для очистки трубопроводов от органических отложений в результате наслоения на стенках трубопроводов технических и пищевых жиров, например, в пунктах общественного питания, где за день сливаются в канализацию без очистки сотни килограмм отработанного растительного масла и других жиров;
- Для разложения на простейшие соединения, которые биологическим путем разлагаются на простейшие химические вещества, отходов промышленных предприятий, которые используют в своем производстве промышленные жиры;
- Для растворения таких полимеров, как нефтеуглероды и полипропилены.

Использование растворителей ионных жидкостей допускают при очистке старых канализационных труб и коллекторов от наслоения кальцинированного осадка.
Свойства растворителей ионных жидкостей
Ионные жидкости являются очень вязкими полужидкими веществами, температура кипения которых может составлять (у различных солей) до 800С. Те соли, которыми можно заинтересоваться в быту, имеют комнатную температуру кипения, благодаря чему могут переливаться в любую емкость. Жидкость бесцветна или имеет легкий желтоватый цвет, из-за наличия различных побочных соединений, без запаха. Растворитель не горит и не поддерживает горения, не токсичен, и при разложении не выделяет токсичные вещества.
Сегодня для производства растворителей ионных жидкостей применяются большие количества органических растворителей, что делает процесс производства дорогим и затратным. Однако теоретически для их производства можно использовать любые возобновляемые соединения. Проблема состоит в дороговизне очистки от сопутствующих химических элементов. Синтез растворителя очень дорого проводить для маленьких партий продукции, и начав один раз ее выпуск, необходимо организовать массовую продажу выпускаемого товара. Американская фирма Solvent innovation успешно производит и реализует «зеленый растворитель», позиционируя его на рынке под торговым названием ECOENG.
Синтез растворителя очень дорого проводить для маленьких партий продукции, и начав один раз ее выпуск, необходимо организовать массовую продажу выпускаемого товара. Американская фирма Solvent innovation успешно производит и реализует «зеленый растворитель», позиционируя его на рынке под торговым названием ECOENG.
13: Свойства растворов — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 21668
Во всех растворах, газообразных, жидких или твердых, вещество, присутствующее в наибольшем количестве, является растворителем, а вещество или вещества, присутствующие в меньших количествах, являются растворенным(ыми) веществом(ями). Растворенное вещество не обязательно должно находиться в том же физическом состоянии, что и растворитель, но физическое состояние растворителя обычно определяет состояние раствора. Пока растворенное вещество и растворитель объединяются, образуя гомогенный раствор, говорят, что растворенное вещество растворимо в растворителе.
Растворенное вещество не обязательно должно находиться в том же физическом состоянии, что и растворитель, но физическое состояние растворителя обычно определяет состояние раствора. Пока растворенное вещество и растворитель объединяются, образуя гомогенный раствор, говорят, что растворенное вещество растворимо в растворителе.
- 13.1: Процесс растворения
- Растворы представляют собой гомогенные смеси двух или более веществ, компоненты которых равномерно распределены в микроскопическом масштабе. Компонент, присутствующий в наибольшем количестве, является растворителем, а компоненты, присутствующие в меньших количествах, представляют собой растворенное вещество (растворенные вещества). Образование раствора из растворенного вещества и растворителя — это физический процесс, а не химический. Смешиваемые вещества, например газы, при смешивании образуют единую фазу во всех соотношениях. Вещества, образующие отдельные фазы, несмешиваются.
- 13.
 2: Насыщенные растворы и растворимость
2: Насыщенные растворы и растворимость - Растворимость вещества – это максимальное количество растворенного вещества, которое может раствориться в данном количестве растворителя; это зависит от химической природы растворенного вещества и растворителя, а также от температуры и давления. Когда раствор содержит максимальное количество растворенного вещества, которое может раствориться при заданном наборе условий, это насыщенный раствор. В противном случае он ненасыщенный. Пересыщенные растворы, которые содержат больше растворенного вещества, чем разрешено в определенных условиях, нестабильны.
- 13.
- 13.3: Факторы, влияющие на растворимость
- Растворимость большинства веществ сильно зависит от температуры и, в случае газов, от давления. Растворимость большинства твердых или жидких растворенных веществ увеличивается с повышением температуры. Компоненты смеси часто можно разделить с помощью фракционной кристаллизации, которая разделяет соединения в зависимости от их растворимости.

- 13.4: Способы выражения концентрации
- В зависимости от применения для выражения концентрации раствора используются различные единицы измерения. Концентрация раствора – это количество растворенного вещества в данном количестве раствора. Его можно выразить несколькими способами.
- 13.5: Коллигативные свойства
- Коллигативные свойства раствора зависят только от общего количества растворенных частиц в растворе, а не от их химической идентичности. Коллигативные свойства включают давление пара, температуру кипения, точку замерзания и осмотическое давление. Добавление нелетучего растворенного вещества (без измеримого давления паров) снижает давление паров растворителя. Давление паров раствора пропорционально мольной доле растворителя в растворе, соотношение, известное как закон Рауля.

- 13.6: Коллоиды
- Коллоид можно классифицировать как золь, дисперсию твердых частиц в жидкости или твердом веществе; гель, полутвердый золь, в котором вся жидкая фаза абсорбирована твердыми частицами; аэрозоль, дисперсия твердых или жидких частиц в газе; или эмульсия, дисперсия одной жидкой фазы в другой. Коллоид можно отличить от истинного раствора по его способности рассеивать луч света, известной как эффект Тиндаля.
- 13.E: Свойства растворов (упражнения)
- Это домашнее задание, сопровождающее текстовую карту, созданную для «Химия: центральная наука» Брауном и др.
- 13.S: Свойства растворов (резюме)
- Краткое изложение ключевых понятий в этой главе Textmap, созданной для «Химия: центральная наука» Брауном и др.
Миниатюра: раствор Нильского красного. Использование изображения с разрешения (CC BY-SA 3. 0; Armin Kübelbeck).
0; Armin Kübelbeck).
13: Properties of Solutions распространяется под лицензией CC BY-NC-SA 3.0, автором, ремиксом и/или куратором является LibreTexts.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Глава
- Лицензия
- CC BY-NC-SA
- Версия лицензии
- 3,0
- Показать страницу TOC
- № на стр.
- Теги

Физические свойства растворителей — Alfa Chemistry
| Органические растворители | Плотность (20 °C) | Температура кипения (°C) | Температура плавления (°C) ) | Вязкость (сП, °C) | Диэлектрическая постоянная (20 °C) | УФ-отсечка (нм) | Показатель преломления (20 °C) 9 0157 | Смешиваемость с водой | ||||
| 1,1,2-Трихлортрифторэтан | 1,570 | 47-48 | -35 | — | 0,69 | — | 901 97 2311,358 | X | ||||
| 1,2-дихлорбензол | 1,306 | 180 | -17 | 65 | 1,32 (25) | 9,93 (25) | 295 | 1,551 | X | |||
| 1,2-дихлорэтан | 1,256 | 83 | -35 | 15 | 0,79 | — | 225 | 1,445 | X | |||
| -2-имидазолинон (ДМИ) | 1,056 | 224-226 | 8,2 | 104 | — | — | — | 1,472 | O | |||
| 1,3-Диметил-3,4,5,6-тетрагидро-2(1Н)-пиримидинон (ДМПУ) 9015 7 | 1,060 | 146 (44 мм рт. ст.) ст.) | -20 | 121 | — | — | — | 1,488 | O | |||
| 1,4-Диоксан | 1,034 | 100-102 9 0157 | 12 | 12 | 1,44 (15) | 2,209 (25) | 215 | 352,95 | 17,80 | 215 | 1,399 | P |
| 1-хлорбутан | 0,886 | 77-78 | -123 | -6 | 0,35 | — | 225 | 9019 7 1,402X | ||||
| 1-метил-2-пирролидинон (NMP) | 1,028 | 81-82 (10 мм рт. ст.) | -24 | 86 | 1,67 (25) | 32,00 | 285 | 1,470 | O | |||
| 1-°Ctanol | 0,827 | 196 | — 15 | 81 | 10,6 (15) | — | 215 | 1,429 | X | |||
| 1-пропанол | 0,804 | 97 | -127 | 15 | 2,26 | 20,1 (25) | 210 | 1,384 | О | |||
| 2,2,4-Триметилпентан | 0,692 | 98-99 | -107 | 90 197 -70,50 | 1,94 | 215 | 1,391 | X | ||||
| 2-бутанон | 0,805 | 80 | -87 | -3 | 0,42 (15) | 18,50 901 57 | 329 | 1,379 | P | |||
| 2-хлорпиридин | 1,209 | 168 | -46 | 64 | — | — | — | 1. 532 532 | П | |||
| 0,965 | 124-125 | -85 | 46 | 1,72 | 16,90 | 210 | 1,402 | O | ||||
| 2-Метоксиэтилацетат | 1. 009 | 145 | -65 | 43 | — | — | 254 | 1.402 | П | |||
| 2-Метил-1-пропанол | 0,803 | 108 | -108 | 27 | 4,70 (15) | 15,8 (25) | 200 | 1,396 | X | |||
| 2-Метил-2-пропанол | 0,775 | 83 | 25-26 | 11 | — | — 9 0157 | 215 | 1,387 | O | |||
| 2-Метилбутан | 0,620 | 30 | — | -56 | — | — | 192 | 1,354 | X | |||
| 2-метилпиридин | 0,943 | 128-129 | -70 | 26 | — | — | — | 1,500 | O | |||
| 2-пропанол | 0,785 | 9019 7 82,4-89,5 | 22 | 2,86 (15) | 18,3 (25) | 210 | 1,377 | O | ||||
| 3-хлорпиридин | 1,194 | 148 | 66 | 65 | — | — | — | 1,533 | P | |||
| 3-Метил-1-бутанол | 0,809 | 130 | -117 | 45 | — | — | 215 | 1,4 06 | X | |||
| 3-пентанон | 0,813 | 102 | -40 | -49 | — | — | 330 | 1,392 | Х | |||
| 4-Метил-2-пентанон | 0,801 9 0157 | 117-118 | -80 | 13 | 0,58 | — | 334 | 1,396 | X | |||
| Уксусная кислота (AcOH) | 1,049 | 118 | 17 9 0157 | 40 | 1,31 (15) | 6,15 | — | 1,372 | O | |||
| Ангидрид уксусной кислоты | 1. 082 082 | 138-140 | -73 | 54 | — | — | — 901 57 | 1,390 | — | |||
| Ацетон | 0,791 | 56 | -94 | -17 | 0,32 | 20,7 (25) | 330 | 1,359 | O | |||
| Ацетонитрил | 0,786 | 82 | -48 | 5 | 0,37 | 37,50 | 190 | 1,344 | O | |||
| Бензол | 0,874 | 80 90 157 | 6 | -11 | 0,65 | 2,28 | 280 | 1,501 | X | |||
| Бензонитрил | 1,010 | 191 | -13 | 71 | 1,24 (25) | — | 300 | 1,528 | X | |||
| Бутилацетат | 0,882 | 124-126 | -78 | 22 | 0,73 | — | 254 | 1,394 | X | |||
| Сероуглерод | 1,266 | 46 | -112 | -30 | 0,37 | — | 380 | 1,627 | X | |||
| Четыреххлористый углерод 90 157 | 1,594 | 77 | -23 | — | 0,97 | 2,24 | 263 | 1.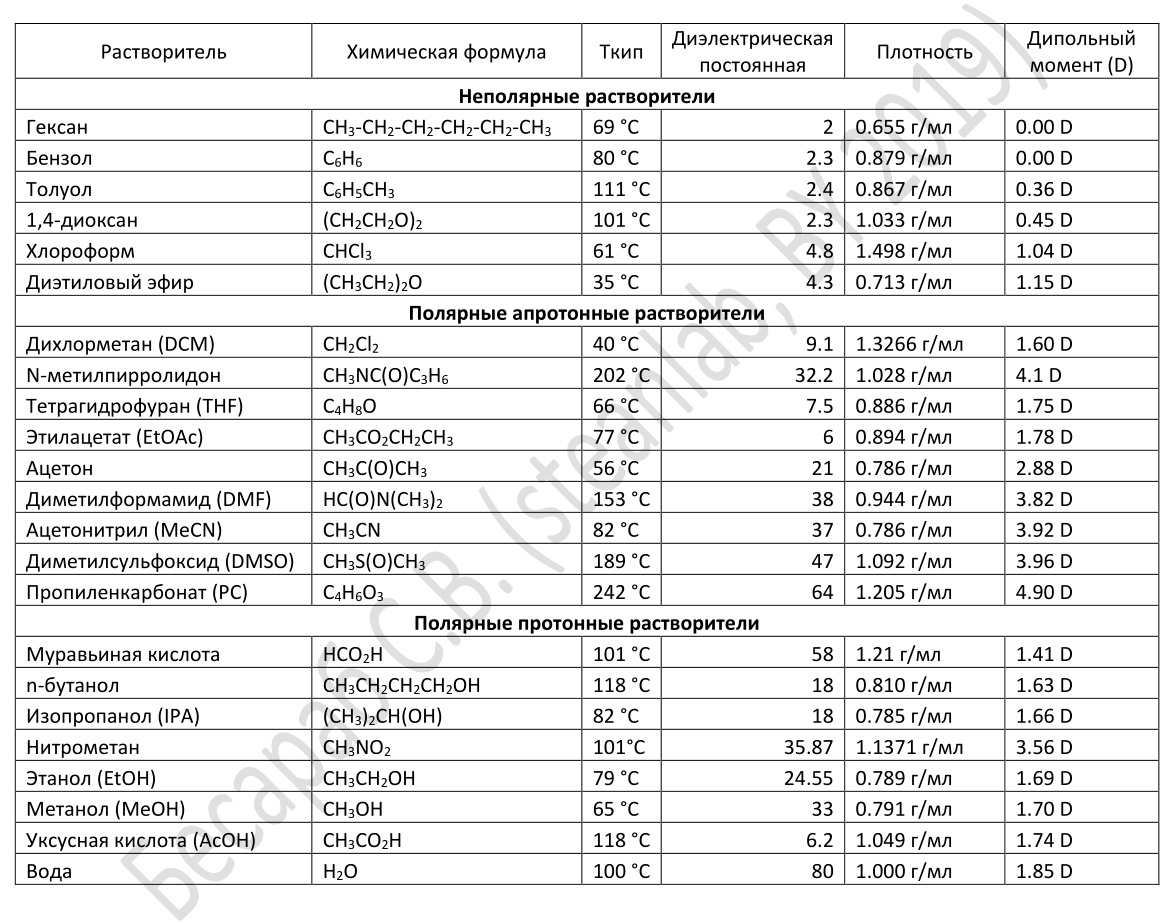 460 0,8 0 460 0,8 0 | 2,71 | 287 | 1,524 | х |
| Хлороформ | 1,492 | 61 | -64 | — | 0,58 | 4,81 | 245 | 1,446 | X | |||
| Циклогексан | 0,779 | 80 | 7 | -18 | 0,98 | 2,02 | 200 | 1,426 | X | |||
| Циклопентан | 0,751 | 50 | -94 | -37 | 0,44 | 1,97 | 200 | 1,400 | X | |||
| Ди(этиленгликоль) диэтиловый эфир | 0,909 | 180-190 | — | 71 | — | — | 260 | 1,412 | O | |||
| Дихлорметан | 1,325 | 40 | -97 | — | 0,45 (15) 9015 7 | 9,08 | 233 | 1,424 | X | |||
| Диизопропиловый эфир ( i -Pr 2 O) | 0,724 | 68,5 | -85,5 | — | 9 0197 —— | 1,368 | X | |||||
| Этиловый эфир (Et 2 О) | 0,706 | 34,6 | -116 | -40 | 0,24 | 4,34 | 2 18 | 1,353 | X | |||
| Этилацетат (EtOAc) | 0,902 | 77 | -84 | -3 | 0,46 | 6,02 (25) | 256 | 1,372 | X | 90 195|||
| Спирт этиловый (EtOH) | 0,816 | 78 | -114 | 16 | 1,10 (25) | 24,55 (25 ) | 205 | 1,363 | O | |||
| Диметиловый эфир этиленгликоля (Gly я) | 0,867 | 85 | -58 | 0 | 0,46 (25) | 7,20 (25) | 220 | 1,379 | O | |||
| Гептан | 0,684 | 901 97 98-91 | -1 | 0,42 | 1,92 | 220 | 1,387 | X | ||||
| Триамид гексаметилфосфорной кислоты (HMPA) | 1,027 | 233 | 7,2 | 106 | — | — | — | 1.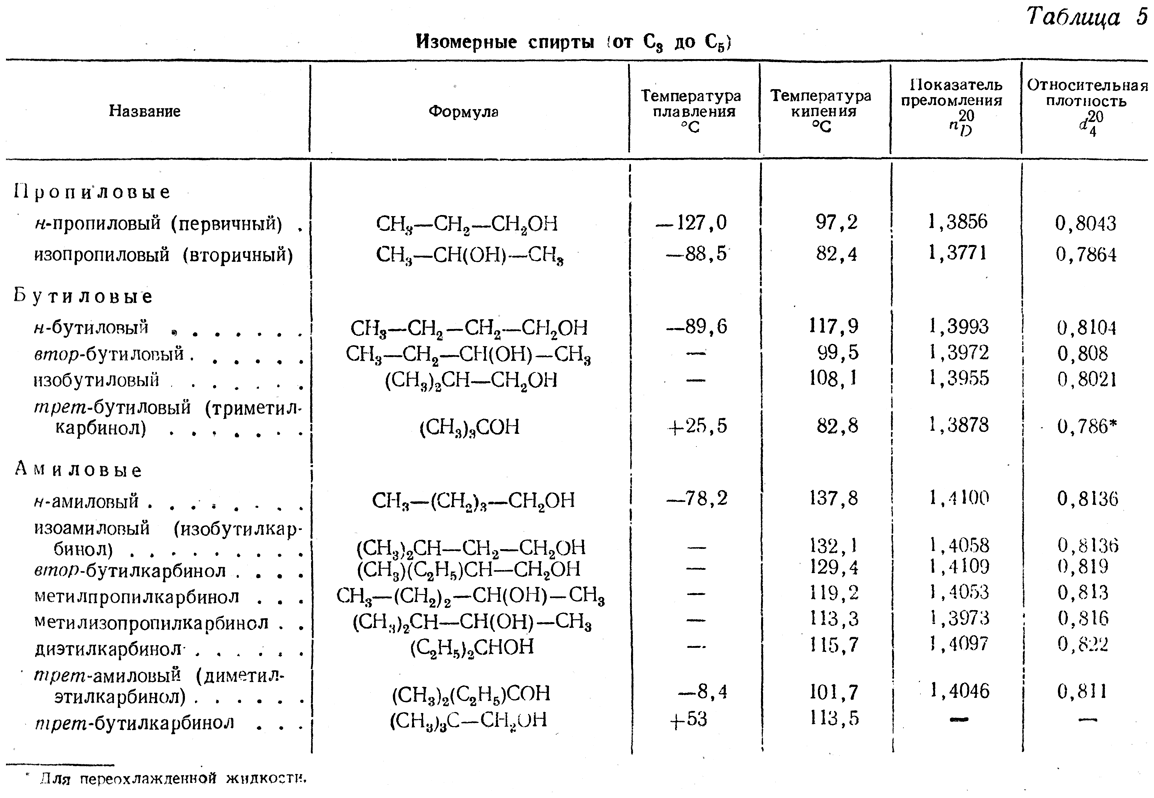 459 459 | О | |||
| Гексан | 0,659 | 69 | -95 | -23 | 0,31 | 1,89 | 200 901 57 | 1,375 | Х | |||
| Гексаны | 0,672 | 68-70 | — | — 22 | — | — | 210 | 1,379 | X | |||
| Метиловый спирт (MeOH) | 0. 791 | 64,7 | -98 | 11 | 0,55 | 32,6 (25) | 205 | 1.329 | O | |||
| Метилсульфоксид | 1.101 | 189 | 18,4 | 85 | 2,24 | — | 268 | 1,479 | П | |||
| м- Ксилол | 0,868 | 138-139 | — | 25 | — | — | — | 1,497 9015 7 | X | |||
| N,N -Диметилацетамид (DMAc) | 0,937 | 165 | -20 | 70 | 2,14 | 37,8 | 268 | 90 197 1,438O | ||||
| N,N -Диметилформид (ДМФА) | 0,944 | 153 | -61 | 57 | 0,92 | 36,7 | 268 | 1,430 | О | |||
| 1,127 | 101,2 | -29 | 35 | 0,67 | — | 380 | 1,382 | X | ||||
| o -Ксилол | 0,870 90 157 | 143-145 | -23 | 32 | 2,57 | 2,57 | 288 | 1,505 | 9 0197 X||||
| Пентан | 0,626 | 35-36 | -130 | -49 | 0,24 | 901 97 1,84200 | 1,358 | X | ||||
| Пропиленкарбонат 91,4 21 | P | |||||||||||
| p -Ксилол | 0,866 | 138 | 12 | 27 90 157 | 2,27 | 2,27 | 290 | 1,495 | X | |||
| Пиридин | 0,978 | 115 | -42 | 20 | 0,95 | 12,3 (25) | 330 | 1,510 | O | |||
| трет- -Бутилметиловый эфир | 0,740 | X | ||||||||||
| Тетрахлорэтилен | 1,623 | 121 | -22 | — | — | — | 290 | 1,506 | X | |||
| Тетрагидрофуран (ТГФ) | 0. |
