Подготовка аккумуляторных батарей КАмаЗа к работе
Категория:
Ремонт автомобилей КАмаЗ
Публикация:
Подготовка аккумуляторных батарей КАмаЗа к работе
Читать далее:
Зарядка аккумуляторных батарей КАмаЗ
Подготовка аккумуляторных батарей КАмаЗа к работе
После сборки аккумуляторные батареи подготавливают к работе. Подготовка аккумуляторных батарей к работе после ремонта заключается в приготовлении электролита, заправке его в батареи аккумулятора и зарядке.
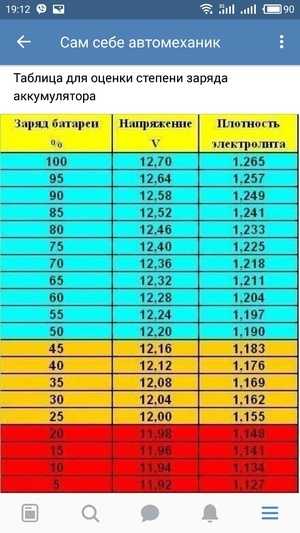
Электролит требуемой плотности для эксплуатации автомобилей в различных районах с разным температурным диапазоном приготавливают непосредственно из химически чистой серной кислоты плотностью 1,83—1,84 г/см3. Учитывая сильный разогрев раствора (до 80 °С и выше), более удобно готовить электролит требуемой плотности из заранее приготовленного раствора серной кислоты плотностью 1,40 г/см3 при 15 °С.
Плотность электролита проверяют кислотомером, как показано на рис. 88. Резиновую группу кислотомера сжимают, его наконечник опускают в заливное отверстие аккумулятора. При разжимании во внутреннюю полость стеклянного цилиндра набирается необходимое количество электролита, до всплытия ареометра, и по делениям на его трубке определяют плотность электролита.
Рекламные предложения на основе ваших интересов:
Дополнительные материалы по теме:
Плотность электролита зависит от температуры, поэтому перед измерением плотности следует предварительно измерить его температуру. Для того чтобы получить сопоставимые результаты во всех расчетах, плотность электролита- принято приводить к температуре 15 °С.
Температура электролита, заливаемого в аккумуляторы, должна быть не выше 25 °С в условиях умеренного климата и не выше 30 °С в районах с жарким климатом.
Порядок заливки электролита следующий; выворачиваются пробки из заливных горловин и электролит заливается до тех пор, пока поверхность его не коснется нижнего торца тубуса заливной горловины.
Не ранее чем через 20 мин и не позднее чем через 2 ч после заливки электролита проверяют его плотность и уровень.
Уровень электролита проверяется, как показано на рис. 2.
Электролит должен касаться нижнего торца тубуса заливной горловины. Уровень электролита можно проверить с помощью стеклянной трубки диаметром 5—6 мм. Для этого надо опустить трубку в заливную горловину аккумулятора до упора в предохранительную сетку, закрыть верхний конец трубки большим пальцем, затем вынуть ее и определить высоту столбика электролита в трубке. Уровень электролита должен быть на 10—15 мм выше предохранительной сетки. Если уровень окажется ниже, необходимо довести его до нормы доливкой дистиллированной воды при помощи резиновой груши.
Рис. 1. Проверка плотности электролита в аккумуляторной батарее:
Рис. 2. Проверка уровня электролита в аккумуляторе:
2. Проверка уровня электролита в аккумуляторе:
1 — крышка аккумулятора; 2 — воздушное пространство под крышкой; 3 — уровень эллектролнта; 4— верхний край пластин (предохранительная сетка)
Рис. 3. Определение напряжения аккумулятора нагрузочной вилкой:
а—установка нагрузочной вилки на штыри аккумулятора (нагрузочное сопротивление не включено): 1 — положительный штырь; 2 — отрицательный штырь; 3 — контакт цепи вольтметра; 4 — пружина; 5 — вольтметр; 6 — рукоятка нагрузочной вилки; 7 — направление установки нагрузочной вилки; б— определение напряжения аккумулятора под нагрузкой: 1 — направление действия силы руки при сжатии пружин для включения нагрузочного сопротивления; 2 — нагрузочное сопротивление; 3 — контакт нагрузочного сопротивления со штырем аккумулятора
Плотность электролита между банками в аккумуляторах батареи не должна отличаться более чем на 0,02 г/см3. При необходимости плотность электролита выравнивают доливкой электролита плотностью 1,4 г/см3 или дистиллированной водой.
Состояние аккумуляторной батареи можно проверить по напряжению аккумуляторов под нагрузкой. Для этого необходимо установить нагрузочную вилку на штыри аккумулятора, как показано на рис. 4, а. После этого следует нажать на рукоятку нагрузочной вилки, как показано на рис. 4, б, удерживая ее в прижатом состоянии. Напряжение определяют по вольтметру. Так же определяют напряжение и на остальных аккумуляторах. Во всех аккумуляторах напряжение должно быть не ниже 1,7 В.
Как поднять плотность электролита в аккумуляторе? — Блог
Сегодня без труда можно найти целую кипу материалов о том, как поднять плотность электролита в аккумуляторе автомобиля. К сожалению, обычный пользователь в 99% случаев наталкивается на советы о доливке или замене электролита. В итоге этот метод закрепляется в памяти, как единственно эффективный, и многие применяют его на практике. В результате вернуть аккумулятор к жизни не получается такими методами ни у кого, и пользователи поголовно покупают новый.
- Что такое плотность электролита?
- Основные причины низкой плотности электролита
- Способы поднять плотность электролита
Что такое плотность электролита?
Электролит в АКБ — это растворённая в дистиллированной воде (H2O) серная кислота (PbSO4). Плотность воды почти равна 1 г/см3. Если измерить её автолюбительским ареометром, то его поплавок полностью всплывёт, и покажет значение близкое к единице (если вода реально чистая). Плотность концентрированной серной кислоты составляет 1,83 г/см3. Если измерить её тем же ареометром, то его поплавок полностью «утонет» и покажет соответствующее значение.
Плотность электролита — это показатель того, сколько серной кислоты растворено в воде. Чем больше кислоты, тем выше плотность, и наоборот. В исправном аккумуляторе этот показатель может варьироваться в диапазоне 1,11…1,28 г/см3.
В исправном аккумуляторе этот показатель может варьироваться в диапазоне 1,11…1,28 г/см3.
Данная цифра зависит от нескольких факторов. В первую очередь, от степени заряженности аккумулятора. Если батарея заряжена на 100%, то плотность составляет 1,26…1,28 г/см3. Соответственно, если разряжена, что называется, в ноль (но не мёртвая совсем), ареометр показывает 1,10…1,11 г/см3. Если же аккумулятор совсем дохлый, например, в нём есть закороченные «банки», то именно в них может быть практически чистая вода без кислоты. То есть, плотность стремится к единице.
Как это работает на практике, и куда «отлучается» кислота из электролита, понижая его плотность? Проще всего это объяснить по вот этой упрощённой дальше некуда формуле:
Pb + PbO + H2SO4 — PbSO4 + H20,
где:
Pb — это чистый свинец, из которого сделаны «минусовые» пластины АКБ;
PbO — оксид свинца, или «плюсовые» пластины АКБ;
H2SO4 — кислота, которая есть в электролите;
PbSO4— сульфат свинца, который образуется на пластинах АКБ в виде бело-серых кристаллов;
H20 — вода.
Если читать эту формулу слева направо, то мы увидим процесс разряда аккумулятора. Кислота взаимодействует с пластинами, благодаря чему с выводов АКБ мы получаем электроэнергию. На пластинах образуется сульфат свинца в виде кристаллов, а электролит постепенно «теряет» кислоту, превращаясь в воду. Его плотность, соответственно, снижается.
Если читать формулу справа налево, то мы увидим процесс заряда аккумулятора (от генератора или зарядного устройства). Под воздействием электрического тока сульфаты свинца разрушаются, и в электролит возвращается кислота. Его плотность, соответственно, повышается.
Диванные эксперты скажут, что это неполная формула и слишком примитивное объяснение процессов, происходящих в АКБ. И это тот редкий случай, когда они будут правы. Но мы не химики, а автолюбители. И сейчас наша задача — поднять плотность электролита. А изложенной информации более, чем достаточно, чтобы решить эту задачу адекватными методами.
Основные причины низкой плотности электролита
Низкая плотность электролита — это когда в нём недостаточно кислоты.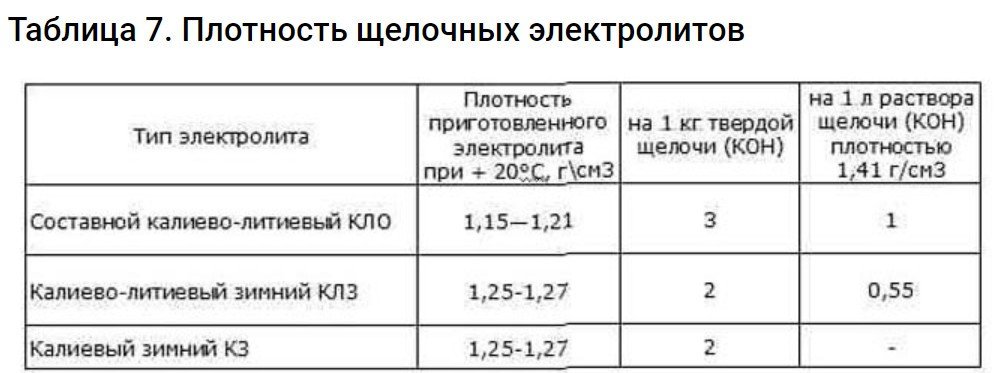 Поплавок ареометра «всплывает», и не «тонет» до зелёной зоны на шкале. Где «прячется» кислота, мы уже знаем — она превращается в сульфат свинца, и откладывается в виде кристаллов на пластинах аккумулятора. Как же поднять плотность, то есть, заставить кислоту «вернуться» в электролит и раствориться в воде?
Поплавок ареометра «всплывает», и не «тонет» до зелёной зоны на шкале. Где «прячется» кислота, мы уже знаем — она превращается в сульфат свинца, и откладывается в виде кристаллов на пластинах аккумулятора. Как же поднять плотность, то есть, заставить кислоту «вернуться» в электролит и раствориться в воде?
Чтобы ответить на этот вопрос, надо сначала выяснить, почему плотность электролита низкая. Если аккумулятор не переворачивали, не роняли, и из него ничего не проливалось — причин может быть только четыре. Рассмотрим их.
Аккумулятор разряжен
Разряд аккумулятора и снижение в результате плотности электролита — это нормальные процессы, благодаря которым мы и можем запускать двигатель. Чем больше энергии отдаёт АКБ, тем больше кислоты превращается в сульфат свинца, и тем сильнее падает плотность в ячейках. По плотности даже можно узнать, на сколько процентов разряжен или заряжен аккумулятор. Поэтому, первая причина низкой плотности — АКБ разряжена или заряжена неполностью (здесь как с наполовину пустым или полным стаканом).
Аккумулятор заряжен неправильно
Многие зарядные устройства имеют крайне примитивную схемотехнику, и заряжают аккумуляторы неправильно. Одни приборы завышают напряжение. Другие не умеют его поддерживать на нужном уровне. Третьи не могут ограничивать зарядный ток. В результате использования таких зарядных устройств аккумуляторы, в принципе, заряжаются. Но не на 100%.
Например, если не ограничивать ток заряда, и он будет слишком большим для конкретной модели АКБ, первая стадия зарядки пройдёт быстрее, чем положено. Но энергии аккумулятор накопит меньше, чем он вообще может. То есть, под воздействием тока не весь сульфат свинца успеет раствориться в воде, и повысить плотность электролита.
Если же в зарядном устройстве отсутствует стабилизация напряжения или оно даёт его слишком высокое, аккумулятор раньше времени начинает «кипеть». «Кипение» электролита — это процесс электролиза, в ходе которого вода распадается на кислород и водород, и эти вещества в газообразном состоянии безвозвратно покидают аккумулятор. В итоге, помимо того, что падает уровень электролита, не успевает подняться до нормы его плотность.
В итоге, помимо того, что падает уровень электролита, не успевает подняться до нормы его плотность.
Хотя, если измерить плотность, не доливая сначала потерянную из-за электролиза воду, то ареометр может показать даже завышенные цифры. Также уже здесь, наверное, скажем, что сразу после доливания воды в АКБ измерять плотность бессмысленно. В верхних слоях, откуда мы берём электролит ареометром, будет априори низкая концентрация кислоты. Об этом многие не знают, или забывают, из-за чего преждевременно начинают паниковать.
Всякие дешёвые зарядные устройства, позиционирующиеся, как автоматические, поголовно прекращают процесс зарядки слишком рано. То есть, они не заряжают АКБ до 100%. В результате на пластинах ещё остаётся сульфат свинца, часть кислоты в электролит не возвращается, а значит и плотность его не поднимается до нормы.
Неправильный заряд АКБ — это одна из распространённых причин низкой плотности электролита.
Сульфатация
В принципе, сульфатация в чистом виде — это такой же нормальный процесс для АКБ, как заряд и разряд. Но чаще всего этим термином обозначают так называемую необратимую сульфатацию. Это когда сульфат свинца не разрушается, и часть кислоты не возвращается в электролит. Происходит такое сплошь и рядом, а причин может быть, как минимум, две.
Но чаще всего этим термином обозначают так называемую необратимую сульфатацию. Это когда сульфат свинца не разрушается, и часть кислоты не возвращается в электролит. Происходит такое сплошь и рядом, а причин может быть, как минимум, две.
Первая причина, и она более распространена, случается тогда, когда аккумулятор долгое время находится в полностью или наполовину разряженном состоянии. В результате такой эксплуатации кристаллы солей свинца увеличиваются в размерах, и в процессе последующих зарядок разрушаются неполностью. Чем чаще и глубже аккумулятор пребывал в разряженном состоянии, тем больше и твёрже на его пластинах «налипает» нерастворимые или труднорастворимые сульфаты. То есть, часть кислоты не возвращается в электролит, даже если мы заряжаем АКБ правильно. Плотность, соответственно, не поднимается до нормы. А ещё при сульфатации аккумулятор накапливает меньше энергии, а значит снижается его ёмкость. Пусковые токи, кстати, тоже «слабеют».
Вторая распространённая причина сульфатации — это длительная эксплуатация АКБ с низким уровнем электролита. То есть, когда свинцовые пластины, на которых уже, как правило, есть сульфаты, внезапно «оголяются», и долго находятся вне электролита. Понятно, что накопленные в таких зонах сульфаты там и остаются. Более того, чем дольше они там «висят», тем прочнее и труднорастворимее они становятся. В итоге, даже когда мы доливаем воду, чтобы восполнить уровень электролита, пострадавшая от «жажды» часть пластин оказывается уже нерабочей, либо крайне неэффективной.
То есть, когда свинцовые пластины, на которых уже, как правило, есть сульфаты, внезапно «оголяются», и долго находятся вне электролита. Понятно, что накопленные в таких зонах сульфаты там и остаются. Более того, чем дольше они там «висят», тем прочнее и труднорастворимее они становятся. В итоге, даже когда мы доливаем воду, чтобы восполнить уровень электролита, пострадавшая от «жажды» часть пластин оказывается уже нерабочей, либо крайне неэффективной.
Сульфатация — это частая причина заниженной плотности электролита.
Неравномерная плотность электролита
Последняя причина низкой плотности, о которой ещё лет 20 назад никто не сталкивался — это неравномерная плотность. На практике проблема выглядит следующим образом. Когда мы заряжаем аккумулятор, плотность электролита, который находится непосредственно возле активной зоны пластин, повышается. Над пластинами же, откуда мы набираем электролит в ареометр, плотность заниженная, так как в этой зоне вышеописанные процессы не проходят.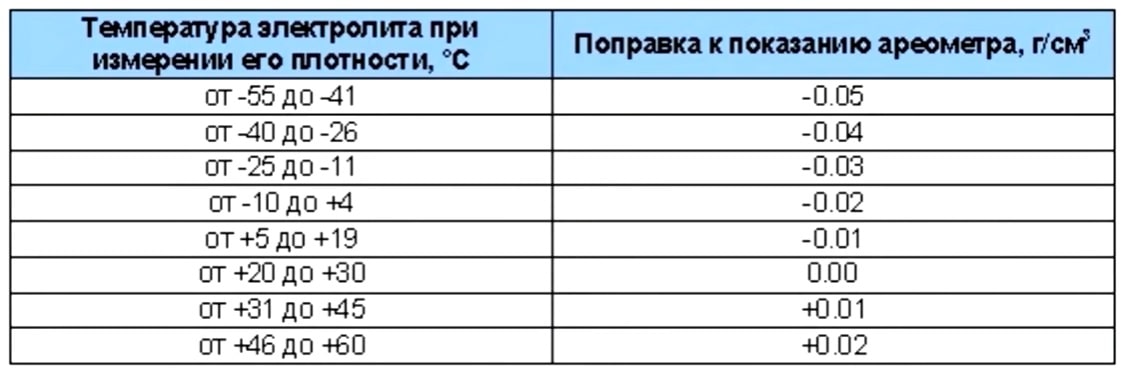
Раньше это не было проблемой, так как все аккумуляторы поголовно «закипали» даже при нормальном напряжении бортовой сети или ЗУ. Электролит активно бурлил, и нижние его слои смешивались с верхними. В результате плотность электролита выравнивалась по всему объёму ячеек и, набирая его в ареометр, мы получали удовлетворяющие нас показания. Проблема была только в том, что «кипение» является не очень полезным эффектом для АКБ. Как минимум потому, что из электролита в газообразном виде улетучивается водород и кислород, который до этого был водой. В итоге аккумуляторы сплошь и рядом эксплуатировались с низким уровнем электролита, что нехорошо отражалось на их ёмкости и ресурсе.
Сегодня эта проблема решена. Пластины современных АКБ сделаны так, что электролиз («кипение») в них начинается при напряжении, значительно превышающем норму. То есть, при обычном напряжении ЗУ или бортовой сети электролит «не кипит» никогда. Это позволило уменьшить случаи эксплуатации с низким уровнем электролита, и избавило автолюбителей от надобности постоянно доливать в АКБ дистиллированную воду. Более того, часть аккумуляторов и вовсе остались без заливных пробок, и в народе их окрестили необслуживаемыми.
Более того, часть аккумуляторов и вовсе остались без заливных пробок, и в народе их окрестили необслуживаемыми.
Одну беду побороли, но вторая пришла. Электролит во время правильной зарядки АКБ теперь «не кипит», а значит и не перемешивается. Отсюда и возникает проблема с низкой плотностью. В «дебрях» аккумулятора она, может быть, и нормальная. А вот там, где мы забираем электролит ареометром, она ниже. Более того, если электролит разной плотности так и не смешивается, в аккумуляторе происходит так называемая стратификация. То есть, простыми словами, расслоение электролита. Это тоже проблема, которой раньше не было, а сегодня она уже частично решена.
Способы поднять плотность электролита
Все вышеописанные четыре причины в большинстве случаев — устраняемы. Но это только при условии, что вы знали о них, и своевременно принимали соответствующие меры. Чаще же всего на низкую плотность обращают внимание, когда поднять её адекватными, то есть, естественными методами — сложно или даже невозможно. И тогда люди начинают чудить — сливать электролит, заливать новый, доливать концентрированную кислоту, сверлить необслуживаемые АКБ, чтобы проделать всё вышеперечисленное…
И тогда люди начинают чудить — сливать электролит, заливать новый, доливать концентрированную кислоту, сверлить необслуживаемые АКБ, чтобы проделать всё вышеперечисленное…
Так делать не стоит. Разве только ради спортивного интереса. Положительного результата эти действия не принесут, и вы, всё равно, купите новый аккумулятор. Если же ещё не поздно, и ваш аккумулятор ещё не отдал концы, плотность электролита можно повысить нормальными методами. С ними вы сейчас и познакомитесь.
Даже если у вас ничего не получится, и всё закончится покупкой нового аккумулятора, вы будете знать, как его правильно эксплуатировать, и уже он то прослужит вам положенные 5…7 лет.
Своевременная зарядка аккумулятора
Это самое главное правило эксплуатации АКБ, которое поможет не сталкиваться никогда с низкой плотностью электролита. Заключается оно в том, что уровень заряда аккумулятора следует стараться поддерживать выше отметки в 65…75%. Как только разрядился больше указанного — подзарядите.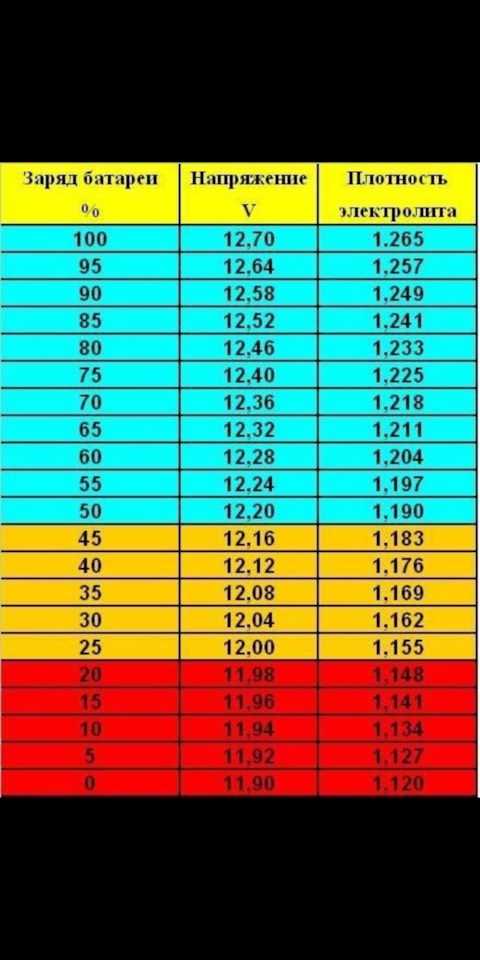 Случился глубокий разряд? Как можно быстрее зарядите. Затем выясните и устраните причину, из-за которой батарея высадилась в ноль.
Случился глубокий разряд? Как можно быстрее зарядите. Затем выясните и устраните причину, из-за которой батарея высадилась в ноль.
Самый простой способ контролировать уровень заряженности АКБ — это замер напряжения на клеммах. Если мультиметр или бортовой вольтметр показывает меньше 12,30 В — надо подзарядить. Всё просто. Но есть одна важная особенность. Оценивать уровень заряженности АКБ по напряжению можно только после того, как она постоит без дела 8…12 часов. Сразу после зарядки от ЗУ или генератора это делать бессмысленно, так как напряжение всегда будет завышенным и практически ни о чём не говорящим.
Обычно, если аккумулятор «живой», на борту присутствует не менее 14,2…14,7 В, машина ездит каждый день более, чем по часу, на улице не зима, а ток утечки в норме — подзаряжать ничего не приходится. Если же в вашем случае эти условия не выполняются, контролируйте уровень заряженности АКБ по утру хотя бы раз в неделю. Со временем, когда вы проделаете контрольные замеры несколько раз, вы будете на уровне интуиции знать, как часто ваш аккумулятор требует внимания.
Правильная зарядка АКБ
Правильно зарядить аккумуляторную батарею можно только двумя способами. Первый — купить реально толковое зарядное устройство, которое выдаёт нормальное стабильное напряжение, ограничивает ток, не вырубается раньше времени, обманывая, что АКБ заряжена на 100%. Стоят такие ЗУ недёшево, а среди дорогих попадаются «пустышки». Но хорошие есть. Это точно. Второй способ — подзаряжать аккумулятор при помощи регулируемого блока питания. При таком подходе вы сами будете решать, каким током и напряжением заряжать, и когда прекращать процесс.
Что в случае с хорошими ЗУ, что с регулируемыми блоками питания — оптимальный алгоритм зарядки выглядит следующим образом:
- На начальной стадии ток не должен превышать 10% от реальной ёмкости* АКБ (чем ток меньше, тем лучше).
- Напряжение на клеммах АКБ не должно превышать 14,4 В.
- Заряжать аккумулятор надо до тех пор, пока при указанном напряжении ток заряда не снизится до 0,1 А.

Для зарядки современных кальциевых АКБ в этот алгоритм следует добавить ещё один шаг, но о нём немного позже.
*Реальная ёмкость — это те ампер-часы, которые в действительности способен накопить ваш аккумулятор, а не те, что написаны на этикетке. Её можно измерить специальными приборами. Делается это для того, чтобы не жарить АКБ, на которой написано 60 А*ч, током 6 ампер, когда реально в ней не более 40…50 А*ч. Такое может быть как с новым аккумулятором, и гарантированно есть, если ему несколько лет.
Десульфатация или тренировка
Десульфатация или тренировка (что одно и то же) — это принудительное разрушение сульфатов свинца, которые не растворяются в ходе нормальной зарядки АКБ. Достигается несколькими методами, в частности, путём зарядки малыми токами, циклических зарядов-разрядов, а также зарядкой с кратковременной разрядкой. К сожалению, к десульфатации прибегают уже тогда, когда она аккумулятору, как мёртвому припарки. То есть, когда кристаллы сульфата свинца настолько «бронированные», что разрушить их не может даже самое умное в мире зарядное устройство.
Как выполнить десульфатацию, если у вас в наличии нет «умной» зарядки, но есть регулируемый блок питания или ЗУ с регулировками напряжения и тока? Самый простой способ представляет собой последовательность следующих шагов:
- Ограничьте ток заряда до 5% от реальной ёмкости АКБ (опять же, чем ток меньше, тем лучше, но процесс затянется по времени).
- Напряжение должно быть не более 14,4 В.
- Подготовьте обычную (не светодиодную) 12-вольтовую лампу с проводами.
- Заряжайте АКБ, не превышая указанные напряжение и ток.
- Раз в 10…30 минут (как позволяет время и желание) нагружайте на 3…5 минут АКБ лампой.
- Продолжайте заряд, пока при напряжении 14,4 В ток заряда не снизится до 0,1 А.
В принципе, положительные результаты даёт даже тренировка без лампочки. То есть, обычная зарядка пониженными токами, затем разрядка и повторение процедуры. Как правило, при каждой следующей зарядке процесс будет проходить заметно дольше. Это означает, что сульфатов стало меньше, и батарея способна накапливать больше энергии (повышается ёмкость).
Как правило, при каждой следующей зарядке процесс будет проходить заметно дольше. Это означает, что сульфатов стало меньше, и батарея способна накапливать больше энергии (повышается ёмкость).
Если десульфатация увенчалась успехом, то и плотность неминуемо повысится. При этом всё, что придётся доливать в АКБ, это исключительно дистиллированную воду. И то, только если в этом есть необходимость.
Перемешивание электролита
Проблема эта многим известна и достаточно легко устраняется без танцев с бубном. Одни производители частично решили её внесением новшеств в конструкцию АКБ. В таких аккумуляторах есть элементы, способствующие перемешиванию электролита во время движения автомобиля. Производители кальциевых АКБ предлагают в прилагаемых инструкциях смешивать электролит принудительным «кипячением». На последнем и остановимся.
Чтобы перемешать более плотный электролит с менее плотным, надо заставить его немного «покипеть». Поскольку «кипение» в данном случае вызывается ничем иным, как электролизом (а не нагревом, как в случае с приготовлением пищи), его и будем провоцировать.
Делается правильно это следующим образом:
- Заряжайте АКБ током 10% от реальной ёмкости.
- Не превышайте напряжение 14,4 В.
- Дождитесь, когда при напряжении 14,4 В ток заряда снизится до 0,1 А (первые три шага — это обычный цикл зарядки АКБ).
- Повысьте напряжение заряда до 15,5…16,1 В.
- Ток, при этом, не должен превышать 5% от ёмкости (для 60-ки 3 А).
- Контролируя температуру АКБ, заряжайте в таком режиме 20…40 минут.
- Проверяйте плотность электролита.
Если на аккумуляторе есть цветовой индикатор, то до пункта три включительно он, как правило, будет оставаться красным. Это означает, что плотность в верхних слоях АКБ не дотягивает до нормы, хотя возле пластин она, скорее всего, уже в норме. После шагов 4-5-6 индикатор позеленеет, что укажет на успешное перемешивание и выровнявшуюся плотность. Только после этого есть смысл измерять её ареометром. До «кипячения» плотность всегда будет заниженной.
Перемешаться электролит в заряженной аккумуляторной батарее может и без «кипячения» описанным способом. Плотность часто выравнивается после поездки по не очень ровным дорогам, в тот же день, или к следующему утру (индикатор внезапно зеленеет). Тем не менее, трясти АКБ в руках, чтобы смешать принудительно электролиты разной плотности, ни в коем случае нельзя. Но это уже другая история.
Итоги
Как видите, материал подошёл к концу, и в нём нет ни одного совета доливать в АКБ свежий электролит или концентрированную серную кислоту. Доливать нужно только воду, и то, если в этом есть необходимость. Если же вам ничего из вышеописанного не помогло поднять плотность, значит вашему аккумулятору пришёл конец. Вы, конечно, можете попробовать заменить электролит, долить кислоты, посверлить корпус необслуживаемой батареи, залить в АКБ воду с содой и многое другое, что советуют на просторах Интернета. Это всё будет очень интересно и познавательно, но от покупки нового аккумулятора подобные мероприятия не спасут.
В. Какова максимальная теоретическая плотность энергии в химической батарее?
$\begingroup$
Существует ли теоретический предел плотности химических батарей? Как можно их вычислить? И что мешает нам достичь этих пределов?
- энергия
- напряжение
- плотность
- аккумуляторы
- электрохимия
$\endgroup$
4
$\begingroup$
Максимальная теоретическая удельная энергия (MTSE) батареи может быть выражена как $(xE/W_t)F$ Дж/моль, где $x$ — количество молей компонента A, которое вступает в реакцию на моль B, $E$ – среднее напряжение реакции, $W_t$ – сумма молекулярных масс реагентов и $F$ константы Фарадея 96500 Кл/моль (Huggins 2008, стр. 13). Ясно, что это ограничено $E$ (<6 В из-за доступных электрохимических потенциалов элементов) и минимально возможной молекулярной массой (вот почему литий привлекателен для батарей).
Текущие литиевые батареи имеют удельную энергию в диапазоне 0,360-0,720 МДж/кг, литий-серные батареи достигают 1,26 МДж/кг, а элементы Li/CuCl$_2$ могут иметь MTSE 4,197600 МДж/кг (1166 Втч/ кг). (Huggins 2008)
Тем не менее, количество энергии, которое может быть высвобождено при сгорании материалов, в несколько раз выше: килограмм бензина содержит энергии почти в 100 раз больше, чем килограмм литий-ионной батареи. Гипотетический топливный элемент, сжигающий литий, достиг бы 40 МДж/кг, в то время как идеальная батарея имела бы MTSE < 5 МДж/кг. Частично это жульничает, конечно, забирая кислород из воздуха.
Следовательно, верхний предел удельной энергии будет определяться максимальной химической энтальпией, деленной на массу. Как отметили разработчики ракетного топлива, верхний предел энергии, хранящейся в химических системах, ограничен «пределом свободного атома», соответствующим теплоте сгорания, когда каждый атом не связан. Это примерно 41,5 МДж/кг для аллотропов азота, что является пределом возможного. Вывод состоит в том, что химические топливные элементы могут в лучшем случае достигать нескольких десятков мегаджоулей на килограмм, а батареи — около одной десятой этого.
Вывод состоит в том, что химические топливные элементы могут в лучшем случае достигать нескольких десятков мегаджоулей на килограмм, а батареи — около одной десятой этого.
Хаггинс, Р. (2008). Усовершенствованные батареи: аспекты материаловедения . Springer Science & Business Media.
$\endgroup$
0
Зарегистрируйтесь или войдите в систему
Зарегистрируйтесь с помощью Google
Зарегистрироваться через Facebook
Зарегистрируйтесь, используя адрес электронной почты и пароль
Опубликовать как гость
Электронная почта
Требуется, но никогда не отображается
Опубликовать как гость
Электронная почта
Требуется, но не отображается
Нажимая «Опубликовать свой ответ», вы соглашаетесь с нашими условиями обслуживания, политикой конфиденциальности и политикой использования файлов cookie
Вечно пять лет? Нет, аккумуляторы совершенствуются у вас под носом
Твои литий-ионные глаза —
Под капотом литий-ионные аккумуляторы за последнее десятилетие стали лучше.

Скотт К. Джонсон —
Увеличить / В каком году, опять же, Мистер Фьюжн появляется, чтобы конкурировать с Теслой и другими?
Universal Pictures
Трудно писать об исследованиях аккумуляторов в этих частях, не услышав эхо некоторых комментариев еще до того, как они будут опубликованы: Он никогда не появится на рынке. До холодного синтеза осталось 20 лет, а до новой аккумуляторной технологии — 5 лет.
Этот скептицизм понятен, когда новый дизайн батареи обещает революцию, но он рискует упустить тот факт, что батареи стали лучше . Литий-ионные батареи уже некоторое время царят — это правда. А вот «литий-ион» — это , категория батарей, которая включает в себя широкий спектр технологий, как с точки зрения батарей, используемых сегодня, так и с точки зрения батарей, которые мы использовали ранее. Многое можно сделать — и многое было сделано — — чтобы улучшить литий-ионный аккумулятор. На самом деле увеличение количества энергии, которую они могут хранить, составляло порядка пяти процентов в год. Это означает, что емкость ваших нынешних батарей более чем в 1,5 раза превышает емкость их десять лет назад.
Многое можно сделать — и многое было сделано — — чтобы улучшить литий-ионный аккумулятор. На самом деле увеличение количества энергии, которую они могут хранить, составляло порядка пяти процентов в год. Это означает, что емкость ваших нынешних батарей более чем в 1,5 раза превышает емкость их десять лет назад.
Литий-ионные аккумуляторы эволюционировали, заметили вы это или нет. Вот как.
Почему ревет Li-ion?
Полезно начать с определения того, что делает батарею «литий-ионной». Звездами шоу, очевидно, являются атомы лития, которые легко отдают электрон, образуя ионы. Каждая батарея имеет катод и анод, а между ними находится сепаратор и электролит. Со стороны катода литий находится в составе оксида металла, где он будет оставаться до тех пор, пока каждый атом удерживает этот электрон. После отделения от электрона ионы лития будут двигаться через сепаратор, чтобы собраться на аноде. Освобожденные электроны не могут пересечь сепаратор, поэтому вместо этого они движутся по любой цепи, подключенной к двум электродам батареи.
Во время зарядки ионы лития и электроны накапливаются в аноде. Во время разряда электроны проходят через цепь, а ионы лития снова проходят через сепаратор, воссоединяясь по мере того, как литий оседает обратно в структуру материала катода.
Увеличить / Вот: литий-ионный аккумулятор.
Аргоннская национальная лаборатория
Настоящая батарея состоит из трех слоев материалов: катодного материала, нанесенного на металлическую фольгу, разделительного слоя и анодного материала, нанесенного на другую металлическую фольгу. Сложите их в плоскую форму, и у вас будет аккумулятор в виде мешочка или призматического типа, который вы можете найти в своем телефоне или Chevy Bolt. Сверните слои в катушку, и у вас получится цилиндрическая батарея, как в электроинструментах или Tesla.
Реклама Вы не можете избавиться от лития и по-прежнему называть это литий-ионным аккумулятором, но все остальное — честная игра. Для катода используется множество различных материалов, и вы можете заменить сепаратор или попробовать другой химический состав для электролита.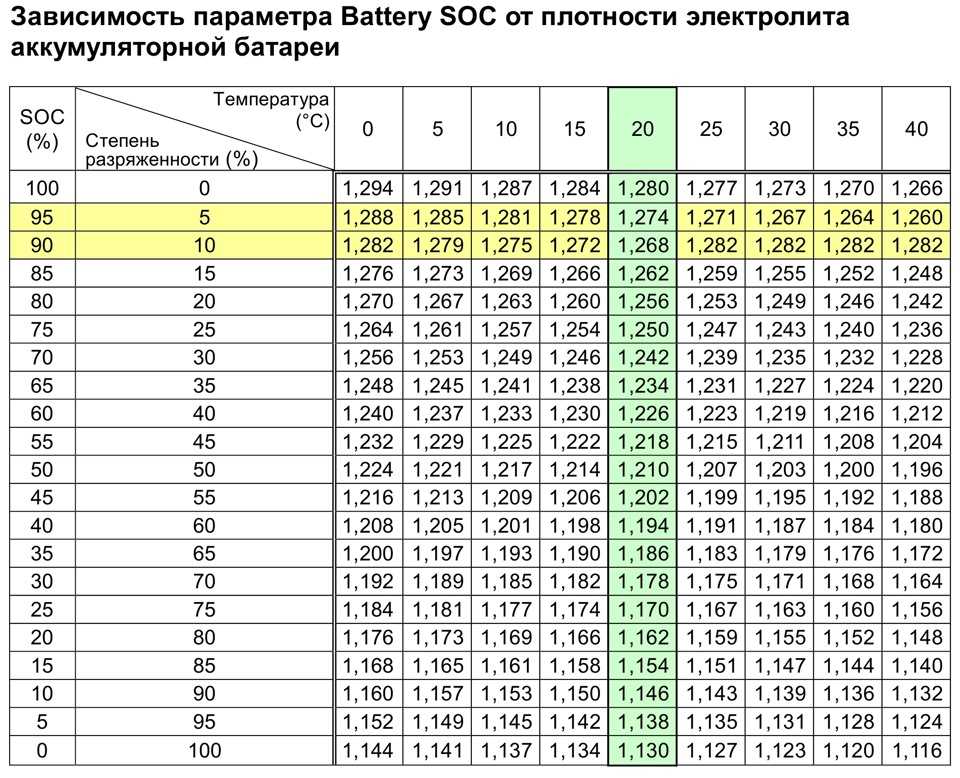 Есть даже варианты материала анода, правда, один из них долгое время доминировал.
Есть даже варианты материала анода, правда, один из них долгое время доминировал.
Первые попытки создания литий-ионных батарей пытались использовать твердый металлический литий в качестве анода, но это привело к серьезным проблемам со стабильностью. (Проблемы, над которыми до сих пор работают.) Прорывом стало использование графита для анода. Графит занимает ценное пространство, не внося дополнительной энергии, но его листовая структура обеспечивает безопасное размещение ионов лития, значительно увеличивая срок службы и безопасность. Это позволило использовать первые литий-ионные аккумуляторы Sony в 1991.
Даже первые литий-ионные аккумуляторы имели большую плотность энергии, чем никель-металлгидридные аккумуляторы, удерживая больше заряда при меньшем объеме и меньшем весе. Они также работают с более высоким напряжением элемента, что может быть полезно. Конечно, это не только солнце и единороги. Литий-ионные батареи более дорогие, а органический растворитель, используемый для электролита, легко воспламеняется, что создает опасность возгорания, которую необходимо тщательно контролировать.
Никель-металлогидридные батареи по-прежнему используются в перезаряжаемых батареях AA и AAA, а также в гибридных транспортных средствах, которым не требуется столько энергии. Но литий-ионный аккумулятор доминирует там, где пространство и вес имеют большое значение, например, в ноутбуках или электромобилях.
Очень специфический набор умений
Батареи обладают более чем одной или двумя важными характеристиками, поэтому их часто представляют в виде паутинной диаграммы (как показано ниже). «Есть плотность энергии, есть плотность мощности, есть стоимость, есть цикл жизни, есть календарная жизнь, есть безопасность», — сказал Ars Венкат Шринивасан из Аргоннской национальной лаборатории. «Что обычно происходит, так это то, что в батареях это компромисс между этими разными вещами». Даже просто придерживаясь литий-ионных аккумуляторов, существуют конфигурации и конструкции, которые могут подчеркнуть некоторые из этих характеристик за счет чего-то другого. Например, плотность энергии можно немного увеличить, но, возможно, это будет связано с более высокими затратами или сокращением срока службы.
Увеличить / Один общий набор характеристик батареи.
Аргоннская национальная лаборатория
Это может быть одной из причин разочарования или скептицизма в отношении новостей об исследованиях батарей. Исследование может определить способ значительного улучшения одной характеристики, что приведет к захватывающим выводам. Но дизайн может быть непрактично плохим в каком-то другом отношении. Хотя исследователи батарей учатся тому, что работает, а что нет, это означает, что многие лабораторные батареи, о которых вы можете прочитать, никогда не появятся на рынке.
Однако это также означает, что существует множество ручек, которые можно использовать для настройки конкретной конструкции батареи. Даже кажущиеся незначительными вещи, такие как точная толщина анодного или катодного слоя, который осаждается на его металлической фольге, могут повлиять на поведение. Например, чем толще катод относительно его подложки из фольги, тем выше плотность энергии вашей батареи, поскольку фольга занимает меньшую часть общего объема.