1)Дайте определение понятиям :раствор, растворитель, растворенное вещество. Современная классификация плазмозаменяющих растворов в медицине.
В растворах протекает большее количество химических реакций организма. Раствор – это идеальная транспортная система, которая доставляет необходимые лекарственные средства непосредственно во внутреннюю среду организма. Также растворённые препараты лучше усваиваются организмом.
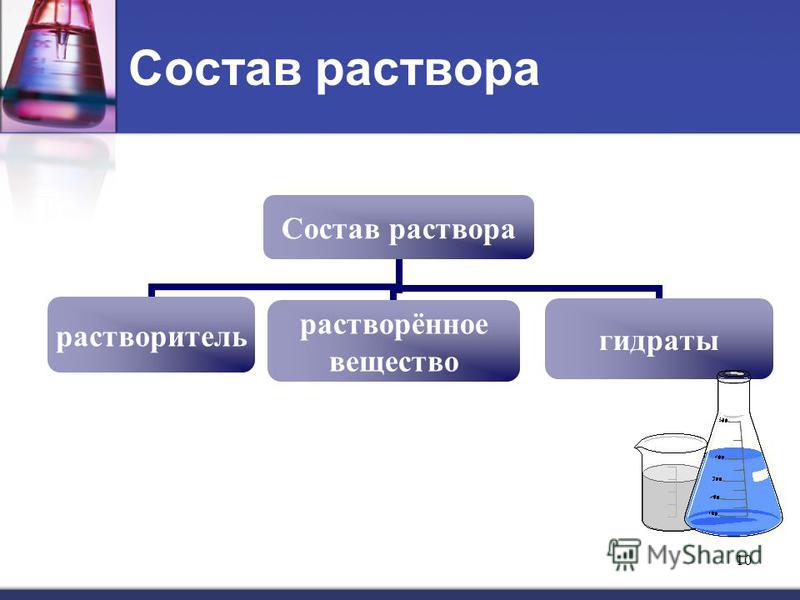
Раствор — это гомогенная система переменного состава, состоящая из двух и более независимых компонентов и продуктов их взаимодействия.
Растворитель — компонент, агрегатное состояние которого не изменяется при образовании раствора. При одинаковых агрегатных состояниях компонентов растворителем считают то вещество, содержание которого в растворе больше.
Растворенное вещество-компонент, молекулы или ионы которого равномерно распределены в объеме растворителя.
Плазмозаменяющие растворы( классификация):
1)Гемодинамические(
противошоковые) растворы — предназначены для лечения шока
различного происхождения и восстановления
гемодинамики, в том числе микроциркуляции,
при использовании аппаратов искусственного
кровообращения для разведения крови
во время операции. Например растворы
глюкозы (полиглюкин), 8% -ный раствор
расщеаленного пищевого желатина —
препарат желатиноль и др.
Например растворы
глюкозы (полиглюкин), 8% -ный раствор
расщеаленного пищевого желатина —
препарат желатиноль и др.
2)Дезинотоксикационные растворы, применяемые при интоксикации различной этилогии. К лекарственным средствам этой группы относятся такие препараты, как гемодез, неогемодез, глюконеодез и др. Помимо поливинилпирролидона в состав растворов входят ионы магния, калия, кальция, натрия и хлора.
3)Регуляторы водно-солевого баланса и кислотно-основного состояния: солевые растворы (растворы электролитов), осмотические диуретики (глицерол, маннитол и мочевина)
4)Растворы для парентерального питания, которые служат для обеспечения энергетических ресурсов организмв, доставки питательных веществ к органам и тканям. Например, растворы аминокислот, жировые эмульсии, поливитаминные комплексы и микроэлементы; комбинированные препараты.
5)Переносчики кислорода, восстанавливающие дыхательную функцию крови( растворы модифицированного гемоглобина человека; эмульсии порфторуглеродов (ПФУ) например, перфторан)
6)Комплексные
( полифункциональные) растворы,
обладающие широким диапазоном действия,
которые могут состоять из нескольки
групп плазмозаменяющих растворов.
2)Дайте определения, поясните физический смысл следующих способов выражения концентраций веществ в растворе: массовая доля, молярная концентрация, титр.
Массовая доля растворенного вещества w(Х)- величина равная отношению массы растворенного вещества m(Х) к массе раствора. Массовая доля вещества в растворе величина безразмерная, она показывает , сколько граммов растворенного вещества содержится в 100 г раствора. Используется для характеристики лекарственных препаратов, физиологических растворов.
Молярная концентрация вещества в растворе с(Х)- величина, равная отношению количества растворенного вещества к объему раствора. Молярная концентрация вещества в растворе показывает, какое количество растворенного вещества содержится в 1 л раствора. Основная единица измерения в СИ — моль/м3, на практике-моль/л. Применяется для выражения концентрации различных веществ в биологических жидкостях.
Титр растворенного
вещества T(X)- это масса растворенного
вещества Х, содержащаяся в 1 мл
раствора. Измеряется в г/см3, допускается
записать г/мл. Это способ используется
в микробиологии, общей гигиене,
иммунологии.
Измеряется в г/см3, допускается
записать г/мл. Это способ используется
в микробиологии, общей гигиене,
иммунологии.
3)
Молярная концентрация эквивалента вещества Х, с(1X) –величина, равная отношению количества вещества эквивалента n(z1X) в растворе к объему этого раствора. Запись «0,1 н. h3SO4» означает, что молярная концентрация эквивалента вещества h3SO4 равна 0,1 моль/л, т.е. в 1 л раствора содержится 0,1 моль эквивалента вещества h3SO4.
Моляльная концентрация вещества Х в растворе, сm(Х) – это величина, равная отношению количества вещества к массе растворителя. Запись «сm(h3SO4) = 0,15 моль/кг» означает, что в 1 кг раствори- теля содержится 0,15 моль вещества h3SO4.
Молярная
доля растворенного вещества N(X) – величина, равная отношению количества
вещества данного компонента к сум
марному количеству всех компонентов,
входящих в состав раствора, включая
растворитель n(A).
Эквивалент- реальная или условная частица вещества Х, которая в данной кислотно-основной реакции может присоединять, отдавать или быть каким-либо другим образом эквивалентна одному иону водорода или одному электрону в данной ОВР.
Фактор эквивалентности fэкв(Х) — число, показывающее, какая доля реальной частицы вещества Х эквивалентна одному иону водорода в данной кислотно-основной реакции или одному электрону в данной ОВР.
4)Укажите основные способы приготовления растворов. Дайте краткую характеристику этим способам.
Существует 3 способа приготовления растворов заданных концентраций: 1.Из навески твердого вещества 2.Разбавлением более концентрированного раствора. 3.Из фиксанала.
Приготовление
раствора из навески тв. вещества. 1.Рассчитать
массу вещества. 2.Сделать расчет
навески.
3.Взвесить на аналитических
весах (для приготовления первичного
стандартного раствора) или на технических
(для приготовления вторичного).
4.Перенести
навеску в мерную колбу нужного
объема.
5.Добавить воду в колбу до метки
и перемешать.
6.Стандартизировать
вторичный стандартный раствор.
2.Сделать расчет
навески.
3.Взвесить на аналитических
весах (для приготовления первичного
стандартного раствора) или на технических
(для приготовления вторичного).
4.Перенести
навеску в мерную колбу нужного
объема.
5.Добавить воду в колбу до метки
и перемешать.
6.Стандартизировать
вторичный стандартный раствор.
Приготовление раствора из фиксанала. 1.Выбрать мерную колбу в соответствии с требуемым объемом приготовляемого раствора. 2.Обмыть ампулу фиксанала и разбить бойком над воронкой в колбе. 3.Перенести содержимое ампулы через воронку в выбранную мерную колбу. 4.Промыть ампулу через воронку в колбу. 5.Добавить воду в колбу до метки и перемешать.
Приготовление
раствора разбавлением конц.
раствора. 1.Определить
плотность исходного концентрированного
раствора с помощью ареометра.
2.Сделать
расчет объема концентрированного
раствора.
3.Отмерить необходимый объем
концентрированного раствора
цилиндра.
4.Перенести концентрированный
раствор: а) в мерную колбу нужного
объема,
б) в немерную химическую посуду
для приготовления раствора с массовой
долей вещества в раствора. 5. Добавить
: а) воды в мерную колбу до метки,
б)
рассчитанный объем воды в соответствующую
химическую посуду.
6.Раствор перемешать.
5. Добавить
: а) воды в мерную колбу до метки,
б)
рассчитанный объем воды в соответствующую
химическую посуду.
6.Раствор перемешать.
5)Что такое титриметрический анализ? Какое правило лежит в основе этого метода. Укажите его математическое выражение. Какие требования предъявляют к реакциям, лежащим в основе титриметрического анализа.
Титриметрический анализ — метод количественного анализа, основанный на точном измерении объема раствора реагента, израсходованного на эквивалентное взаимодействие с определяемым веществом.
В основе анализа определяемого вещества титриаметрическим методом лежит проведение химической реакции и установление состояния эквивалентности между взаимодействующими веществами
Требования: 1.
Вещества, вступающие в реакцию должны
реагировать в строго определенных
количественных соотношениях.
2.Реакции
должны протекать быстро и количественно
, т.е быть практически необратимыми. Константа равновесия должна быть
большой.
3.Реакции должны по
возможности протекать при комнатной
температуре.
4.Точка эквивалентности
должна фиксироваться резко и точно.
5.
Титрование не должно сопровождаться
побочными реакциями.
Константа равновесия должна быть
большой.
3.Реакции должны по
возможности протекать при комнатной
температуре.
4.Точка эквивалентности
должна фиксироваться резко и точно.
5.
Титрование не должно сопровождаться
побочными реакциями.
Закон эквивалентов: В химических реакциях число моль эквивалентов всех веществ, вступивших в реакцию и образовавшихся в ней, всегда равны между собой.
Математическое выражение: С(f экв A)*V(A) = С(f экв B)*V (B)
Разница между растворенным веществом и растворителем
- 2020
Раствор и растворитель являются частью раствора, где растворенное вещество в любом растворе или смеси называется растворенным веществом, а жидкость или газ, который растворяет другую жидкость, твердое вещество или газ, называется растворителем .
Раствор может быть определен как гомогенная смесь двух или более веществ. Таким образом, в растворе вещество, которое растворяется, является растворенным, тогда как растворитель является веществом, в котором растворяется растворенное вещество. В повседневной жизни существует множество продуктов, приготовленных из смеси одного или нескольких растворенных веществ и растворителей и образующих раствор. К таким продуктам относятся лекарства, мыло, мази, чай, кофе, сок лайма и т. Д.
Таким образом, в растворе вещество, которое растворяется, является растворенным, тогда как растворитель является веществом, в котором растворяется растворенное вещество. В повседневной жизни существует множество продуктов, приготовленных из смеси одного или нескольких растворенных веществ и растворителей и образующих раствор. К таким продуктам относятся лекарства, мыло, мази, чай, кофе, сок лайма и т. Д.
Гомогенная смесь — это раствор, в котором растворенные вещества полностью и равномерно растворяются в растворе. При этом растворимость — это способность вещества растворяться в другом веществе. В этой статье мы обсудим разницу и характеристики растворенного вещества и растворителя.
Сравнительная таблица
| Основа для сравнения | растворенное вещество | растворитель |
|---|---|---|
| Смысл | Вещество, которое растворяется в растворителе в растворе, называется растворенным веществом; растворенное вещество присутствует в меньшем количестве, чем растворитель. | Вещество, которое растворяет растворенное вещество в растворе, называется растворителем; растворитель присутствует в большем количестве, чем растворитель. |
| Точка кипения | Температура кипения выше, чем у растворителя. | Это ниже, чем у растворенного вещества. |
| Физическое состояние | Найдено в твердом, жидком или газообразном состоянии. | В основном в жидком состоянии, но также может быть газообразным. |
| надежность | Растворимость зависит от свойств растворенного вещества. | Растворимость зависит от свойств растворителя. |
Определение растворенного вещества
Вещество, растворенное в растворе, называется растворенным веществом. Раствор может быть твердым, жидким или газообразным, хотя в основном это твердое соединение. Соль в морской воде, сахар в воде и кислород в воздухе — вот несколько типичных примеров растворенных веществ. Раствор растворяется в растворителе только тогда, когда силы притяжения между ними достаточно сильны, что может преодолеть молекулярные силы, удерживающие частицы, то есть частицы растворенного вещества и растворителя-растворителя вместе.
Хотя раствор содержит небольшое количество раствора, по сравнению с растворителем. Но в растворе существует условие, называемое насыщением, при котором растворитель больше не способен растворяться.
Пример растворенного вещества и растворителя можно объяснить, рассматривая чашку чая. Сухое молоко и сахар растворяют в горячей воде. Здесь горячая вода — это растворитель, а сухое молоко и сахар — это растворенные вещества.
Характеристики растворенного вещества
- Раствор имеет более высокую температуру кипения, чем растворитель.
- Они могут быть твердыми, жидкими или газовыми.
- При увеличении площади поверхности частиц растворенного вещества растворимость будет увеличиваться. Твердые частицы разбиваются на более мелкие кусочки.
- В случае газообразных растворенных веществ растворимость зависит от давления, помимо объема и температуры.
Определение растворителя
Раствор растворяется в растворителе. Его также можно определить как вещество, в котором различные вещества или соединения растворяются, превращаясь в раствор.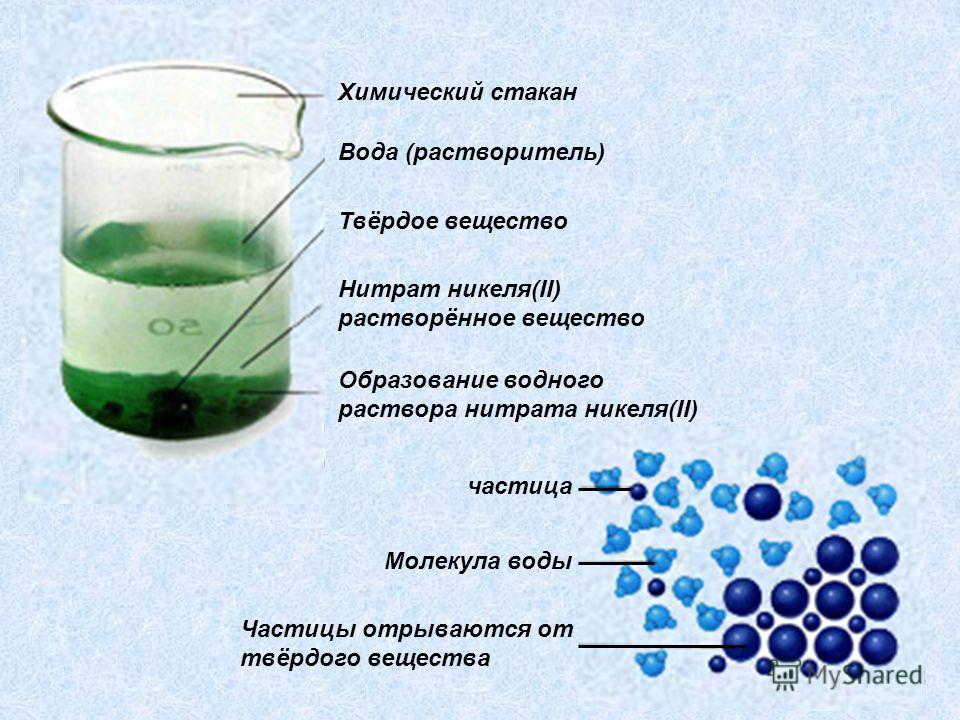 Растворитель занимает основную часть раствора. Обычно это жидкости. Говорят, что вода является наиболее распространенным растворителем в повседневной жизни, поскольку она обладает способностью растворять любые (газ, твердые или жидкие) вещества и так же называется универсальным растворителем . Основное правило растворимости — « как растворить, как ».
Растворитель занимает основную часть раствора. Обычно это жидкости. Говорят, что вода является наиболее распространенным растворителем в повседневной жизни, поскольку она обладает способностью растворять любые (газ, твердые или жидкие) вещества и так же называется универсальным растворителем . Основное правило растворимости — « как растворить, как ».
Растворители можно разделить на полярные и неполярные.
Полярные растворители имеют высокую диэлектрическую проницаемость и имеют один или несколько электроотрицательных атомов, таких как N, H или O. Спирты, кетоны, карбоновые кислоты и амиды являются общими примерами функциональной группы, присутствующей в полярных растворителях. Полярные растворители состоят из полярных молекул и могут растворять только полярные соединения.
Полярный растворитель далее делится на полярные протонные растворители и полярные апротонные растворители. Вода и метанол являются полярными протонными молекулами, поскольку они способны образовывать водородную связь с растворенными веществами. С другой стороны, ацетон считается полярным апротонным растворителем, поскольку он не способен образовывать водородную связь с растворенным веществом, но создает диполь-дипольные взаимодействия с ионными растворенными веществами.
С другой стороны, ацетон считается полярным апротонным растворителем, поскольку он не способен образовывать водородную связь с растворенным веществом, но создает диполь-дипольные взаимодействия с ионными растворенными веществами.
Неполярные растворители содержат связи со сходными электроотрицательными атомами, такими как C и H. Они состоят из неполярных молекул и могут растворять неполярные соединения или растворенные вещества.
Характеристики растворителя
- Растворитель имеет низкую температуру кипения и легко испаряется.
- Растворитель существует только в виде жидкости, но также может быть твердым или газообразным.
- Обычно используемые растворители содержат углеродный элемент и поэтому называются органическими растворителями, тогда как другие называются неорганическими растворителями.
- Растворители имеют характерный цвет и запах.
- Ацетон, спирт, бензин, бензол и ксилол являются обычно используемыми органическими растворителями и имеют большое значение в химической промышленности.

- Растворители также используются при регулировании температуры в растворе, либо для поглощения тепла, выделяемого во время какой-либо химической реакции, либо для
увеличить скорость реакции с растворенным веществом.
Ниже приведены основные различия между растворенным веществом и растворителем:
- Растворение может быть определено как вещество, которое растворяется растворителем в растворе, а вещество, которое растворяет раствор, называется растворителем . Следовательно, растворенное вещество присутствует в меньшем количестве, чем растворитель.
- Раствор может быть найден в твердом, жидком или газообразном состоянии, в то время как растворитель в основном находится в жидком состоянии, но может быть твердым или в газообразном состоянии.
состояние также. - Точка кипения выше растворенного вещества, чем растворителя. Свойства растворенного вещества и растворителя взаимозависимы.
Вывод
Растворители и растворители — это вещества, которые используются не только в химических лабораториях, но и являются частью повседневной жизни. Раствор содержит только два компонента: растворенный и растворяющий. Растворитель обладает способностью растворять растворенное вещество в гомогенном растворе.
Раствор содержит только два компонента: растворенный и растворяющий. Растворитель обладает способностью растворять растворенное вещество в гомогенном растворе.
Мы обсудили характеристики обоих веществ и пришли к выводу, что в одном растворителе могут быть разные типы растворенных веществ, которые могут образовывать гомогенный раствор.
|
Навигация: Главная Случайная страница Обратная связь ТОП Интересно знать Избранные Топ: Процедура выполнения команд. Рабочий цикл процессора: Функционирование процессора в основном состоит из повторяющихся рабочих циклов, каждый из которых соответствует… Марксистская теория происхождения государства: По мнению Маркса и Энгельса, в основе развития общества, происходящих в нем изменений лежит. Методика измерений сопротивления растеканию тока анодного заземления: Анодный заземлитель (анод) – проводник, погруженный в электролитическую среду (грунт, раствор электролита) и подключенный к положительному… Интересное: Средства для ингаляционного наркоза: Наркоз наступает в результате вдыхания (ингаляции) средств, которое осуществляют или с помощью маски… Аура как энергетическое поле: многослойную ауру человека можно представить себе подобным… Как мы говорим и как мы слушаем: общение можно сравнить с огромным зонтиком, под которым скрыто все… Дисциплины: Автоматизация Антропология Археология Архитектура Аудит Биология Бухгалтерия Военная наука Генетика География Геология Демография Журналистика Зоология Иностранные языки Информатика Искусство История Кинематография Компьютеризация Кораблестроение Кулинария Культура Лексикология Лингвистика Литература Логика Маркетинг Математика Машиностроение Медицина Менеджмент Металлургия Метрология Механика Музыкология Науковедение Образование Охрана Труда Педагогика Политология Правоотношение Предпринимательство Приборостроение Программирование Производство Промышленность Психология Радиосвязь Религия Риторика Социология Спорт Стандартизация Статистика Строительство Теология Технологии Торговля Транспорт Фармакология Физика Физиология Философия Финансы Химия Хозяйство Черчение Экология Экономика Электроника Энергетика Юриспруденция |
Стр 1 из 2Следующая ⇒ Дайте определение понятиям :раствор, растворитель, растворенное вещество. В растворах протекает большее количество химических реакций организма. Раствор – это идеальная транспортная система, которая доставляет необходимые лекарственные средства непосредственно во внутреннюю среду организма. Также растворённые препараты лучше усваиваются организмом. Раствор— это гомогенная система переменного состава, состоящая из двух и более независимых компонентов и продуктов их взаимодействия. Растворитель— компонент, агрегатное состояние которого не изменяется при образовании раствора. При одинаковых агрегатных состояниях компонентов растворителем считают то вещество, содержание которого в растворе больше. Растворенное вещество-компонент, молекулы или ионы которого равномерно распределены в объеме растворителя.
Плазмозаменяющие растворы( классификация): 1)Гемодинамические( противошоковые) растворы — предназначены для лечения шока различного происхождения и восстановления гемодинамики, в том числе микроциркуляции, при использовании аппаратов искусственного кровообращения для разведения крови во время операции. 2)Дезинотоксикационные растворы, применяемые при интоксикации различной этилогии. К лекарственным средствам этой группы относятся такие препараты, как гемодез, неогемодез, глюконеодез и др. Помимо поливинилпирролидона в состав растворов входят ионы магния, калия, кальция, натрия и хлора. 3)Регуляторы водно-солевого баланса и кислотно-основного состояния: солевые растворы (растворы электролитов), осмотические диуретики (глицерол, маннитол и мочевина) 4)Растворы для парентерального питания, которые служат для обеспечения энергетических ресурсов организмв, доставки питательных веществ к органам и тканям. Например, растворы аминокислот, жировые эмульсии, поливитаминные комплексы и микроэлементы; комбинированные препараты. 5)Переносчики кислорода, восстанавливающие дыхательную функцию крови( растворы модифицированного гемоглобина человека; эмульсии порфторуглеродов (ПФУ) например, перфторан) 6)Комплексные ( полифункциональные) растворы, обладающие широким диапазоном действия, которые могут состоять из нескольки групп плазмозаменяющих растворов.
2)Дайте определения, поясните физический смысл следующих способов выражения концентраций веществ в растворе: массовая доля, молярная концентрация, титр. Массовая доля растворенного вещества w(Х)- величина равная отношению массы растворенного вещества m(Х) к массе раствора. Молярная концентрация вещества в растворе с(Х)- величина, равная отношению количества растворенного вещества к объему раствора. Титр растворенного вещества T(X)- это масса растворенного вещества Х, содержащаяся в 1 мл раствора.
3) Молярная концентрация эквивалента вещества Х, с(1X) –величина, равная отношению количества вещества эквивалента n(z1X) в растворе к объему этого раствора. Запись «0,1 н. h3SO4» означает, что молярная концентрация эквивалента вещества h3SO4 равна 0,1 моль/л, т.е. в 1 л раствора содержится 0,1 моль эквивалента вещества h3SO4. Моляльная концентрация вещества Х в растворе, сm(Х) – это величина, равная отношению количества вещества к массе растворителя. Запись «сm(h3SO4) = 0,15 моль/кг» означает, что в 1 кг раствори- теля содержится 0,15 моль вещества h3SO4. Молярная доля растворенного вещества N(X) – величина, равная отношению количества вещества данного компонента к сум марному количеству всех компонентов, входящих в состав раствора, включая растворитель n(A). Эквивалент- реальная или условная частица вещества Х, которая в данной кислотно-основной реакции может присоединять, отдавать или быть каким-либо другим образом эквивалентна одному иону водорода или одному электрону в данной ОВР. Дайте определение понятиям :раствор, растворитель, растворенное вещество. Современная классификация плазмозаменяющих растворов в медицине. В растворах протекает большее количество химических реакций организма. Раствор – это идеальная транспортная система, которая доставляет необходимые лекарственные средства непосредственно во внутреннюю среду организма. Также растворённые препараты лучше усваиваются организмом. Раствор— это гомогенная система переменного состава, состоящая из двух и более независимых компонентов и продуктов их взаимодействия. Растворитель— компонент, агрегатное состояние которого не изменяется при образовании раствора. При одинаковых агрегатных состояниях компонентов растворителем считают то вещество, содержание которого в растворе больше. Растворенное вещество-компонент, молекулы или ионы которого равномерно распределены в объеме растворителя.
Плазмозаменяющие растворы( классификация): 1)Гемодинамические( противошоковые) растворы — предназначены для лечения шока различного происхождения и восстановления гемодинамики, в том числе микроциркуляции, при использовании аппаратов искусственного кровообращения для разведения крови во время операции. Например растворы глюкозы (полиглюкин), 8% -ный раствор расщеаленного пищевого желатина — препарат желатиноль и др. 2)Дезинотоксикационные растворы, применяемые при интоксикации различной этилогии. К лекарственным средствам этой группы относятся такие препараты, как гемодез, неогемодез, глюконеодез и др. Помимо поливинилпирролидона в состав растворов входят ионы магния, калия, кальция, натрия и хлора. 3)Регуляторы водно-солевого баланса и кислотно-основного состояния: солевые растворы (растворы электролитов), осмотические диуретики (глицерол, маннитол и мочевина) 4)Растворы для парентерального питания, которые служат для обеспечения энергетических ресурсов организмв, доставки питательных веществ к органам и тканям. 5)Переносчики кислорода, восстанавливающие дыхательную функцию крови( растворы модифицированного гемоглобина человека; эмульсии порфторуглеродов (ПФУ) например, перфторан) 6)Комплексные ( полифункциональные) растворы, обладающие широким диапазоном действия, которые могут состоять из нескольки групп плазмозаменяющих растворов.
2)Дайте определения, поясните физический смысл следующих способов выражения концентраций веществ в растворе: массовая доля, молярная концентрация, титр. Массовая доля растворенного вещества w(Х)- величина равная отношению массы растворенного вещества m(Х) к массе раствора. Молярная концентрация вещества в растворе с(Х)- величина, равная отношению количества растворенного вещества к объему раствора. Титр растворенного вещества T(X)- это масса растворенного вещества Х, содержащаяся в 1 мл раствора.
3) Молярная концентрация эквивалента вещества Х, с(1X) –величина, равная отношению количества вещества эквивалента n(z1X) в растворе к объему этого раствора. Запись «0,1 н. h3SO4» означает, что молярная концентрация эквивалента вещества h3SO4 равна 0,1 моль/л, т.е. в 1 л раствора содержится 0,1 моль эквивалента вещества h3SO4. Моляльная концентрация вещества Х в растворе, сm(Х) – это величина, равная отношению количества вещества к массе растворителя. Запись «сm(h3SO4) = 0,15 моль/кг» означает, что в 1 кг раствори- теля содержится 0,15 моль вещества h3SO4. Молярная доля растворенного вещества N(X) – величина, равная отношению количества вещества данного компонента к сум марному количеству всех компонентов, входящих в состав раствора, включая растворитель n(A). Эквивалент- реальная или условная частица вещества Х, которая в данной кислотно-основной реакции может присоединять, отдавать или быть каким-либо другим образом эквивалентна одному иону водорода или одному электрону в данной ОВР. 12Следующая ⇒ Индивидуальные и групповые автопоилки: для животных. Схемы и конструкции… Папиллярные узоры пальцев рук — маркер спортивных способностей: дерматоглифические признаки формируются на 3-5 месяце беременности, не изменяются в течение жизни. Механическое удерживание земляных масс: Механическое удерживание земляных масс на склоне обеспечивают контрфорсными сооружениями различных конструкций… Опора деревянной одностоечной и способы укрепление угловых опор: Опоры ВЛ — конструкции, предназначенные для поддерживания проводов на необходимой высоте над землей, водой… |
15.4: Раствор и растворитель — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 53840
Зимой температура часто опускается ниже точки замерзания воды. Это условие может создать проблемы в автомобильных радиаторах. Если вода замерзнет, водяные шланги порвутся, блок двигателя может треснуть, а автомобилю могут быть нанесены значительные повреждения.
Раствор и растворитель
Когда одно вещество растворяется в другом, образуется раствор . Раствор представляет собой гомогенную смесь, состоящую из растворенного вещества , растворенного в растворителе . Растворенное вещество — это растворяемое вещество, а растворитель — растворяющая среда. Растворы могут быть образованы со многими различными типами и формами растворенных веществ и растворителей.
Мы знаем много типов растворов. Посмотрите несколько примеров в таблице ниже.
| Тип | Растворитель | Растворенное вещество | Пример |
|---|---|---|---|
| газ/газ | азот | кислород | воздух |
| газ/жидкость | вода | двуокись углерода | газированная вода |
| жидкость/жидкость | вода | этиленгликоль | антифриз |
| твердое/жидкое | вода | соли | морская вода |
В этом разделе рассматриваются растворы, в которых растворителем является вода. Водный раствор – это вода, содержащая одно или несколько растворенных веществ. Растворенные вещества в водном растворе могут быть твердыми веществами, газами или другими жидкостями. Некоторые примеры перечислены в таблице выше. Другие примеры включают уксус (уксусная кислота в воде), алкогольные напитки (этанол в воде) и жидкие лекарства от кашля (различные лекарства в воде).
Водный раствор – это вода, содержащая одно или несколько растворенных веществ. Растворенные вещества в водном растворе могут быть твердыми веществами, газами или другими жидкостями. Некоторые примеры перечислены в таблице выше. Другие примеры включают уксус (уксусная кислота в воде), алкогольные напитки (этанол в воде) и жидкие лекарства от кашля (различные лекарства в воде).
Чтобы раствор был верным, смесь должна быть стабильной. Когда сахар полностью растворится в воде, он может стоять неопределенное время и сахар не осядет из раствора. Далее, если водно-сахарный раствор пропустить через фильтр, он останется неизменным. Растворенные частицы сахара будут проходить через фильтр вместе с водой. Это связано с тем, что растворенные в растворе частицы очень малы, обычно меньше \(1 \: \text{нм}\) в диаметре. Частицы растворенного вещества могут быть атомами, ионами или молекулами, в зависимости от типа растворенного вещества.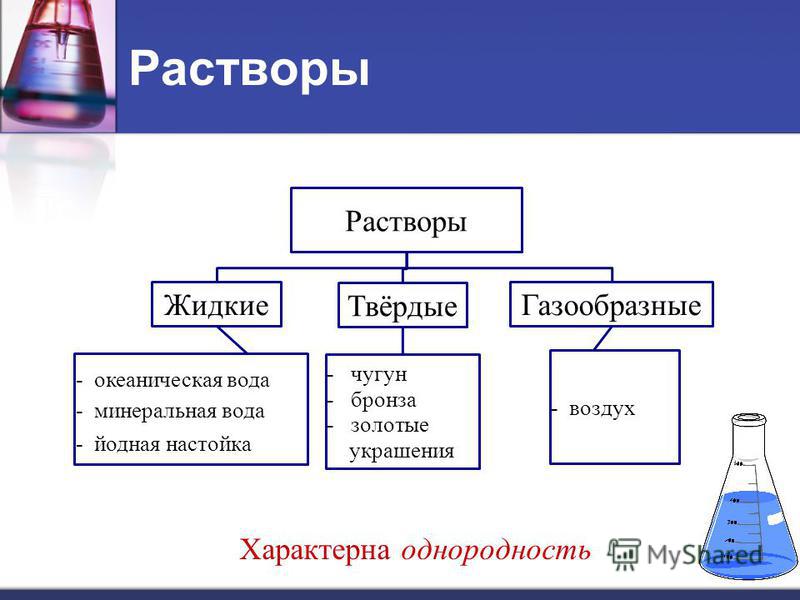
Резюме
- Раствор представляет собой гомогенную смесь растворенного вещества в растворителе.
- Растворенное вещество – это вещество, присутствующее в растворе в меньшем количестве.
- Растворитель – это вещество, присутствующее в растворе в большем количестве.
Эта страница под названием 15.4: Solute and Solvent распространяется под лицензией CK-12 и была создана, изменена и/или курирована Фондом CK-12 с использованием исходного контента, который был отредактирован в соответствии со стилем и стандартами платформы LibreTexts; подробная история редактирования доступна по запросу.
ПОД ЛИЦЕНЗИЕЙ
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Автор
- Фонд СК-12
- Лицензия
- СК-12
- Программа OER или Publisher
- СК-12
- Показать страницу TOC
- № на стр.

- Теги
- источник@https://flexbooks.ck12.org/cbook/ck-12-chemistry-flexbook-2.0/
Растворитель против растворителя — определение, 9 основных отличий, примеры
Анупама Сапкота
Содержание
Определение растворенного веществаРастворенное вещество – это вещество, которое добавляют к растворителю для образования раствора.
- Растворенное вещество может существовать во всех трех формах вещества: твердое, жидкое или газообразное.
- В гомогенной смеси растворенное вещество полностью растворяется в другом веществе, причем растворяемое вещество равномерно распределяется по всему раствору.

- В гетерогенной смеси растворенное вещество распределено неравномерно, и его концентрация различна в разных частях раствора.
- Количество растворенного вещества в растворе измеряется его концентрацией. Концентрация растворенного вещества в растворе определяется соотношением количества растворенного вещества и общего объема раствора.
- Свойство растворенных частиц растворяться в растворителе называется растворимостью. Растворимость растворенного вещества зависит от ряда факторов.
- В твердых телах и газах температура напрямую влияет на растворимость растворенного вещества. Однако давление влияет только на растворимость газов.
- Кроме того, способность твердых частиц растворяться в растворителе зависит от их собственной химической структуры. Полярное растворенное вещество растворяется в полярном растворителе и наоборот.
- Молекулярный размер растворенного вещества также важен для раствора, поскольку растворитель разрушает частицы растворенного вещества и распределяет его по раствору.

- Почти во всех типах растворов количество или объем растворенного вещества меньше, чем у растворителя.
- Частицы растворенных веществ обычно имеют более высокую температуру кипения, чем растворители.
- Примеры растворенных веществ включают соль в морской воде, протоны в цитозоле, сахар в чае и т. д.
Растворитель – это вещество, растворяющее частицы растворенного вещества при образовании раствора.
- Большинство растворителей находятся в жидком состоянии, но некоторые растворители могут находиться в газообразном или твердом состоянии.
- Растворитель расщепляет более крупные частицы растворенного вещества на более мелкие частицы, которые затем могут быть рассеяны по всему раствору.
- Растворитель образует среду раствора, которая составляет большую часть объема раствора.
- Количество растворенного вещества, которое может диспергироваться в растворителе, зависит от температуры среды.

- Раствор представляет собой гомогенную смесь, в которой частицы растворенного вещества равномерно распределены по объему растворителя. Таким образом, каждый объем растворителя в растворе имеет одинаковую концентрацию растворенного вещества.
- Растворитель и растворенное вещество в растворе существуют в виде однофазных комплексов, образующих растворенное вещество и растворитель, также известных как сольваты.
- Во время образования раствора несколько частиц растворителя окружают частицу растворенного вещества, где тепловая энергия передается от растворителя к растворенному веществу, создавая более термодинамически стабильные условия.
- Полярность частицы растворителя имеет решающее значение для определения растворимости любого растворенного вещества в растворителе.
- Вода представляет собой полярное соединение, которое также считается универсальным растворителем, растворяющим большое количество растворенных частиц.
- Большинство растворителей подразделяются на две категории: полярные и неполярные растворители.
 Ртуть образует особый тип растворителя, называемый амальгамой.
Ртуть образует особый тип растворителя, называемый амальгамой. - Температура кипения растворителя ниже, чем у растворенного вещества.
- Примеры растворителя включают воду, углеводороды, спирты, сложные эфиры и т. д.
| База для сравнения | Раствор | Растворитель |
| Определение | Растворенное вещество — это вещество, которое добавляют к растворителю с образованием раствора. | Растворитель – это вещество, растворяющее частицы растворенного вещества при образовании раствора. |
| Фаза | Растворенное вещество представляет собой дисперсную фазу раствора. | Растворитель представляет собой среднюю фазу раствора, которая диспергирует частицы растворенного вещества. |
| Количество | Количество растворенного вещества меньше количества растворителя в растворе. | Количество растворителя больше, чем растворенного вещества в растворе. |
| Физическое состояние | Растворенное вещество может существовать в твердом, жидком или газообразном состоянии. | Большинство растворителей находятся в жидком состоянии, но некоторые растворители могут существовать в газообразном состоянии. |
| Состояние раствора | Раствор может находиться или не находиться в состоянии растворенного вещества. | Раствор почти наверняка находится в состоянии растворителя. |
| Температура кипения | Растворенное вещество имеет более высокую температуру кипения, чем растворитель. | Растворители имеют более низкую температуру кипения, чем растворенные вещества. |
| Растворимость | Растворимость растворенного вещества зависит от свойств растворенного вещества, таких как площадь поверхности и размер молекул. | Растворимость зависит от свойств растворителя, таких как его полярность. |
| Теплообмен | В растворе тепло передается растворенному веществу. | В растворе тепло передается от растворителя. |
| Примеры | Примеры растворенных веществ включают соль в морской воде, протоны в цитозоле, сахар в чае и т. д. | Примеры растворителя включают воду, углеводороды, спирты, сложные эфиры и т. д. |
- Соль является растворенным веществом, а вода является растворителем в морской воде.
- Соль NaCl представляет собой ионное соединение, в котором отрицательно заряженный ион хлорида притягивается слегка положительно заряженным атомом водорода воды. Аналогичное притяжение происходит между атомами натрия и кислорода.
- Это притяжение вызывает расщепление NaCl на более мелкие частицы, которые затем рассеиваются по воде.

- Диапазон растворимости и период времени зависят от площади поверхности частицы растворенного вещества.
- Таким образом, крупные соли растворяются в меньшей степени, чем более мелкие соли с большей площадью поверхности.
- Когда вся соль растворится, в растворе не будет видно кристаллов соли.
Читайте также: Кислоты и основания Льюиса
Протоны в цитозоле- Протоны или Н + присутствуют в цитоплазме клетки, что помогает поддерживать рН раствора.
- Эти протоны притягиваются атомом кислорода молекул воды и, таким образом, играют существенную роль в трансмембранном транспорте молекул.
- Мембраны проницаемы для воды, но не для протонов. В результате молекулы воды могут свободно пересекать мембрану.
- Благодаря притяжению между молекулами воды и протонами создается протонная движущая сила.
- Затем протонная движущая сила может быть использована для транспорта различных веществ через мембрану.

- Вода считается универсальным растворителем, так как она растворяет широкий спектр растворенных частиц.
- Вода является основой многих биологических растворов, которые переносят важные частицы и перемещают их по всему телу.
- Вода является полярным растворителем, в котором атом кислорода несет частичный отрицательный заряд, а атом водорода несет частичный положительный заряд.
- Полярность молекул воды делает ее очень совместимой с некоторыми молекулами растворенных веществ.
- Одним из наиболее важных примеров воды в качестве растворителя является морская вода. Морская вода несет в себе большое количество соли, растворенной в воде.
- Масло также выступает в качестве растворителя при приготовлении пищи, предотвращая прилипание полярных и полярных растворенных веществ к сковороде.
- Горячее масло создает раствор, в котором можно приготовить другие продукты.

- Масло содержит некоторое количество растворенного вещества, которое затем можно добавить в готовящуюся пищу.
- Масло представляет собой органическое соединение и пример неполярного растворителя, который позволяет распределять неполярные молекулы растворенного вещества по всему раствору.
- По сравнению с другими нефтяными растворителями растительное масло считается нелетучим органическим соединением (ЛОС), обладающим высокой растворяющей способностью и температурой воспламенения, а также низкой токсичностью и меньшим воздействием на окружающую среду.
Yara-Varón, E., Li, Y. , Balcells, M., Canela-Garayoa, R., Fabiano Tixier, A.S., и Chemat, F. (2017). Растительные масла как альтернативные растворители для экстракции зеленого олео, очистки и приготовления пищевых и натуральных продуктов. Molecules (Базель, Швейцария) , 22 (9), 1474. https://doi.org/10.3390/molecules22091474.
, Balcells, M., Canela-Garayoa, R., Fabiano Tixier, A.S., и Chemat, F. (2017). Растительные масла как альтернативные растворители для экстракции зеленого олео, очистки и приготовления пищевых и натуральных продуктов. Molecules (Базель, Швейцария) , 22 (9), 1474. https://doi.org/10.3390/molecules22091474.
- 2%
- 1% – https://www.vequill.com/solute-vs-solvent/
- 1% – https://www.answers.com/Q/How_does_the_boiling_point_of_a_solution_compare_to_the_boiling_point_of_the_pure_solvent
- 1% — https://www.answers.com/Q/Amount_of_a_solute_that_can_be_dissolved_in_a_solvent
- 1% – https://quizlet.com/123513907/science-lesson-2-chpt-13-flash-cards/
- 1% – https://pediaa.com/difference-between-solvent-and-solute/
- 1% – https://in.answers.yahoo.com/question/index?qid=20091123053727AAGxb2n
- 1% – https://chem.libretexts.org/Bookshelves/Organic_Chemistry/Map%3A_Organic_Chemistry_(Smith)/Chapter_01%3A_Structure_and_Bonding/1.
 12%3A_Polarity_of_Molecules
12%3A_Polarity_of_Molecules - 1% – https://brainly.com/question/7437740
- 1% – https://biologydictionary.net/solute/
- 1% – http://biologyaspoetry.com/terms/proton_motive_force.html
- <1% — https://www.youtube.com/watch?v=E-M8JcYr2d4
- <1% — https://www.wikihow.com/Calculate-the-Concentration-of-a-Solution
- <1% — https://www.quora.com/What-is-the-difference-between-a-solute-solvent-and-solution
- <1% – https://www.khanacademy.org/science/biology/water-acids-and-bases/hydrogen-bonding-in-water/a/water-as-a-solvent
- <1% – https://web.viu.ca/krogh/chem331/SOLUBILITY%202010.pdf
- <1% – https://quizlet.com/11495145/chemistry-solutions-flash-cards/
- <1% — https://physics.stackexchange.com/questions/198213/how-does-the-dissolution-of-salt-affect-the-solution-density
- <1% – https://pharmlabs.unc.edu/labs/solubility/structure.htm
- <1% — https://en.wikipedia.org/wiki/Solid_solubility
- <1% – https://byjus.
 com/chemistry/solute/
com/chemistry/solute/ - <1% – https://biodifferences.com/difference-between-solute-and-solvent.html
- <1% — http://colaistechiaraineolaiocht.weebly.com/uploads/2/4/7/2/24726104/particle_theory_dissolving_worksheet.pdf
Разница между растворителем и растворенным веществом
29 августа 2017 г.
от Madhusha
Чтение через 5 мин.
Основное отличие — растворитель против растворенного вещества
Раствор — это форма материи, которая находится в жидком физическом состоянии. Он состоит из двух компонентов: растворителя и растворенного вещества. Раствор представляет собой гомогенную смесь растворителя и растворенного вещества. Растворенное вещество растворяется в растворителе. Общие свойства раствора зависят от таких факторов, как тип растворителя, тип раствора, количество растворенного вещества, присутствующего в растворе, и т. д. Этими свойствами могут быть либо химические свойства, такие как температура кипения раствора, либо физические свойства, такие как плотность. , цвет и т. д. Основное различие между растворителем и растворенным веществом состоит в том, что растворитель — это вещество, в котором растворено растворенное вещество, тогда как растворенное вещество — это вещество, которое может растворяться в растворителе.
, цвет и т. д. Основное различие между растворителем и растворенным веществом состоит в том, что растворитель — это вещество, в котором растворено растворенное вещество, тогда как растворенное вещество — это вещество, которое может растворяться в растворителе.
Ключевые области, охватываемые
1. Что представляет собой растворитель
— Определение, объяснение свойств с примерами
2. Что является растворенным
4468 — Определение. , В чем разница между растворителем и растворенным веществом
– Сравнение ключевых различий
Ключевые термины: плотность, гомогенность, раствор, раствор, растворитель
Что такое растворитель сформировать раствор. Поэтому растворитель часто является основным компонентом раствора. Соединения, которые можно растворить в растворителе, зависят от свойств этого растворителя. Решения встречаются в основном двух типов.

Полярные растворители
Полярные растворители состоят из полярных молекул. Эти растворители могут растворять полярные соединения.
Неполярные растворители
Неполярные растворители состоят из неполярных молекул. Поэтому эти растворители могут растворять неполярные соединения.
Когда соединения растворяются в растворителе, смесь растворителя и этого растворенного соединения называется раствором. Химические и физические свойства этого раствора отличаются от свойств растворителя. Некоторые растворители окрашены, а другие бесцветны. Некоторые растворители легко воспламеняются, а другие менее или не воспламеняются. Некоторые растворители быстро испаряются, в то время как другие растворители не испаряются.
Рисунок 1: Растворители можно использовать для растворения различных химических соединений.
Например, давайте рассмотрим чашку чая. Здесь чай является решением. Сахар и сухое молоко растворяют в горячей воде. Поэтому горячая вода здесь является растворителем. В лабораториях органической химии очистка соединения путем перекристаллизации является обычным экспериментом. В этом эксперименте нечистое соединение растворяется в растворителе, и растворитель растворяет только те соединения, которые необходимо очистить от смеси, а примеси удаляются путем фильтрации. Таким образом, определение лучшего растворителя для перекристаллизации очень важно в этом эксперименте. Вода является лучшим и наиболее распространенным растворителем для многих целей.
В лабораториях органической химии очистка соединения путем перекристаллизации является обычным экспериментом. В этом эксперименте нечистое соединение растворяется в растворителе, и растворитель растворяет только те соединения, которые необходимо очистить от смеси, а примеси удаляются путем фильтрации. Таким образом, определение лучшего растворителя для перекристаллизации очень важно в этом эксперименте. Вода является лучшим и наиболее распространенным растворителем для многих целей.
Что такое растворенное вещество
Растворенное вещество — это вещество, которое можно растворить в растворе. Растворенное вещество может быть как твердым, так и жидким. В большинстве случаев это твердое соединение. Концентрация раствора – это количество присутствующего растворенного вещества по отношению к количеству растворителя. Однако растворенное вещество является второстепенным компонентом раствора.
Когда растворенное вещество растворяется в растворе, химические и физические свойства этого раствора соответственно изменяются. Иногда растворитель может состоять из разных растворенных веществ. Когда водорастворимое ионное соединение растворяется в воде, это соединение разделяется на его водные ионы. Тогда это ионное соединение является растворенным веществом этого раствора. Когда ковалентное соединение растворяется в растворе, оно разделяется на свои молекулы.
Иногда растворитель может состоять из разных растворенных веществ. Когда водорастворимое ионное соединение растворяется в воде, это соединение разделяется на его водные ионы. Тогда это ионное соединение является растворенным веществом этого раствора. Когда ковалентное соединение растворяется в растворе, оно разделяется на свои молекулы.
Рисунок 2: Соль может растворяться в воде. Здесь соль является растворенным веществом, а вода — растворителем.
Растворенные вещества могут быть как полярными, так и неполярными. Полярные растворенные вещества могут быть растворены в полярных растворителях, тогда как неполярные растворенные вещества могут быть растворены в неполярных растворителях. Растворенные вещества обычно имеют более высокие точки кипения по сравнению с растворителями. Растворимость растворенного вещества может зависеть от температуры, типа используемого растворителя и площади поверхности растворенного соединения. Следовательно, мы можем увеличить растворимость растворенного вещества в подходящем растворителе, увеличив площадь поверхности.
Разница между растворителем и растворенным веществом
Определение
Растворитель: Растворитель — это вещество, в котором можно растворить различные соединения, чтобы получить раствор.
Растворенное вещество: Растворенное вещество — это вещество, которое можно растворить в растворе.
Физическое состояние
Растворитель: Растворители почти все время находятся в жидкой фазе, но также могут быть твердые или газообразные растворители.
Раствор: Растворенные вещества находятся в твердой, жидкой или газообразной фазе.
Растворимость
Растворитель: Растворимость растворенного вещества в растворителе зависит от свойств растворителя, таких как полярность.
Растворенное вещество: Растворимость растворенного вещества в растворителе зависит от свойств растворенного вещества, таких как площадь поверхности растворенного вещества.
Температура кипения
Растворитель: Температура кипения растворителя обычно ниже, чем у растворенного вещества.
Раствор: Температура кипения растворенного вещества обычно выше, чем у растворителя.
Заключение
Раствор состоит из двух компонентов: растворенных веществ и растворителя. Растворитель является основным компонентом, тогда как растворенное вещество является второстепенным компонентом. Основное различие между растворителем и растворенным веществом заключается в том, что растворитель — это вещество, в котором растворено растворенное вещество, тогда как растворенное вещество — это вещество, которое может растворяться в растворителе.
Ссылки:
1. «Обзор растворителя и растворенного вещества и их основных различий». ScienceStruck, доступно здесь. По состоянию на 17 августа 2017 г.
2. Хельменстин, Энн Мари. «Что такое растворенное вещество? Определение и примеры». ThoughtCo, доступно здесь.


 ..
..
 Современная классификация плазмозаменяющих растворов в медицине.
Современная классификация плазмозаменяющих растворов в медицине. Например растворы глюкозы (полиглюкин), 8% -ный раствор расщеаленного пищевого желатина — препарат желатиноль и др.
Например растворы глюкозы (полиглюкин), 8% -ный раствор расщеаленного пищевого желатина — препарат желатиноль и др.

 Например, растворы аминокислот, жировые эмульсии, поливитаминные комплексы и микроэлементы; комбинированные препараты.
Например, растворы аминокислот, жировые эмульсии, поливитаминные комплексы и микроэлементы; комбинированные препараты.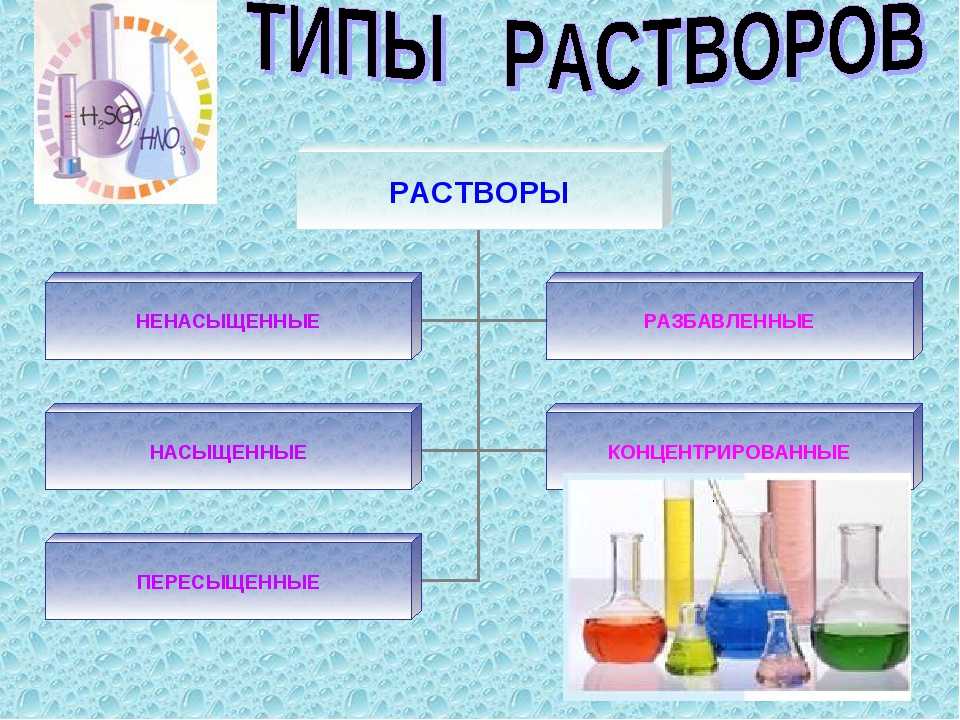
 ..
..



 Ртуть образует особый тип растворителя, называемый амальгамой.
Ртуть образует особый тип растворителя, называемый амальгамой.


 12%3A_Polarity_of_Molecules
12%3A_Polarity_of_Molecules com/chemistry/solute/
com/chemistry/solute/